Рак легких - Lung cancer - Wikipedia
| Рак легких | |
|---|---|
| Другие имена | Карцинома легкого |
 | |
| А рентгенограмма грудной клетки показывает опухоль в легком (отмечена стрелкой) | |
| Специальность | Онкология Пульмонология |
| Симптомы | Кашляющий (включая кровохарканье ), потеря веса, одышка, боли в груди[1] |
| Обычное начало | ~ 70 лет[2] |
| Типы | Мелкоклеточный рак легкого (SCLC), немелкоклеточный рак легкого (НМРЛ)[3] |
| Факторы риска | |
| Диагностический метод | Медицинская визуализация, биопсия ткани[6][7] |
| Профилактика | Не курить, избегать асбест контакт |
| Уход | Хирургия, химиотерапия, лучевая терапия[7] |
| Прогноз | Пятилетняя выживаемость 19,4% (США)[2] 41,4% (Япония)[8] |
| Частота | 3,3 миллиона пострадавших по состоянию на 2015 год[9] |
| Летальные исходы | 1,7 миллиона (2015)[10] |
Рак легких, также известный как карцинома легких,[7] злокачественный опухоль легкого характеризуется неконтролируемым рост клеток в ткани из легкое.[11] Этот рост может распространяться за пределы легких в результате метастаз в близлежащие ткани или другие части тела.[12] Наиболее раки которые начинаются в легких, известные как первичный рак легких, карциномы.[13] Два основных типа: мелкоклеточный рак легкого (SCLC) и немелкоклеточный рак легкого (НМРЛ).[3] Самый распространенный симптомы кашляют (в том числе кровохарканье ), похудание, одышка и боли в груди.[1]
Подавляющее большинство (85%) случаев рака легких связаны с долгосрочными заболеваниями. курение табака.[4] Около 10–15% случаев возникают у людей, которые никогда не курили.[14] Эти случаи часто вызваны сочетанием генетические факторы и воздействие радон газ асбест, пассивное курение, или другие формы загрязнение воздуха.[4][5][15][16] Рак легких можно увидеть на рентгенограммы грудной клетки и компьютерная томография (КТ) сканирование.[7] В диагноз подтверждается биопсия который обычно выполняется бронхоскопия или CT-наведение.[6][17]
Избегание факторов риска, включая курение и загрязнение воздуха, является основным методом профилактики.[18] Лечение и долгосрочные результаты зависят от типа рака, сцена (степень распространения) и общее состояние здоровья человека.[7] Большинство случаев неизлечимы.[3] Общие методы лечения включают: хирургия, химиотерапия, и лучевая терапия.[7] НМРЛ иногда лечат хирургическим путем, тогда как МРЛ обычно лучше реагирует на химиотерапию и лучевую терапию.[19]
Во всем мире в 2012 году рак легких заболел 1,8 миллиона человек и привел к 1,6 миллиона смертей.[13] Это делает его самой частой причиной смерти от рака у мужчин и второй по распространенности среди женщин после рак молочной железы.[20] Самый распространенный возраст постановки диагноза - 70 лет.[2] В Соединенных Штатах, пятилетняя выживаемость составляет 19,4%,[2] а в Японии - 41,4%.[8] В среднем результаты в развивающихся странах хуже.[21]
Признаки и симптомы
Признаки и симптомы, которые могут указывать на рак легких, включают:[1]
- Респираторные симптомы: кашляющий, кровохарканье, хрипы, или же одышка
- Системные симптомы: похудание, слабое место, высокая температура, или же избиение ногтей
- Симптомы при надавливании раковой массы на соседние структуры: грудная боль, боль в костях, обструкция верхней полой вены, или же затруднение глотания
Если рак растет в дыхательные пути, это может препятствовать потоку воздуха, вызывая затруднения дыхания. Обструкция также может привести к накоплению секрета за закупоркой и увеличить риск пневмония.[1]
В зависимости от типа опухоли паранеопластические явления - симптомы, не связанные с местным присутствием рака - могут изначально привлечь внимание к болезни.[22] При раке легких эти явления могут включать: гиперкальциемия, синдром несоответствующего антидиуретического гормона (SIADH, аномально концентрированная моча и разбавленная кровь), эктопический АКТГ производство, или Миастенический синдром Ламберта-Итона (мышечная слабость из-за аутоантитела ). Опухоли в верхняя часть легкого, известный как Опухоли Панкоста, может вторгнуться в локальную часть Симпатическая нервная система, в результате чего Синдром Хорнера (опущение века и маленький зрачок с этой стороны), а также повреждение плечевое сплетение.[1]
Многие симптомы рака легких (плохой аппетит, похудание, жар, утомляемость) неспецифичны.[6] У многих людей рак уже распространился за пределы исходного участка к тому времени, когда у них появляются симптомы и они обращаются за медицинской помощью.[23] Симптомы, указывающие на наличие метастазов, включают потерю веса, боли в костях и неврологические симптомы (головные боли, обморок, судороги, или слабость конечностей).[1] Общие места распространения включают мозг, кости, надпочечники, противоположное легкое, печень, перикард, и почки.[23] Около 10% людей с раком легких не имеют симптомов при постановке диагноза; эти виды рака кстати найдено в обычном порядке рентгенография грудной клетки.[17]
Причины

Рак развивается после генетическое повреждение к ДНК и эпигенетический изменения. Эти изменения влияют на нормальные функции клетки, включая распространение клеток, запрограммированная гибель клеток (апоптоз ), и Ремонт ДНК. Чем больше повреждений накапливается, тем выше риск рака.[24]
Курение
Курение табака на сегодняшний день является основным источником рака легких.[4] Сигаретный дым содержит как минимум 73 известных канцерогена,[25] включая бензо [а] пирен,[26] ННК, 1,3-бутадиен, а радиоактивный изотоп полония - полоний-210.[25] Во всем развитом мире 90% смертей от рака легких среди мужчин и 70% среди женщин в течение 2000 г. были связаны с курением.[27] Курение составляет около 85% случаев рака легких.[7] Обзор 2014 года показал, что вейпинг может быть фактором риска рака легких, но меньше, чем сигареты.[28]
Пассивное курение - вдыхание дыма от чужого курения - причина рака легких у некурящих. Пассивного курильщика можно определить как человека, живущего или работающего с курильщиком. Исследования из США,[29][30][31] Великобритания[32] и другие европейские страны[33] постоянно демонстрируют значительно повышенный риск среди лиц, подвергающихся пассивному курению.[34] У тех, кто живет с кем-то, кто курит, риск увеличивается на 20–30%, а у тех, кто работает в среде с пассивным курением, риск увеличивается на 16–19%.[35] Исследования побочный дым предполагают, что это более опасно, чем прямой дым.[36] Ежегодно пассивное курение в США приводит примерно к 3400 смертельным случаям, связанным с раком легких.[31]
Дым марихуаны содержит много того же канцерогены как те, что содержатся в табачном дыме,[37] однако эффект курения каннабис о риске рака легких не ясно.[38][39] Обзор 2013 года не обнаружил повышенного риска от легкого до умеренного использования.[40] Обзор 2014 года показал, что курение каннабиса в два раза увеличивает риск рака легких, хотя во многих странах каннабис обычно смешивают с табаком.[41]
Газ радон
Радон бесцветный и без запаха газ порожденные распадом радиоактивных радий, который, в свою очередь, является продуктом распада уран, найденный в корка. Продукты радиационного распада ионизировать генетический материал, вызывающий мутации, которые иногда становятся злокачественными. Радон - вторая по частоте причина рака легких в США.[42] вызывая около 21000 смертей каждый год.[43] Риск увеличивается на 8–16% на каждые 100 Бк /м³ увеличение концентрации радона.[44] Уровни газообразного радона зависят от местности и состава подстилающей почвы и горных пород. Примерно в одном из 15 домов в США уровень радона превышает рекомендуемый уровень в 4 человека. пикокури на литр (пКи / л) (148 Бк / м³).[45]
Асбест
Асбест может вызывать различные заболевания легких, например, рак легких. Табак курение и асбест имеют синергетический влияние на развитие рака легких.[5] У курильщиков, работающих с асбестом, риск рака легких увеличивается в 45 раз по сравнению с населением в целом.[46] Асбест также может вызвать рак плевра, называется мезотелиома - что на самом деле отличается от рака легких.[47]
Загрязнение воздуха
Загрязнители наружного воздуха, особенно химикаты, выделяющиеся при горении ископаемое топливо, увеличивают риск рака легких.[4] Отлично частицы (ВЕЧЕРА2.5) и сульфатные аэрозоли, которые могут попасть в трафик выхлопные газы, связаны с несколько повышенным риском.[4][48] За диоксид азота, постепенное увеличение на 10 частей на миллиард увеличивает риск рака легких на 14%.[49] По оценкам, загрязнение атмосферного воздуха вызывает 1-2% случаев рака легких.[4]
Предварительные данные подтверждают повышенный риск рака легких от загрязнение воздуха внутри помещений в отношении сожжения дерево, уголь, навоз или растительные остатки для приготовления и обогрева.[50] Женщины, которые подвергаются воздействию угольного дыма в помещении, имеют примерно вдвое больший риск, и многие из побочных продуктов горения биомасса являются известными или предполагаемыми канцерогенами.[51] Этот риск затрагивает около 2,4 миллиарда человек во всем мире,[50] и считается, что это приводит к 1,5% смертей от рака легких.[51]
Генетика
Около 8% случаев рака легких вызывается унаследованный факторы.[52] У родственников людей, у которых диагностирован рак легких, риск увеличивается вдвое, вероятно, из-за комбинация генов.[53] Полиморфизмы на хромосомы 5, 6 и 15, как известно, влияют на риск рака легких.[54] Однонуклеотидные полиморфизмы (SNP) генов, кодирующих никотиновый рецептор ацетилхолина (нАЧР) - CHRNA5, CHRNA3, и CHRNB4 - относятся к тем, которые связаны с повышенным риском рака легких, а также RGS17 - ген регулирующий Передача сигналов G-белка.[54]
Другие причины
Многие другие вещества, занятия и воздействие окружающей среды были связаны с раком легких. В Международное агентство по изучению рака (IARC) заявляет, что есть некоторые «достаточные доказательства», чтобы показать, что следующие вещества являются канцерогенными для легких:[55]
- Некоторые металлы (алюминий производство, кадмий и соединения кадмия, хром (VI) соединения, бериллий и соединения бериллия, утюг и стальное литье, никель соединения, мышьяк и неорганические соединения мышьяка, и подземные гематит добыча полезных ископаемых)
- Некоторые продукты горение (неполное сгорание, уголь (выбросы внутри помещений от сжигания угля в домах) газификация угля, каменноугольная смола подача, производство кокса, сажа, и выхлоп дизельного двигателя )
- Ионизирующего излучения (рентгеновский снимок и гамма )
- Некоторые токсичные газы (метиловый эфир (технический уровень), и бис- (хлорметиловый) эфир, серная горчица, MOPP (смесь винкристина, преднизона, азота и горчицы с прокарбазином ) и пары от живописи )
- Производство каучука и кристаллического кремнеземная пыль
- Существует небольшое повышение риска рака легких у людей, страдающих от системный склероз.
Патогенез
Подобно многим другим видам рака, рак легких вызывается активацией онкогены или инактивация гены-супрессоры опухолей.[56] Канцерогены вызывают мутации в этих генах, которые вызывают развитие рака.[57]
Мутации в K-ras протоонкоген вызывает примерно 10–30% легких аденокарциномы.[58][59] Около 4% немелкоклеточных карцином легких связаны с EML4-ALK тирозинкиназа ген слияния.[60]
Эпигенетический изменения, такие как изменение Метилирование ДНК, гистон модификация хвоста, или микроРНК регулирование может привести к инактивации генов-супрессоров опухолей.[61] Важно отметить, что раковые клетки развивают устойчивость к окислительный стресс, что позволяет им выдерживать и обострять воспалительный условия, которые подавляют активность иммунная система против опухоли.[62][63]
В рецептор эпидермального фактора роста (EGFR) регулирует пролиферацию клеток, апоптоз, ангиогенез, и инвазия опухоли.[58] Мутации и усиление EGFR являются обычными при немелкоклеточной карциноме легкого, и они обеспечивают основу для лечения ингибиторами EGFR. Her2 / neu поражается реже.[58] Другие гены, которые часто мутируют или амплифицируют, включают: c-MET, NKX2-1, LKB1, PIK3CA, и BRAF.[58]
В Сотовые линии происхождения полностью не изучены.[1] Механизм может включать аномальную активацию стволовые клетки. В проксимальных дыхательных путях стволовые клетки, экспрессирующие кератин 5 с большей вероятностью пострадают, что обычно приводит к плоскоклеточный рак легкого. В средние дыхательные пути вовлеченные стволовые клетки включают: клубные клетки и нейроэпителиальные клетки что экспресс секреторный белок клубных клеток. Мелкоклеточная карцинома легкого может происходить из этих клеточных линий.[64] или же нейроэндокринные клетки,[1] и это может выражать CD44.[64]
Метастаз рака легких требует переход из эпителиальный к мезенхимальный тип ячейки. Это может происходить через активацию сигнальных путей, таких как Акт /GSK3Beta, МЕК-ЭРК, Фас, и Par6.[65]
Диагностика


Выполнение рентгенограмма грудной клетки является одним из первых шагов расследования, если человек сообщает о симптомах, которые могут указывать на рак легких. Это может выявить очевидную массу, расширение средостение (наводит на мысль о распространении на лимфатический узел там), ателектаз (коллапс легкого), уплотнение (пневмония ), или же плевральный выпот.[7] КТ сундука может показать спикулярная масса который очень наводит на мысль о раке легких, а также используется для получения дополнительной информации о типе и степени заболевания. Бронхоскопический или под контролем КТ биопсия часто используется для отбора проб опухоли на гистопатология.[17]
Рак легких часто проявляется как солитарный легочный узел на рентгенограмме грудной клетки. Тем не менее дифференциальная диагностика широкий. Многие другие заболевания также могут давать такой вид, в том числе метастатический рак, гамартомы, и заразный гранулемы вызванный туберкулез, гистоплазмоз или же кокцидиоидомикоз.[66] Рак легких также может быть случайная находка, как одиночный легочный узел на рентгенограмме грудной клетки или компьютерной томографии, сделанной по не связанной с этим причине.[67] Окончательный диагноз рака легких ставится на основании гистологический исследование подозрительной ткани[1] в контексте клинических и рентгенологических особенностей.[6]
Рекомендации по клинической практике рекомендовать частоты для наблюдения за легочными узлами.[68] КТ не следует использовать дольше или чаще, чем указано, так как расширенный наблюдение подвергает людей повышенному облучению и требует больших затрат.[68]
Классификация

| Гистологический тип | Заболеваемость на 100000 в год |
|---|---|
| Все типы | 66.9 |
| Аденокарцинома | 22.1 |
| Плоскоклеточная карцинома | 14.4 |
| Мелкоклеточная карцинома | 9.8 |
Рак легких классифицируют по гистологический тип.[6] Эта классификация важна как для определения лечения, так и для прогнозирования результатов заболевания. Рак легких карциномы - злокачественные новообразования, возникающие из эпителиальные клетки. Карциномы легких классифицируются по размеру и внешнему виду злокачественных клеток, которые гистопатолог видит под микроскоп. В терапевтических целях различают два широких класса: немелкоклеточный рак легкого и мелкоклеточный рак легкого.[70]
Немелкоклеточный рак легкого

Три основных подтипа НМРЛ: аденокарцинома, плоскоклеточная карцинома, и крупноклеточная карцинома.[1] Редкие подтипы включают аденокарцинома легкого кишечника.[71]
Около 40% случаев рака легких - это аденокарцинома, которая обычно возникает из периферической ткани легких.[6] Хотя большинство случаев аденокарциномы связано с курением, аденокарцинома также является наиболее распространенной формой рака легких среди людей, выкуривших менее 100 сигарет за свою жизнь («никогда не курившие»).[1][72] и бывшие курильщики со скромным стажем курения.[1] Подтип аденокарциномы, бронхиолоальвеолярная карцинома, чаще встречается у никогда не курящих женщин и может иметь лучшую долгосрочную выживаемость.[73]
Плоскоклеточная карцинома вызывает около 30% случаев рака легких. Обычно они возникают вблизи крупных дыхательных путей. Полая полость и связанная с ней смерть клетки обычно находятся в центре опухоли.[6]
Около 10-15% случаев рака легких - это крупноклеточная карцинома.[74] Они названы так потому, что раковые клетки большие, с избытком цитоплазма, большой ядра, и бросается в глаза ядрышки.[6]
Мелкоклеточный рак легкого

При SCLC клетки содержат плотные нейросекреторные гранулы (пузырьки содержащий нейроэндокринный гормоны ), которые придают этой опухоли эндокринную или паранеопластический синдром ассоциация.[75] Большинство случаев возникают в более крупных дыхательных путях (первичных и вторичных. бронхи ).[17] От 60 до 70 процентов имеют обширное заболевание (которое не может быть направлено в рамках одной области лучевой терапии) на момент обращения.[1]
Другие
Различают четыре основных гистологических подтипа, хотя некоторые виды рака могут содержать комбинацию различных подтипов,[70] Такие как аденосквамозная карцинома.[6] Редкие подтипы включают карциноидные опухоли, карциномы бронхов и саркоматоидные карциномы.[6]
Метастаз
| Гистологический тип | Напсин-А | TTF-1 |
|---|---|---|
| Плоскоклеточная карцинома | Отрицательный | Отрицательный |
| Аденокарцинома | Положительный | Положительный |
| Мелкоклеточная карцинома | Отрицательный | Положительный |
Легкие - обычное место для распространения опухолей из других частей тела. Вторичный рак классифицируется по месту происхождения; Например, рак молочной железы который распространился в легкие, называется метастатическим раком груди. На рентгенограмме грудной клетки метастазы часто имеют характерный округлый вид.[76]
Первичный рак легких также чаще всего метастазирует в мозг, кости, печень и надпочечники.[6] Иммуноокрашивание биопсии обычно помогает определить первоисточник.[77] Наличие Напсин-А, TTF-1, CK7, и CK20 помочь подтвердить подтип карциномы легких. SCLC, происходящий из нейроэндокринные клетки может выражать CD56, молекула адгезии нервных клеток, синаптофизин, или же хромогранин.[1]
Постановка
Легкое стадия рака это оценка степени распространения рака от его первоначального источника.[78] Это один из факторов, влияющих на прогноз и потенциальное лечение рака легких.[1][78]
Для оценки стадии немелкоклеточного рака легкого (НМРЛ) используется Классификация TNM (опухоль, узел, метастаз). Это зависит от размера первичной опухоли, поражения лимфатических узлов и отдаленных метастазов.[1]
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Используя дескрипторы TNM, назначается группа от скрытого рака до стадий 0, IA (один-A), IB, IIA, IIB, IIIA, IIIB и IV (четыре). Эта группа этапов помогает в выборе лечения и оценке прогноза.[81]
| TNM | Сценическая группа |
|---|---|
| T1a – T1b N0 M0 | Я |
| T2a N0 M0 | IB |
| T1a – T2a N1 M0 | IIA |
| T2b N0 M0 | |
| T2b N1 M0 | МИБ |
| T3 N0 M0 | |
| T1a – T3 N2 M0 | IIIA |
| T3 N1 M0 | |
| T4 N0 – N1 M0 | |
| N3 M0 | IIIB |
| T4 N2 M0 | |
| M1 | IV |
SCLC традиционно классифицируется как «ограниченная стадия» (ограничивается половиной грудной клетки и находится в пределах единственной допустимой стадии). лучевая терапия поле) или «обширная стадия» (более распространенное заболевание).[1] Однако классификация и группировка TNM полезны для оценки прогноза.[81]
Как для НМРЛ, так и для МРЛ существуют два основных типа оценки стадии: клиническая стадия и хирургическая стадия. Клиническая стадия проводится перед окончательной операцией. Он основан на результатах визуализационных исследований (таких как Компьютерная томография и ПЭТ сканирование ) и результаты биопсии. Хирургическая стадия оценивается во время или после операции. Он основан на совокупных результатах хирургических и клинических исследований, включая хирургический забор образцов грудных лимфатических узлов.[6]
- Схемы основных характеристик постановки

Стадии рака легких IA и IB

Рак легких стадии IIA
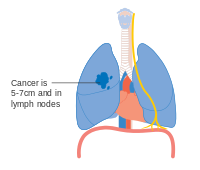
Рак легких IIB стадии
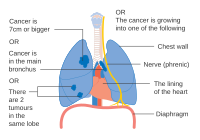
Один вариант для рака легких стадии IIB, с T2b; но если опухоль находится в пределах 2 см от карина, это этап 3

Рак легких стадии IIIA

Рак легких стадии IIIA, если с каждой стороны есть по одному признаку из списка
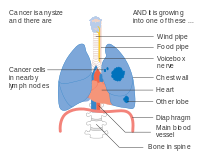
Рак легких стадии IIIA

Рак легких IIIB стадии
Рак легких IIIB стадии

Рак легких IV стадии
Профилактика

Профилактика курения и Отказ от курения эффективные способы предотвращения развития рака легких.[82]
Курить запрещено
Хотя в большинстве стран промышленные и бытовые канцерогены были выявлены и запрещены, курение табака по-прежнему широко распространено. Прекращение курения табака - основная цель профилактики рака легких, а отказ от курения - важный профилактический инструмент в этом процессе.[83]
Политические меры по снижению пассивное курение в общественных местах, таких как рестораны и рабочие места, стали более распространенными во многих западные страны.[84] Бутан полностью запретил курение с 2005 г.[85] в то время как Индия ввела запрет на курение в общественных местах в октябре 2008 года.[86] В Всемирная организация здоровья призвал правительства ввести полный запрет на рекламу табака, чтобы молодые люди не начали курить.[87] По их оценкам, такие запреты привели к сокращению потребления табака на 16% там, где они были введены.[87]
Скрининг
Скрининг рака использует медицинские анализы для выявления болезни у больших групп людей, у которых нет симптомов.[88] Для людей с высоким риском развития рака легких: компьютерная томография (КТ) скрининг может выявить рак и дать человеку возможность отреагировать на него таким образом, чтобы продлить жизнь.[68][89] Эта форма скрининга снижает вероятность смерти от рака легких абсолютная сумма 0,3% (относительное количество 20%).[90][91] Люди высокого риска - это люди в возрасте 55–74 лет, выкуривающие эквивалентное количество пачки сигарет ежедневно в течение 30 лет, включая время, в течение последних 15 лет.[68]
КТ-скрининг связан с высоким уровнем ложноположительный тесты, которые могут привести к ненужному лечению.[92] На каждое точное положительное сканирование приходится около 19 ложноположительных сканирований.[91] Другие проблемы включают облучение[92] и стоимость тестирования вместе с последующими действиями.[68] Исследования не нашли двух других доступных тестов -мокрота цитология или же рентгенограмма грудной клетки (CXR) скрининговые тесты - чтобы принести пользу.[89][93]
В Целевая группа профилактических служб США (USPSTF) рекомендует ежегодно проходить скрининг с использованием низкодозовой компьютерной томографии тем, у кого общее количество курящих в анамнезе составляет 30 пачка лет и находятся в возрасте от 55 до 80 лет, пока человек не курит более 15 лет.[94] Скрининг не следует проводить тем, у кого есть другие проблемы со здоровьем, которые могут сделать лечение рака легких невозможным.[94] В Национальная служба здравоохранения Англии в 2014 году повторно изучал доказательства для скрининга.[95]
Другие стратегии профилактики
Долгосрочное применение дополнительных витамин А,[96][97] Витамин С,[96] Витамин Д[98] или же витамин Е[96] не снижает риск рака легких. Некоторые исследования показали, что витамины A, B и E могут увеличивать риск рака легких у тех, кто курил в анамнезе.[99]
Некоторые исследования показывают, что люди, которые придерживаются диеты с более высоким содержанием овощей и фруктов, как правило, имеют более низкий риск,[31][100] но это может быть из-за сбивать с толку —С меньшим риском фактически из-за связи диеты с высоким содержанием фруктов и овощей с меньшим количеством курения.[101] Несколько тщательных исследований не продемонстрировали четкой связи между диетой и риском рака легких.[1][100] хотя метаанализ, который учитывает статус курения, может показать пользу здорового питания.[102]
Управление
Лечение рака легких зависит от конкретного типа клеток рака, степени его распространения. распространять, и человека статус производительности. Общие методы лечения включают: паллиативная помощь,[103] хирургия, химиотерапия, и радиационная терапия.[1] Таргетная терапия рака легких приобретает все большее значение при распространении рака легких.[104] Людей, страдающих раком легких, следует рекомендовать бросить курить.[105] Нет четких доказательств того, что Отказ от курения Программа наиболее эффективна для людей, у которых был диагностирован рак легких.[105] Неясно, полезны ли физические упражнения для людей с запущенным раком легких.[106] Физические упражнения могут принести пользу людям с НМРЛ, восстанавливающимся после операции на легких.[107] Кроме того, физические упражнения могут принести пользу людям с НМРЛ, получившим лучевую терапию, химиотерапию, химиолучевую терапию или паллиативную помощь.[108]
Физические упражнения перед операцией по поводу рака легких улучшают результаты.[109] Домашний компонент в реабилитация тоже полезно.[108] Несмотря на то, что неясно, приводит ли предварительная реабилитация в домашних условиях к меньшему количеству побочных эффектов или времени госпитализации, реабилитация с использованием домашнего компонента может улучшить восстановление после лечения и общее состояние здоровья легких.[108]
Хирургия

Если исследования подтверждают НМРЛ, сцена оценивается, чтобы определить, является ли заболевание локализованным и поддается хирургическому вмешательству, или оно распространилось до такой степени, что не может быть излечено хирургическим путем. Компьютерная томография и позитронно-эмиссионная томография (ПЭТ-КТ), неинвазивные тесты, могут быть использованы для исключения злокачественных новообразований или лимфатический узел средостения участие.[1][110] Если при помощи ПЭТ-КТ подозревается поражение средостенных лимфатических узлов, следует взять образцы узлов (с помощью биопсии) для определения стадии, ПЭТ-КТ недостаточно точна, чтобы использовать ее отдельно.[110] Методы, используемые для получения образца, включают трансторакальный игла аспирация, трансбронхиальная пункционная аспирация (с или без эндобронхиальное УЗИ ), эндоскопическое ультразвуковое исследование с иглой аспирации, медиастиноскопия, и торакоскопия.[111] Анализы крови и исследование функции легких используются для оценки состояния здоровья человека для операции.[17] Если легочные функциональные пробы выявляют плохой дыхательный резерв, операция может быть невозможна.[1]
В большинстве случаев ранней стадии НМРЛ удаление доли легкого (лобэктомия ) является предпочтительным хирургическим лечением. У людей, которые не подходят для полной лобэктомии, выполняется меньшее субдолевое иссечение (клиновидная резекция ) может быть выполнено. Однако клиновидная резекция имеет более высокий риск рецидива, чем лобэктомия. Радиоактивный йод брахитерапия на краях иссечения клина может снизить риск рецидива. Редко удаление всего легкого (пневмонэктомия ) выполняется.[112] Видеоассистированная торакоскопическая хирургия (НДС) и Лобэктомия ВАТС использовать минимально инвазивный подход к хирургии рака легких.[113] Лобэктомия VATS столь же эффективна, как и обычная открытая лобэктомия, с меньшим количеством послеоперационных заболеваний.[114]
При SCLC обычно используется химиотерапия и / или лучевая терапия.[115] Однако роль хирургического вмешательства при МРЛ пересматривается. Хирургия может улучшить результаты при добавлении к химиотерапии и лучевой терапии на ранней стадии SCLC.[116]
Эффективность хирургического вмешательства (резекции) рака легкого у людей с НМРЛ I - IIA стадии не ясна, однако слабые данные свидетельствуют о том, что комбинированный подход резекции рака легкого и удаления лимфатические узлы средостения (рассечение лимфатических узлов средостения) может улучшить выживаемость по сравнению с резекцией легкого и выборкой узлов средостения (не полное рассечение узла).[117]
Лучевая терапия

Лучевая терапия часто назначается вместе с химиотерапией и может использоваться с лечебной целью у людей с НМРЛ, которые не подходят для операции.[118] Этот вид высокоинтенсивной лучевой терапии называется радикальной лучевой терапией.[119] Усовершенствованием этого метода является непрерывная гиперфракционированная ускоренная лучевая терапия (СХЕМА), при которой высокая доза лучевой терапии назначается за короткий период времени.[120] Радиохирургия относится к методу лучевой терапии, заключающемуся в предоставлении точной высокой дозы лучевой терапии, управляемой компьютером.[121] Послеоперационный (адъювант ) грудную лучевую терапию, как правило, не следует применять после хирургических вмешательств по поводу НМРЛ.[122] Некоторым людям с поражением N2-лимфатических узлов средостения может быть полезна послеоперационная лучевая терапия.[123]
Для потенциально излечимых случаев SCLC в дополнение к химиотерапии часто рекомендуется лучевая терапия грудной клетки.[6] Идеальное время для этих терапий (оптимальное время для лучевой терапии и химиотерапии для повышения выживаемости) неизвестно.[124]
Если рост рака блокирует короткий отрезок бронха, брахитерапия (локализованная лучевая терапия) может проводиться непосредственно в дыхательных путях, чтобы открыть проход. В сравнении с дистанционная лучевая терапия, брахитерапия позволяет сократить время лечения и снизить лучевую нагрузку на медицинский персонал.[125] Однако доказательств в пользу брахитерапии меньше, чем для дистанционной лучевой терапии.[126]
Профилактическое краниальное облучение (ЧКВ) - это вид лучевой терапии головного мозга, используемый для снижения риска метастаз.[127] PCI наиболее полезен при SCLC. При ограниченной стадии заболевания ЧКВ увеличивает трехлетнюю выживаемость с 15% до 20%; при обширном заболевании однолетняя выживаемость увеличивается с 13% до 27%.[128] Для людей с НМРЛ и единичным метастазом в мозг не ясно, является ли операция более эффективной, чем радиохирургия.[121]
Недавние улучшения в нацеливании и визуализации привели к развитию стереотаксического излучения при лечении рака легких на ранней стадии. В этой форме лучевой терапии высокие дозы доставляются в течение нескольких сеансов с использованием стереотаксических методов наведения. Его используют в основном у пациентов, которые не являются кандидатами на хирургическое вмешательство по медицинским показаниям. сопутствующие заболевания.[129]
Для пациентов с НМРЛ и МРЛ для контроля симптомов могут использоваться меньшие дозы облучения грудной клетки (паллиативный лучевая терапия).[130][131] Не показано, что использование более высоких доз лучевой терапии для паллиативной помощи продлевает выживаемость.[131]
Химиотерапия
В химиотерапия режим зависит от типа опухоли.[6] SCLC, даже относительно ранняя стадия заболевания, лечится в первую очередь химиотерапией и лучевой терапией.[132] В SCLC, цисплатин и этопозид наиболее часто используются.[133] Комбинации с карбоплатин, гемцитабин, паклитаксел, винорелбин, топотекан, и иринотекан также используются.[134][135] При запущенном НМРЛ химиотерапия улучшает выживаемость и используется в качестве лечения первой линии при условии, что человек достаточно хорошо себя чувствует для лечения.[136] Обычно используются два препарата, из которых часто бывает на основе платины (либо цисплатин, либо карбоплатин). Другие часто используемые препараты - гемцитабин, паклитаксел, доцетаксел,[137][138] пеметрексед,[139] этопозид или винорелбин.[138] Препараты на основе платины и их комбинации, которые включают терапию платиной, по-видимому, не более полезны для продления выживаемости по сравнению с другими препаратами, не содержащими платину, и могут привести к более высокому риску серьезных побочных эффектов, таких как тошнота, рвота, анемия и тромбоцитопения.[140] особенно у людей старше 70 лет.[141] Недостаточно доказательств, чтобы определить, какой подход химиотерапии связан с наивысшим качеством жизни.[140] Также недостаточно данных, чтобы определить, приносит ли лечение людей с НМРЛ во второй раз, когда первый курс химиотерапии не был успешным (химиотерапия второй линии), большую пользу или вред.[142]
Адъювантная химиотерапия относится к использованию химиотерапии после явно излечивающей операции для улучшения результата. При НМРЛ берут пробы из близлежащих лимфатический узел во время операции, чтобы помочь постановка. Если подтверждена стадия II или III, адъювантная химиотерапия (включая или не включая послеоперационную лучевую терапию) увеличивает выживаемость на 4% через пять лет.[143][144][145] Комбинация винорелбина и цисплатина более эффективна, чем старые схемы.[144] Адъювантная химиотерапия для людей с раком стадии IB вызывает споры, поскольку клинические испытания явно не продемонстрировали преимущества выживания.[146] Химиотерапия перед операцией при НМРЛ, которые можно удалить хирургическим путем, могут улучшить результаты.[147][148]
Химиотерапию можно сочетать с паллиативная помощь при лечении НМРЛ.[149] В запущенных случаях соответствующая химиотерапия улучшает среднюю выживаемость по сравнению с только поддерживающей терапией, а также улучшает качество жизни.[150][149] При адекватном физическая подготовка Поддержание химиотерапии во время паллиативного лечения рака легкого предлагает от 1,5 до 3 месяцев продления выживаемости, облегчения симптомов и улучшения качества жизни с лучшими результатами, наблюдаемыми при использовании современных препаратов.[151][152] Совместная группа по мета-анализу НМРЛ рекомендует, если реципиент хочет и может переносить лечение, то при запущенном НМРЛ следует рассмотреть возможность химиотерапии.[136][153]
Таргетная и иммунотерапия
Несколько препаратов, которые целевые молекулярные пути при раке легкого доступны, особенно для лечения запущенных заболеваний. Эрлотиниб, гефитиниб и афатиниб подавлять тирозинкиназа на рецептор эпидермального фактора роста (EGFR). Эти ингибиторы EGFR могут помочь замедлить распространение раковых клеток у людей с раком легких EGFR M + и могут улучшить качество жизни человека.[154] Не было доказано, что ингибиторы EGFR помогают людям выжить дольше.[154] Для людей с мутациями EGFR лечение гефитинибом может привести к улучшению качества жизни по сравнению с лечением химиотерапией.[155] Деносумаб это моноклональное антитело направлен против активатор рецептора ядерного фактора лиганда каппа-B и может быть полезен при лечении костные метастазы.[156]

Иммунотерапия может использоваться как для SCLC, так и для NSCLC.[157][158] Клетки немелкоклеточного рака легкого (НМРЛ), экспрессирующие лиганд запрограммированной смерти 1 (PD-L1), могут взаимодействовать с рецептором запрограммированной смерти 1 (PD-1), экспрессируемым на поверхности Т-клеток, и приводить к снижению уничтожения опухолевых клеток за счет иммунная система.[159] Атезолизумаб представляет собой моноклональное антитело против PD-L1. Ниволумаб и пембролизумаб являются моноклональными антителами против PD-1. Ипилимумаб представляет собой моноклональное антитело, нацеленное на цитотоксический Т-лимфоцит-ассоциированный белок 4 (CTLA-4) на поверхности Т-клеток. Бевацизумаб представляет собой моноклональное антитело, которое нацелено на фактор роста эндотелия сосудов (VEGF) в кровотоке и действует как ингибитор ангиогенеза.[159] Были опубликованы многочисленные клинические испытания фазы 3 с использованием иммунотерапии в первой линии лечения НМРЛ, включая пембролизумаб в KEYNOTE-024, KEYNOTE-042, KEYNOTE-189 и KEYNOTE-407; Ниволумаб и ипилимумаб в CHECKMATE-227 и CHECKMATE 9LA; и атезолизумаб в IMpower110, IMpower130 и IMpower150.[159]

Иммунотерапия на основе вакцин после хирургического вмешательства или лучевой терапии может не привести к увеличению выживаемости людей с НМРЛ I-III стадий.[160]
Бронхоскопия
Для лечения обструкции дыхательных путей или кровотечения с помощью бронхоскопии можно провести несколько процедур. Если дыхательные пути закупориваются из-за роста рака, варианты включают жесткую бронхоскопию, баллонную бронхопластику, стентирование и микродебридмент.[161] Лазерная фотосекция включает доставку лазерного света внутрь дыхательных путей через бронхоскоп для удаления препятствующей опухоли.[162]
Паллиативная помощь
Паллиативная помощь при добавлении к обычному лечению рака приносит пользу людям, даже когда они все еще проходят химиотерапию.[163] Эти подходы позволяют дополнительно обсудить варианты лечения и дают возможность принимать взвешенные решения.[164][165] Паллиативная помощь позволяет избежать бесполезной, но дорогостоящей помощи не только в конце жизни, но и на протяжении болезни. Для людей с более запущенным заболеванием: хоспис также может быть уместным.[17][165]
Неинвазивные вмешательства
Имеются слабые доказательства того, что поддерживающие вмешательства (неинвазивные вмешательства), направленные на улучшение самочувствия людей с раком легких, могут улучшить качество жизни.[166] Вмешательства, такие как наблюдение медсестры, психотерапия, психосоциальный терапия и образовательные программы могут быть полезными, однако доказательства неубедительны (необходимы дальнейшие исследования).[166] Консультации может помочь людям справиться с эмоциональными симптомами, связанными с раком легких.[166] Рефлексотерапия может быть эффективным в краткосрочной перспективе, однако необходимы дополнительные исследования.[166] Нет никаких доказательств того, что диетические вмешательства или программы упражнений приводят к улучшению качества жизни человека с раком легких.[166]
Прогноз
| Клиническая стадия | Пятилетняя выживаемость (%) | |
|---|---|---|
| Немелкоклеточный рак легкого | Мелкоклеточный рак легкого | |
| Я | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| МИБ | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Из всех людей с раком легких в США 16,8% выживают в течение как минимум пяти лет после постановки диагноза.[2][167] В Англии и Уэльсе с 2010 по 2011 год в целом пятилетняя выживаемость для рака легких оценивается в 9,5%.[168] Результаты обычно хуже в Развивающийся мир.[21] На момент постановки диагноза стадия часто продвигается. На момент обращения 30–40% случаев НМРЛ относятся к стадии IV, а 60% случаев МРЛ - к стадии IV.[6] Выживаемость при раке легких снижается по мере того, как стадия постановки диагноза становится более продвинутой: данные на английском языке показывают, что около 70% пациентов выживают как минимум год при постановке диагноза на самой ранней стадии, но это падает до 14% для тех, у кого диагностирована наиболее поздняя стадия. болезнь (IV стадия).[169]
К прогностическим факторам НМРЛ относятся наличие легочных симптомов, большой размер опухоли (> 3 см), плоскоклеточный тип (гистология), степень распространения (стадия) и метастазы во множественные лимфатические узлы, а также сосудистая инвазия. Для людей с неоперабельным заболеванием результаты хуже у людей с плохой статус производительности и потеря веса более 10%.[170] Прогностические факторы мелкоклеточного рака легкого включают работоспособность, биологический пол, стадию заболевания и вовлеченность Центральная нервная система или же печень на момент диагностики.[171]

Для НМРЛ лучший прогноз достигается при полной хирургической резекции болезни IA стадии с пятилетней выживаемостью до 70%.[172] У людей с обширной стадией МРЛ средняя пятилетняя выживаемость составляет менее 1%. Среднее время выживания при ограниченной стадии болезни составляет 20 месяцев, а пятилетняя выживаемость составляет 20%.[7] Прогноз для пациентов с немелкоклеточным раком легкого значительно улучшился в последние годы с введением иммунотерапии.[159] Пациенты с опухолью PDL-1, экспрессирующей более половины или более опухолевых клеток, достигли средней общей выживаемости 30 месяцев с пембролизумабом. [173] Были опубликованы многочисленные исследования фазы 3, обеспечивающие иммунотерапию первой линии для пациентов с немелкоклеточным раком легкого.[159]
По данным, предоставленным Национальный институт рака, средний возраст постановки диагноза рака легких в США составляет 70 лет,[174] средний возраст смерти - 72 года.[175] В США люди с медицинская страховка имеют больше шансов иметь лучший результат.[176]
Эпидемиология

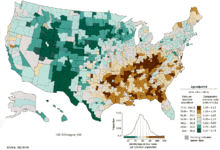

Во всем мире рак легких является наиболее распространенным видом рака среди мужчин с точки зрения обоих заболеваемость и смертность, а среди женщин занимает третье место по заболеваемости и второе место после рака груди по смертности. В 2012 году во всем мире было зарегистрировано 1,82 миллиона новых случаев заболевания и 1,56 миллиона случаев смерти от рака легких, что составляет 19,4% всех случаев смерти от рака.[20] Самые высокие показатели в Северной Америке, Европе и Восточной Азии, при этом в этом году в Китае было зарегистрировано более трети новых случаев. Ставки в Африке и Южной Азии намного ниже.[177]
Сегмент населения, у которого наиболее высока вероятность развития рака легких, - это люди старше 50 лет, которые курили в анамнезе. В отличие от уровня смертности мужчин, который начал снижаться более 20 лет назад, уровень смертности от рака легких у женщин вырос за последние десятилетия и лишь недавно начал стабилизироваться.[178] В США риск жизни заболеваемости раком легких составляет 8% у мужчин и 6% у женщин.[1]
На каждые 3–4 миллиона выкуриваемых сигарет может наступить одна смерть от рака легких.[179] Влияние "Большой Табак «играет важную роль в курении.[180] Молодые некурящие люди, которые видят реклама табака чаще курят.[181] Роль пассивного курения все чаще признается фактором риска рака легких.[34] приводящие к политическим мерам по снижению нежелательного воздействия табачного дыма на некурящих на людей.[182]
С 1960-х годов заболеваемость аденокарциномой легких стала расти по сравнению с другими видами рака легких, частично из-за введения сигарет с фильтром. Использование фильтров удаляет более крупные частицы из табачного дыма, тем самым уменьшая осаждение в более крупных дыхательных путях. Однако курильщик должен вдохнуть более глубоко, чтобы получить такое же количество никотин, увеличивая осаждение частиц в мелких дыхательных путях, где имеет тенденцию возникать аденокарцинома.[183] Заболеваемость аденокарциномой легких продолжает расти.[184]
Соединенные Штаты
В США заболеваемость как чернокожих мужчин, так и чернокожих женщин выше.[185] Заболеваемость раком легких в настоящее время ниже в развивающихся странах.[186] Ожидается, что с ростом курения в развивающихся странах в ближайшие несколько лет показатели вырастут, особенно в Китае.[187] и Индия.[188]
Также в США у ветеранов вооруженных сил на 25-50% выше уровень заболеваемости раком легких, в основном из-за более высокого уровня курения.[189] Во время Второй мировой войны и Корейская война, асбест также сыграл свою роль, и Агент апельсин могли вызвать некоторые проблемы во время война во Вьетнаме.[190]
объединенное Королевство
Рак легкого является третьим по распространенности раком в Великобритании (в 2014 году это заболевание было диагностировано около 46 400 человек).[191] и это самая частая причина смерти от рака (в 2014 г. умерло около 35 900 человек).[192]
История
До появления курения сигарет рак легких был редкостью; до 1761 г. она даже не была признана отдельной болезнью.[193] Различные аспекты рака легких были описаны в 1810 году.[194] Злокачественные опухоли легких составляли только 1% всех случаев рака, наблюдаемых в вскрытие в 1878 г., но к началу 1900-х гг. выросла до 10–15%.[195] В медицинской литературе в 1912 году насчитывалось всего 374 истории болезни.[196] но обзор вскрытий показал, что заболеваемость раком легких увеличилась с 0,3% в 1852 году до 5,66% в 1952 году.[197] В Германия в 1929 г. врач Фриц Ликинт признали связь между курением и раком легких,[195] что привело к агрессивному кампания против курения.[198] В Исследование британских врачей, опубликованный в 1950-х годах, был первым солидным эпидемиологический доказательства связи между раком легких и курением.[199] В результате в 1964 г. Главный хирург США рекомендованные курильщики должны бросить курить.[200]
Связь с радон газ был впервые признан горняками в Рудные горы возле Шнеберг, Саксония. Серебро здесь добывается с 1470 г., и эти рудники богаты уран, с сопровождающими радий и радон.[201] Шахтеры заболели непропорционально большим количеством заболеваний легких, которые в конце концов были признаны раком легких в 1870-х годах.[202] Несмотря на это открытие, добыча продолжалась до 1950-х годов из-за СССР Спрос на уран.[201] Радон был подтвержден как причина рака легких в 1960-х годах.[203]
Первый успешный пневмонэктомия на рак легкого был выполнен в 1933 году.[204] Паллиативная лучевая терапия используется с 1940-х годов.[205] Радикальная лучевая терапия, первоначально использовавшаяся в 1950-х годах, была попыткой использовать более высокие дозы облучения у пациентов с относительно ранней стадией рака легких, которые в остальном были непригодны для хирургического вмешательства.[206] В 1997 году CHART рассматривался как усовершенствование по сравнению с традиционной радикальной лучевой терапией.[207] При SCLC первые попытки хирургической резекции в 1960-х гг.[208] и радикальная лучевая терапия[209] оказались безуспешными. В 1970-х годах были разработаны успешные схемы химиотерапии.[210]
Направления исследований
Текущие направления исследований в области лечения рака легких включают: иммунотерапия,[211][212] который побуждает иммунную систему организма атаковать опухолевые клетки, эпигенетику и новые комбинации химиотерапии и лучевой терапии, как по отдельности, так и вместе. Многие из этих новых методов лечения проходят через блокада иммунных контрольных точек, нарушая способность рака избегать иммунная система.[211][212]
Ипилимумаб блоки сигнализация через рецептор на Т-клетки известный как CTLA-4 который ослабляет иммунную систему. Он был одобрен США. Управление по контролю за продуктами и лекарствами (FDA) для лечения меланома и проходит клинические испытания на НМРЛ и МРЛ.[211]
Другие виды иммунотерапевтического лечения нарушают связывание запрограммированная гибель клеток 1 (PD-1) белок с его лиганд PD-1 лиганд 1 (PD-L1), и были одобрены в качестве препаратов первой и последующих линий для лечения различных подгрупп рака легких.[212] Передача сигналов через PD-1 инактивирует Т-клетки. Некоторые раковые клетки, по-видимому, используют это, экспрессируя PD-L1, чтобы отключить Т-клетки, которые могут распознать в них угрозу. Моноклональные антитела, нацеленные как на PD-1, так и на PD-L1, такие как пембролизумаб, ниволумаб,[65] атезолизумаб, и дурвалумаб[212] в настоящее время проходят клинические испытания для лечения рака легких.[211][212]
Эпигенетика - это изучение небольших, обычно наследуемых, молекулярных модификаций - или «меток», которые связываются с ДНК и изменяют экспрессия гена уровни. Нацеливание на эти метки с помощью лекарств может убить раковые клетки. Ранние исследования НМРЛ с использованием препаратов, направленных на эпигенетические модификации, показывают, что блокирование более чем одного из этих тегов может убить раковые клетки с меньшим количеством побочных эффектов.[213] Исследования также показывают, что прием этих препаратов перед стандартным лечением может повысить его эффективность. В настоящее время проводятся клинические испытания, чтобы оценить, насколько хорошо эти препараты убивают клетки рака легких у людей.[213] Несколько препаратов, нацеленных на эпигенетические механизмы, находятся в разработке. Ингибиторы гистон-деацетилазы в разработке включают вальпроевая кислота, вориностат, белиностат, панобиностат, энтиностат, и ромидепсин. ДНК-метилтрансфераза ингибиторы в развитии включают децитабин, азацитидин, и гидралазин.[61]
В рамках проекта TRACERx изучается, как развивается и развивается НМРЛ, и как эти опухоли становятся устойчивыми к лечению.[214] В рамках проекта будут изучены образцы опухолей у 850 пациентов с НМРЛ на различных этапах, включая диагностику, после первого лечения, после лечения и рецидива.[215] Изучая образцы на разных этапах развития опухоли, исследователи надеются определить изменения, которые приводят к росту опухоли и устойчивости к лечению. Результаты этого проекта помогут ученым и врачам лучше понять НМРЛ и потенциально приведут к разработке новых методов лечения этого заболевания.[214]
Для случаев рака легких, у которых развивается устойчивость к рецептору эпидермального фактора роста (EGFR) и киназа анапластической лимфомы (ALK) ингибиторы тирозинкиназы, новые лекарства находятся в разработке. Ингибиторы EGFR включают: афатиниб и дакомитиниб.[154] Альтернативный сигнальный путь, c-Met, может подавляться тивантиниб и онартузумаб. Новые ингибиторы ALK включают: кризотиниб и церитиниб.[216] Если Путь MAPK / ERK участвует, BRAF ингибитор киназы дабрафениб и ингибитор MAPK / MEK траметиниб может быть полезным.[217]
В Путь PI3K был исследован в качестве мишени для лечения рака легких. Наиболее многообещающими стратегиями для нацеливания на этот путь, по-видимому, является избирательное ингибирование одного или нескольких членов PI3K класса I и совместное ингибирование этого пути с другими, такими как MEK.[218]
Легкое раковые стволовые клетки часто устойчивы к традиционной химиотерапии и лучевой терапии. Это может привести к рецидиву после лечения. Цель новых подходов белок или же гликопротеин маркеры, специфичные для стволовых клеток. К таким маркерам относятся CD133, CD90, ALDH1A1, CD44 и ABCG2. Сигнальные пути Такие как Ежик, Wnt и Notch часто участвуют в самообновлении линий стволовых клеток. Таким образом, лечение, направленное на эти пути, может помочь предотвратить рецидив.[219]
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс Хорн Л., Ловли С.М. (2018). «Глава 74: Новообразования легкого». В Jameson JL, Fauci AS, Kasper DL, Hauser SL, Longo DL, Loscalzo J (ред.). Принципы внутренней медицины Харрисона (20-е изд.). Макгроу-Хилл. ISBN 978-1259644030.
- ^ а б c d е «Программа эпиднадзора, эпидемиологии и конечных результатов». Национальный институт рака. В архиве из оригинала 4 марта 2016 г.. Получено 5 марта 2016.
- ^ а б c "Рак легкого - версия для пациента". NCI. 1 января 1980 г. В архиве из оригинала 9 марта 2016 г.. Получено 5 марта 2016.
- ^ а б c d е ж грамм час Альберг А.Дж., Брок М.В., Самет Дж. М. (2016). «Глава 52: Эпидемиология рака легких». Учебник респираторной медицины Мюррея и Наделя (6-е изд.). Saunders Elsevier. ISBN 978-1-4557-3383-5.
- ^ а б c О'Рейли К.М., Маклафлин А.М., Беккет В.С., Симе П.Дж. (март 2007 г.). «Заболевания легких, связанные с асбестом». Американский семейный врач. 75 (5): 683–8. PMID 17375514. В архиве из оригинала от 29 сентября 2007 г.
- ^ а б c d е ж грамм час я j k л м п о Лу С., Онн А., Вапорциан А.А. и др. (2010). «Глава 78: Рак легкого». Holland-Frei Cancer Medicine (8-е изд.). Народное медицинское издательство. ISBN 978-1-60795-014-1.
- ^ а б c d е ж грамм час я «Карцинома легких: опухоли легких». Руководство Merck Professional Edition, онлайн-издание. В архиве из оригинала 16 августа 2007 г.. Получено 15 августа 2007.
- ^ а б «Японский медицинский центр установил, что пятилетняя выживаемость при раке составляет 66,4%». nippon.com. Получено 2 февраля 2020.
- ^ Вос Т., Аллен С., Арора М., Барбер Р.М., Бхутта З.А., Браун А. и др. (Соавторы исследования ГББ 2015 по заболеваемости и распространенности заболеваний и травм) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и годы, прожитые с инвалидностью для 310 заболеваний и травм, 1990–2015 гг .: систематический анализ для исследования глобального бремени болезней 2015 г.». Ланцет. 388 (10053): 1545–1602. Дои:10.1016 / S0140-6736 (16) 31678-6. ЧВК 5055577. PMID 27733282.
- ^ Ван Х., Нагави М., Аллен С., Барбер Р.М., Бхутта З.А., Картер А. и др. (ГББ 2015 г. Смертность и причины смерти соавторов) (октябрь 2016 г.). «Ожидаемая продолжительность жизни на глобальном, региональном и национальном уровнях, смертность от всех причин и смертность от конкретных причин для 249 причин смерти, 1980–2015 годы: систематический анализ для исследования глобального бремени болезней 2015 года». Ланцет. 388 (10053): 1459–1544. Дои:10.1016 / S0140-6736 (16) 31012-1. ЧВК 5388903. PMID 27733281.
- ^ «Лечение немелкоклеточного рака легких - версия для пациента (PDQ®)». NCI. 12 мая 2015. В архиве из оригинала 29 февраля 2016 г.. Получено 5 марта 2016.
- ^ Фальк С., Уильямс С. (2010). "Глава 1". Рак легких - факты (3-е изд.). Издательство Оксфордского университета. стр.3–4. ISBN 978-0-19-956933-5.
- ^ а б Всемирный доклад о раке 2014 г.. Всемирная организация здоровья. 2014. С. Глава 5.1. ISBN 978-92-832-0429-9.
- ^ Тун М.Дж., Ханнан Л.М., Адамс-Кэмпбелл Л.Л., Боффетта П., Бьюринг Дж. Э., Фесканич Д. и др. (Сентябрь 2008 г.). «Заболеваемость раком легких у некурящих: анализ 13 когортных исследований и 22 исследований ракового регистра». PLOS Медицина. 5 (9): e185. Дои:10.1371 / journal.pmed.0050185. ЧВК 2531137. PMID 18788891.
- ^ Кармона Р.Х. (27 июня 2006 г.). Последствия для здоровья недобровольного воздействия табачного дыма: отчет главного хирурга. Публикации и отчеты главного хирурга. Министерство здравоохранения и социальных служб США. В архиве из оригинала 15 февраля 2017 года.
Пассивное курение вызывает болезни и преждевременную смерть у детей и взрослых, которые не курят.
Проверено 16 июня 2014 г. - ^ «Табачный дым и недобровольное курение» (PDF). Монографии МАИР по оценке канцерогенных рисков для человека. Международное агентство ВОЗ по изучению рака. 83. 2004. В архиве (PDF) из оригинала от 13 августа 2015 г.
Имеется достаточно доказательств того, что непроизвольное курение (воздействие пассивного табачного дыма или табачного дыма из окружающей среды) вызывает рак легких у людей. ... Непроизвольное курение (воздействие вторичного табачного дыма или табачного дыма из окружающей среды) канцерогенно для человека (Группа 1).
- ^ а б c d е ж Коллинз Л.Г., Хейнс С., Перкель Р., Энк Р.Э. (январь 2007 г.). «Рак легкого: диагностика и лечение». Американский семейный врач. 75 (1): 56–63. PMID 17225705. В архиве из оригинала от 29 сентября 2007 г.
- ^ «Профилактика рака легких - версия для пациентов (PDQ®)». NCI. 4 ноября 2015. В архиве из оригинала 9 марта 2016 г.. Получено 5 марта 2016.
- ^ Чепмен С., Робинсон Дж., Стрэдлинг Дж., Уэст С., Райтсон Дж. (2014). «Глава 31». Оксфордский справочник респираторной медицины (3-е изд.). Издательство Оксфордского университета. п. 284. ISBN 978-0-19-870386-0.
- ^ а б Всемирный доклад о раке 2014 г.. Всемирная организация здоровья. 2014. С. Глава 1.1. ISBN 978-92-832-0429-9.
- ^ а б Маджумдер С (2009). Стволовые клетки и рак (Online-Ausg. Ed.). Нью-Йорк: Спрингер. п. 193. ISBN 978-0-387-89611-3. В архиве из оригинала 18 октября 2015 г.
- ^ Оннорат Дж., Антуан Дж. С. (май 2007 г.). «Паранеопластические неврологические синдромы». Журнал редких заболеваний Orphanet. 2 (1): 22. Дои:10.1186/1750-1172-2-22. ЧВК 1868710. PMID 17480225.
- ^ а б Фредерик Л. Г. (2002). Руководство по стадированию рака AJCC. Берлин: Springer-Verlag. ISBN 978-0-387-95271-0.
- ^ Браун К.М., Китс Дж. Дж., Секулич А. и др. (2010). «Глава 8». Holland-Frei Cancer Medicine (8-е изд.). Народное медицинское издательство США. ISBN 978-1-60795-014-1.
- ^ а б Hecht SS (декабрь 2012 г.). «Канцерогенез легких от табачного дыма». Международный журнал рака. 131 (12): 2724–32. Дои:10.1002 / ijc.27816. ЧВК 3479369. PMID 22945513.
- ^ Кумар В., Аббас А.К., Астер Дж. К. (2013). «Глава 5». Базовая патология Роббинса (9-е изд.). Elsevier Saunders. п. 199. ISBN 978-1-4377-1781-5.
- ^ Пето Р., Лопес А.Д., Борхам Дж. И др. (2006). Смертность от курения в развитых странах в 1950–2000 гг .: косвенные оценки из национальной статистики естественного движения населения.. Издательство Оксфордского университета. ISBN 978-0-19-262535-9. В архиве из оригинала от 5 сентября 2007 г.
- ^ Нансеу Дж. Р., Бинья Дж. Дж. (2016). «Электронные сигареты для снижения бремени неинфекционных заболеваний, вызванного употреблением табака: пересмотр доказательств с упором на проблемы в странах Африки к югу от Сахары». Легочная медицина. 2016: 4894352. Дои:10.1155/2016/4894352. ЧВК 5220510. PMID 28116156.
 Эта статья включает текст от Nansseu JR, Bigna JJ доступно под CC BY 4.0 лицензия.
Эта статья включает текст от Nansseu JR, Bigna JJ доступно под CC BY 4.0 лицензия. - ^ «Воздействие на здоровье табачного дыма в окружающей среде. Калифорнийское агентство по охране окружающей среды». Контроль над табаком. 6 (4): 346–53. 1997. Дои:10.1136 / tc.6.4.346. ЧВК 1759599. PMID 9583639. В архиве из оригинала от 8 августа 2007 г.
- ^ Центры профилактики заболеваний (CDC) (Декабрь 2001 г.). «Распространенность нынешнего курения сигарет среди взрослых, а также политика и отношение к пассивному курению - США, 2000 г.». MMWR. Еженедельный отчет о заболеваемости и смертности. 50 (49): 1101–6. PMID 11794619. В архиве с оригинала 25 июня 2017 г.
- ^ а б c Альберг А.Дж., Форд Дж. Г., Самет Дж. М. (сентябрь 2007 г.). «Эпидемиология рака легких: руководящие принципы клинической практики ACCP (2-е издание)». Грудь. 132 (3 Прил.): 29С – 55С. Дои:10.1378 / сундук.07-1347. PMID 17873159.
- ^ Паркин Д.М. (декабрь 2011 г.). «2. Связанное с курением бремя рака в Великобритании в 2010 г.». Британский журнал рака. 105 Дополнение 2 (Дополнение 2): S6 – S13. Дои:10.1038 / bjc.2011.475. ЧВК 3252064. PMID 22158323.
- ^ Яаккола М.С., Яаккола Дж.Дж. (август 2006 г.). «Влияние законодательства о запрете курения на рабочих местах на вредное воздействие и здоровье: возможности для предотвращения». Европейский респираторный журнал. 28 (2): 397–408. Дои:10.1183/09031936.06.00001306. PMID 16880370.
- ^ а б Тейлор Р., Наджафи Ф., Добсон А. (октябрь 2007 г.). «Метаанализ исследований пассивного курения и рака легких: влияние типа исследования и континента». Международный журнал эпидемиологии. 36 (5): 1048–59. Дои:10.1093 / ije / dym158. PMID 17690135. В архиве из оригинала от 5 августа 2011 г.
- ^ «Часто задаваемые вопросы о пассивном курении». Всемирная организация здоровья. В архиве из оригинала на 1 января 2013 г.. Получено 25 июля 2012.
- ^ Шик С., Гланц С. (декабрь 2005 г.). «Токсикологические эксперименты Philip Morris со свежим побочным дымом: более токсичен, чем основной дым». Контроль над табаком. 14 (6): 396–404. Дои:10.1136 / tc.2005.011288. ЧВК 1748121. PMID 16319363.
- ^ Грейданус Д.Е., Хаввер Е.К., Грейданус М.М., Меррик Дж. (Октябрь 2013 г.). «Марихуана: современные концепции (†)». Границы общественного здравоохранения. 1 (42): 42. Дои:10.3389 / fpubh.2013.00042. ЧВК 3859982. PMID 24350211.
- ^ Оуэн К.П., Саттер М.Э., Альбертсон Т.Е. (февраль 2014 г.). «Марихуана: воздействие на дыхательные пути». Клинические обзоры по аллергии и иммунологии. 46 (1): 65–81. Дои:10.1007 / s12016-013-8374-y. PMID 23715638. S2CID 23823391.
- ^ Джоши М., Джоши А., Барттер Т. (март 2014 г.). «Марихуана и болезни легких». Текущее мнение в области легочной медицины. 20 (2): 173–9. Дои:10.1097 / mcp.0000000000000026. PMID 24384575. S2CID 8010781.
- ^ Ташкин Д.П. (июнь 2013 г.). «Влияние курения марихуаны на легкие». Анналы Американского торакального общества. 10 (3): 239–47. Дои:10.1513 / annalsats.201212-127fr. PMID 23802821.
- ^ Андернер М., Урбан Т., Перрио Дж., Де Хазерон И., Мерис Дж. К. (июнь 2014 г.). «[Курение каннабиса и рак легких]». Revue des Maladies Respiratoires. 31 (6): 488–98. Дои:10.1016 / j.rmr.2013.12.002. PMID 25012035.
- ^ Цой Х., Маццоне П. (сентябрь 2014 г.). «Радон и рак легких: оценка и снижение риска». Кливлендский медицинский журнал клиники. 81 (9): 567–75. Дои:10.3949 / ccjm.81a.14046. PMID 25183848. S2CID 43418206.
- ^ «Радон (Rn) Риск для здоровья». EPA. 27 августа 2013 г. В архиве из оригинала от 20 октября 2008 г.
- ^ Шмид К., Куверт Т., Дрекслер Х. (март 2010 г.). «Радон в помещениях: недооцененный фактор риска рака легких в экологической медицине». Deutsches Ärzteblatt International. 107 (11): 181–6. Дои:10.3238 / arztebl.2010.0181. ЧВК 2853156. PMID 20386676.
- ^ EPA (Февраль 2013). «Радиационная информация: радон». EPA. В архиве из оригинала от 29 апреля 2009 г.
- ^ Тобиас Дж. Hochhauser D (2010). «Глава 12». Рак и его лечение (6-е изд.). Вили-Блэквелл. п. 199. ISBN 978-1-4051-7015-4.
- ^ Дэвис Р.Дж., Ли Ю.К. (2010). «18.19.3». Оксфордский учебник медицины (5-е изд.). ОУП Оксфорд. ISBN 978-0-19-920485-4.
- ^ Чен Х., Гольдберг М.С., Вильнёв П.Дж. (октябрь – декабрь 2008 г.). «Систематический обзор связи между долгосрочным воздействием загрязнения атмосферного воздуха и хроническими заболеваниями». Обзоры на здоровье окружающей среды. 23 (4): 243–97. Дои:10.1515 / revh.2008.23.4.243. PMID 19235364. S2CID 24481623.
- ^ Клапп Р. У., Джейкобс М. М., Лёхлер Е. Л. (январь – март 2008 г.). «Экологические и профессиональные причины рака: новые данные 2005–2007 гг.». Обзоры на здоровье окружающей среды. 23 (1): 1–37. Дои:10.1515 / REVEH.2008.23.1.1. ЧВК 2791455. PMID 18557596.
- ^ а б Lim WY, Seow A (январь 2012 г.). «Топливо из биомассы и рак легких». Респирология. 17 (1): 20–31. Дои:10.1111 / j.1440-1843.2011.02088.x. PMID 22008241.
- ^ а б Суд А (декабрь 2012 г.). «Воздействие топлива внутри помещений и легкие как в развивающихся, так и в развитых странах: обновленная информация». Клиники грудной медицины. 33 (4): 649–65. Дои:10.1016 / j.ccm.2012.08.003. ЧВК 3500516. PMID 23153607.
- ^ Ян И.А., Холлоуэй Дж. В., Фонг К.М. (октябрь 2013 г.). «Генетическая предрасположенность к раку легких и сопутствующим заболеваниям». Журнал торакальных болезней. 5 Дополнение 5 (Дополнение 5): S454–62. Дои:10.3978 / j.issn.2072-1439.2013.08.06. ЧВК 3804872. PMID 24163739.
- ^ Дела Круз CS, Tanoue LT, Matthay RA (2015). «Глава 109: Эпидемиология рака легких». В Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (ред.). Легочные болезни и расстройства Фишмана (5-е изд.). Макгроу-Хилл. п. 1673. ISBN 978-0-07-179672-9.
- ^ а б Ларсен Дж. Э., Минна Дж. Д. (декабрь 2011 г.). «Молекулярная биология рака легких: клинические последствия». Клиники грудной медицины. 32 (4): 703–40. Дои:10.1016 / j.ccm.2011.08.003. ЧВК 3367865. PMID 22054881.
- ^ Cogliano VJ, Baan R, Straif K, Grosse Y, Lauby-Secretan B, El Ghissassi F и др. (Декабрь 2011 г.). «Предотвратимые воздействия, связанные с раком человека» (PDF). Журнал Национального института рака. 103 (24): 1827–39. Дои:10.1093 / jnci / djr483. ЧВК 3243677. PMID 22158127. В архиве (PDF) из оригинала от 20 сентября 2012 г.
- ^ Купер В.А., Лам округ Колумбия, О'Тул С.А., Минна Дж.Д. (октябрь 2013 г.). «Молекулярная биология рака легких». Журнал торакальных болезней. 5 Дополнение 5 (Дополнение 5): S479–90. Дои:10.3978 / j.issn.2072-1439.2013.08.03. ЧВК 3804875. PMID 24163741.
- ^ Тобиас Дж., Хоххаузер Д. (2010). «Глава 12». Рак и его лечение (6-е изд.). Вили-Блэквелл. п. 200. ISBN 978-1-4051-7015-4.
- ^ а б c d Хербст Р.С., Хеймах СП, Липпман С.М. (сентябрь 2008 г.). "Рак легких". Медицинский журнал Новой Англии. 359 (13): 1367–80. Дои:10.1056 / NEJMra0802714. PMID 18815398.
- ^ Aviel-Ronen S, Blackhall FH, Shepherd FA, Tsao MS (июль 2006 г.). «Мутации K-ras в немелкоклеточной карциноме легкого: обзор». Клинический рак легких. 8 (1): 30–8. Дои:10.3816 / CLC.2006.n.030. PMID 16870043.
- ^ Кумар В., Аббас А.К., Астер Дж. К. (2013). «Глава 5». Базовая патология Роббинса (9-е изд.). Elsevier Saunders. п. 212. ISBN 978-1-4377-1781-5.
- ^ а б Якопович М., Томас А., Баласубраманиам С., Шрамп Д., Джакконе Г., Бейтс С.Е. (октябрь 2013 г.). «Нацеливание на эпигеном при раке легких: расширение подходов к эпигенетической терапии». Границы онкологии. 3 (261): 261. Дои:10.3389 / fonc.2013.00261. ЧВК 3793201. PMID 24130964.
- ^ Такахаши Н., Чен Х.Й., Харрис И.С., Стовер Д.Г., Селфорс Л.М., Бронсон Р.Т. и др. (Июнь 2018). «Раковые клетки кооптируют нейрональный редокс-чувствительный канал TRPA1 для повышения толерантности к окислительному стрессу». Раковая клетка. 33 (6): 985–1003.e7. Дои:10.1016 / j.ccell.2018.05.001. ЧВК 6100788. PMID 29805077.
- ^ Vlahopoulos S, Adamaki M, Khoury N, Zoumpourlis V, Boldogh I (февраль 2019 г.). «Роль фермента репарации ДНК OGG1 в врожденном иммунитете и его значение при раке легких». Фармакология и терапия. 194: 59–72. Дои:10.1016 / j.pharmthera.2018.09.004. ЧВК 6504182. PMID 30240635.
- ^ а б Mulvihill MS, Kratz JR, Pham P, Jablons DM, He B (февраль 2013 г.). «Роль стволовых клеток в восстановлении дыхательных путей: значение для происхождения рака легких». Китайский журнал рака. 32 (2): 71–4. Дои:10.5732 / cjc.012.10097. ЧВК 3845611. PMID 23114089.
- ^ а б Пауэлл, Калифорния, Халмос Б., Нана-Синкам СП (июль 2013 г.). «Последние данные по раку легких и мезотелиоме, 2012 г.». Американский журнал респираторной медицины и реанимации. 188 (2): 157–66. Дои:10.1164 / rccm.201304-0716UP. ЧВК 3778761. PMID 23855692.
- ^ Ост Д (2015). «Глава 110: Подход к пациенту с легочными узлами». В Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (ред.). Легочные болезни и расстройства Фишмана (5-е изд.). Макгроу-Хилл. п. 1685. ISBN 978-0-07-179672-9.
- ^ Франк Л., Квинт Л. Е. (март 2012 г.). «Случайные КТ грудной клетки: поражения щитовидной железы, увеличенные лимфатические узлы средостения и узелки в легких». Визуализация рака. 12 (1): 41–8. Дои:10.1102/1470-7330.2012.0006. ЧВК 3335330. PMID 22391408.
- ^ а б c d е Американский колледж грудных врачей; Американское торакальное общество (Сентябрь 2013). «Пять вещей, которые должны задать вопросы врачам и пациентам». Мудрый выбор: инициатива Фонд ABIM. Американский колледж грудных врачей и Американское торакальное общество. В архиве из оригинала от 3 ноября 2013 г.. Получено 6 января 2013.
- ^ Курильщиками считаются нынешние или бывшие курильщики со стажем более 1 года. Видеть страница изображений в Commons для процентов в числах. Ссылка: Таблица 2 В архиве 10 сентября 2017 г. Wayback Machine в: Kenfield SA, Wei EK, Stampfer MJ, Rosner BA, Colditz GA (июнь 2008 г.). «Сравнение аспектов курения среди четырех гистологических типов рака легких». Контроль над табаком. 17 (3): 198–204. Дои:10.1136 / tc.2007.022582. ЧВК 3044470. PMID 18390646.
- ^ а б Кумар В., Аббас А.К., Астер Дж. К. (2013). «12». Базовая патология Роббинса (9-е изд.). Elsevier Saunders. п. 505. ISBN 978-1-4377-1781-5.
- ^ Cai-Xia W, Biao L, Yan-Fen W, Ru-Song Z, Bo Y, Zhen-Feng L, Qun-Li S, Xiao-Jun Z (2014) Легочная кишечная аденокарцинома: исследование клинико-патологического и молекулярного статуса из девяти случаев Int J Clin Exp Pathol 7 (3): 1266–1274
- ^ Субраманиан Дж., Говиндан Р. (февраль 2007 г.). «Рак легких у никогда не куривших: обзор». Журнал клинической онкологии. 25 (5): 561–70. Дои:10.1200 / JCO.2006.06.8015. PMID 17290066.
- ^ Raz DJ, He B, Rosell R, Jablons DM (март 2006 г.). «Бронхиолоальвеолярная карцинома: обзор». Клинический рак легких. 7 (5): 313–22. Дои:10.3816 / CLC.2006.n.012. PMID 16640802.
- ^ Ферри Ф.Ф. (2014). Электронная книга Ferri's Clinical Advisor, 2015: 5 книг в 1. Elsevier Health Sciences. п. 708. ISBN 978-0-323-08430-7.
- ^ Рости Дж., Бевилаква Дж., Бидоли П., Порталоне Л., Санто А., Дженестрети Дж. (Март 2006 г.). «Мелкоклеточный рак легкого». Анналы онкологии. 17 Дополнение 2 (Дополнение 2): II5-10. Дои:10.1093 / annonc / mdj910. PMID 16608983.
- ^ Со Дж. Б., Им Дж. Дж., Гу Дж. М., Чунг М. Дж., Ким М.Й. (1 марта 2001 г.). «Атипичные метастазы в легкие: спектр рентгенологических данных». Радиография. 21 (2): 403–17. Дои:10.1148 / радиография.21.2.g01mr17403. PMID 11259704.
- ^ Тан Д., Зандер Д.С. (январь 2008 г.). «Иммуногистохимия для оценки новообразований легких и плевры: обзор и обновление». Международный журнал клинической и экспериментальной патологии. 1 (1): 19–31. ЧВК 2480532. PMID 18784820.
- ^ а б Коннолли Дж. Л., Голдсмит Дж. Д., Ван Х. Х. и др. (2010). «37: Принципы онкологической патологии». Holland-Frei Cancer Medicine (8-е изд.). Народное медицинское издательство. ISBN 978-1-60795-014-1.
- ^ «8-е издание, краткое изложение стадий TNM рака легких» (PDF). Международная ассоциация по изучению рака легких. Архивировано из оригинал (PDF) 17 июня 2018 г.. Получено 30 мая 2018.
- ^ Van Schil PE, Rami-Porta R, Asamura H (март 2018 г.). «8-е издание TNM по раку легких: критический анализ». Анналы трансляционной медицины. 6 (5): 87. Дои:10.21037 / атм.2017.06.45. ЧВК 5890051. PMID 29666810.
- ^ а б c Рами-Порта Р., Кроули Дж. Дж., Голдстроу П. (февраль 2009 г.). «Пересмотренная система стадирования TNM для рака легких» (PDF). Анналы торакальной и сердечно-сосудистой хирургии. 15 (1): 4–9. PMID 19262443. В архиве (PDF) из оригинала от 9 мая 2012 г.
- ^ Дела Круз CS, Tanoue LT, Matthay RA (декабрь 2011 г.). «Рак легкого: эпидемиология, этиология и профилактика». Клиники грудной медицины. 32 (4): 605–44. Дои:10.1016 / j.ccm.2011.09.001. ЧВК 3864624. PMID 22054876.
- ^ Goodman GE (ноябрь 2002 г.). «Рак легких. 1: профилактика рака легких». Грудная клетка. 57 (11): 994–9. Дои:10.1136 / торакс.57.11.994. ЧВК 1746232. PMID 12403886.
- ^ Макнабола А., Гилл Л. В. (февраль 2009 г.). «Контроль за табачным дымом в окружающей среде: обзор политики». Международный журнал экологических исследований и общественного здравоохранения. 6 (2): 741–58. Дои:10.3390 / ijerph6020741. ЧВК 2672352. PMID 19440413.
- ^ Панди Г (февраль 2005 г.). «Курильщикам Бутана грозит общественный запрет». BBC. В архиве из оригинала 7 апреля 2008 г.. Получено 7 сентября 2007.
- ^ Панди Г. (2 октября 2008 г.). «Индийский запрет на курение в общественных местах». BBC. В архиве из оригинала 15 января 2009 г.. Получено 25 апреля 2012.
- ^ а б «Агентство ООН по здравоохранению призывает к полному запрету рекламы табака для защиты молодежи» (Пресс-релиз). Объединенные Нации Служба новостей. 30 мая 2008 г. В архиве из оригинала от 4 марта 2016 г.
- ^ Gutierrez A, Suh R, Abtin F, Genshaft S, Brown K (июнь 2013 г.). «Скрининг на рак легких». Семинары по интервенционной радиологии. 30 (2): 114–20. Дои:10.1055 / с-0033-1342951. ЧВК 3709936. PMID 24436526.
- ^ а б Усман Али М., Миллер Дж., Пирсон Л., Фицпатрик-Льюис Д., Кенни М., Шерифали Д., Райна П. (август 2016 г.). «Скрининг рака легких: систематический обзор и метаанализ». Профилактическая медицина. 89: 301–314. Дои:10.1016 / j.ypmed.2016.04.015. PMID 27130532.
- ^ Яклич М.Т., Якобсон Флорида, Остин Дж. Х., Филд Дж. К., Джетт Дж. Р., Кешавджи С. и др. (Июль 2012 г.). «Рекомендации Американской ассоциации торакальной хирургии по скринингу рака легких с использованием низкодозных компьютерных томографов для выживших после рака легких и других групп высокого риска». Журнал торакальной и сердечно-сосудистой хирургии. 144 (1): 33–8. Дои:10.1016 / j.jtcvs.2012.05.060. PMID 22710039.
- ^ а б Бах П.Б., Миркин Д.Н., Оливер Т.К., Аззоли К.Г., Берри Д.А., Броули О.В. и др. (Июнь 2012 г.). «Польза и вред компьютерной томографии для выявления рака легких: систематический обзор». JAMA. 307 (22): 2418–29. Дои:10.1001 / jama.2012.5521. ЧВК 3709596. PMID 22610500.
- ^ а б Аберль Д.Р., Абтин Ф., Браун К. (март 2013 г.). «Компьютерный томографический скрининг на рак легких: наконец-то он появился? Значение национального исследования по скринингу легких». Журнал клинической онкологии. 31 (8): 1002–8. Дои:10.1200 / JCO.2012.43.3110. ЧВК 3589698. PMID 23401434.
- ^ Мансер Р., Летаби А., Ирвинг Л. Б., Стоун С., Бирнс Г., Абрамсон М. Дж., Кэмпбелл Д. (июнь 2013 г.). «Скрининг на рак легких». Кокрановская база данных систематических обзоров. 6 (6): CD001991. Дои:10.1002 / 14651858.CD001991.pub3. ЧВК 6464996. PMID 23794187.
- ^ а б Мойер В.А. (март 2014 г.). «Скрининг на рак легких: рекомендации Рабочей группы США по профилактическим услугам». Анналы внутренней медицины. 160 (5): 330–8. Дои:10.7326 / M13-2771. PMID 24378917.
- ^ Болдуин Д. Р., Ханселл Д. М., Даффи С. В., Филд-Дж. К. (март 2014 г.). «Скрининг рака легких с помощью компьютерной томографии с низкой дозой облучения». BMJ. 348: g1970. Дои:10.1136 / bmj.g1970. PMID 24609921. S2CID 39926785.
- ^ а б c Фабрициус П., Ланге П. (июль – сентябрь 2003 г.). «Диета и рак легких». Monaldi Archives for Chest Disease = Archivio Monaldi per le Malattie del Torace. 59 (3): 207–11. PMID 15065316.
- ^ Фриц Х., Кеннеди Д., Фергюссон Д., Фернандес Р., Дусетт С., Кули К. и др. (2011). «Витамин А и производные ретиноидов при раке легких: систематический обзор и метаанализ». PLOS ONE. 6 (6): e21107. Bibcode:2011PLoSO ... 621107F. Дои:10.1371 / journal.pone.0021107. ЧВК 3124481. PMID 21738614.
- ^ Herr C, Greulich T., Koczulla RA, Meyer S, Zakharkina T, Branscheidt M, et al. (Март 2011 г.). «Роль витамина D при заболеваниях легких: ХОБЛ, астма, инфекции и рак». Респираторные исследования. 12 (1): 31. Дои:10.1186/1465-9921-12-31. ЧВК 3071319. PMID 21418564.
- ^ Альшараири Н.А. (март 2019 г.). «Влияние пищевых добавок на риск астмы и рака легких у курильщиков и некурящих: обзор литературы». Питательные вещества. 11 (4): 725. Дои:10.3390 / nu11040725. ЧВК 6521315. PMID 30925812.
- ^ а б Key TJ (январь 2011 г.). «Фрукты и овощи и риск рака». Британский журнал рака. 104 (1): 6–11. Дои:10.1038 / sj.bjc.6606032. ЧВК 3039795. PMID 21119663.
- ^ Брэдбери К.Э., Эпплби П.Н., Ки Т.Дж. (июль 2014 г.). «Потребление фруктов, овощей и клетчатки в связи с риском рака: выводы Европейского проспективного исследования рака и питания (EPIC)». Американский журнал клинического питания. 100 Приложение 1 (Приложение 1): 394S – 8S. Дои:10.3945 / ajcn.113.071357. PMID 24920034.
- ^ Сунь Й, Ли З, Ли Дж, Ли З, Хан Дж (март 2016 г.). «Здоровая диета снижает риск рака легких: систематический обзор и метаанализ». Питательные вещества. 8 (3): 134. Дои:10.3390 / nu8030134. ЧВК 4808863. PMID 26959051.
- ^ Феррелл Б., Кочивас М., Граннис Ф., Харрингтон А. (апрель 2011 г.). «Паллиативная помощь при раке легких». Хирургические клиники Северной Америки. 91 (2): 403–17, ix. Дои:10.1016 / j.suc.2010.12.003. ЧВК 3655433. PMID 21419260.
- ^ Османи Л., Аскин Ф., Габриэльсон Э., Ли К.К. (октябрь 2018 г.). «Текущие рекомендации ВОЗ и критическая роль иммуногистохимических маркеров в подклассе немелкоклеточной карциномы легкого (НМРЛ): переход от таргетной терапии к иммунотерапии». Семинары по биологии рака. 52 (Чт 1): 103–109. Дои:10.1016 / j.semcancer.2017.11.019. ЧВК 5970946. PMID 29183778.
- ^ а б Цзэн Л, Ю X, Ю Т, Сяо Дж, Хуан И (июнь 2019). «Меры по отказу от курения у людей с диагнозом рака легких». Кокрановская база данных систематических обзоров. 6: CD011751. Дои:10.1002 / 14651858.CD011751.pub3. ЧВК 6554694. PMID 31173336.
- ^ Peddle-McIntyre CJ, Singh F, Thomas R, Newton RU, Galvão DA, Cavalheri V (февраль 2019 г.). «Тренировка с упражнениями при запущенном раке легких». Кокрановская база данных систематических обзоров. 2: CD012685. Дои:10.1002 / 14651858.CD012685.pub2. ЧВК 6371641. PMID 30741408.
- ^ Cavalheri V, Burtin C, Formico VR, Nonoyama ML, Jenkins S, Spruit MA, Hill K (июнь 2019 г.). «Физические упражнения, проводимые людьми в течение 12 месяцев после резекции легкого по поводу немелкоклеточного рака легкого». Кокрановская база данных систематических обзоров. 6: CD009955. Дои:10.1002 / 14651858.CD009955.pub3. ЧВК 6571512. PMID 31204439.
- ^ а б c Дриссен Э.Дж., Пеэтерс М.Э., Бонжерс Б.К., Маас Х.А., Бутсма ГП, ван Митерен Н.Л., Янссен-Хейнен М.Л. (июнь 2017 г.). «Влияние предварительной реабилитации и реабилитации, включая домашний компонент, на физическую форму, приверженность, переносимость лечения и выздоровление у пациентов с немелкоклеточным раком легкого: систематический обзор» (PDF). Критические обзоры в онкологии / гематологии. 114: 63–76. Дои:10.1016 / j.critrevonc.2017.03.031. PMID 28477748.
- ^ Себио Гарсиа Р., Яньес Браге М.И., Хименес Мулхойзен Е., Грейнджер К.Л., Денехи Л. (сентябрь 2016 г.). «Функциональные и послеоперационные результаты после предоперационных тренировок у пациентов с раком легких: систематический обзор и метаанализ». Интерактивная сердечно-сосудистая и торакальная хирургия. 23 (3): 486–97. Дои:10.1093 / icvts / ivw152. PMID 27226400.
- ^ а б Schmidt-Hansen M, Baldwin DR, Hasler E, Zamora J, Abraira V, Roqué I, Figuls M (ноябрь 2014 г.). «ПЭТ-КТ для оценки поражения лимфатических узлов средостения у пациентов с подозрением на резектабельный немелкоклеточный рак легкого». Кокрановская база данных систематических обзоров (11): CD009519. Дои:10.1002 / 14651858.CD009519.pub2. ЧВК 6472607. PMID 25393718.
- ^ Чанг Л., член парламента Риверы (2015). «Глава 112: Клиническая оценка, диагностика и определение стадии рака легких». В Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (ред.). Легочные болезни и расстройства Фишмана (5-е изд.). Макгроу-Хилл. п. 1728. ISBN 978-0-07-179672-9.
- ^ Резник С.И., Смайт В.Р. (2015). «Глава 113: Лечение немелкоклеточного рака легкого: хирургия». В Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (ред.). Легочные болезни и расстройства Фишмана (5-е изд.). Макгроу-Хилл. С. 1737–1738. ISBN 978-0-07-179672-9.
- ^ Алам Н., Флорес Р.М. (июль – сентябрь 2007 г.). «Видеоассистированная лобэктомия торакальной хирургии (VATS): доказательная база». JSLS. 11 (3): 368–74. ЧВК 3015831. PMID 17931521.
- ^ Рут Н.М., Андраде Р.С. (июнь 2010 г.). «Лучше ли лобэктомия ВАТС: периоперационно, биологически и онкологически?». Летопись торакальной хирургии. 89 (6): S2107-11. Дои:10.1016 / j.athoracsur.2010.03.020. PMID 20493991.
- ^ Саймон Г.Р., Турризи А. (сентябрь 2007 г.). «Ведение мелкоклеточного рака легкого: руководящие принципы клинической практики ACCP (2-е издание)». Грудь. 132 (3 Прил.): 324S – 339S. Дои:10.1378 / сундук.07-1385. PMID 17873178.
- ^ Гольдштейн С.Д., Ян СК (октябрь 2011 г.). «Роль хирургии при мелкоклеточном раке легкого». Клиники хирургической онкологии Северной Америки. 20 (4): 769–77. Дои:10.1016 / j.soc.2011.08.001. PMID 21986271.
- ^ Мансер Р., Райт Дж., Харт Д., Бирнс Дж., Кэмпбелл Д. А. (январь 2005 г.). «Хирургия немелкоклеточного рака легких на ранней стадии». Кокрановская база данных систематических обзоров (1): CD004699. Дои:10.1002 / 14651858.CD004699.pub2. PMID 15674959.
- ^ О'Рурк Н., Роке I, Фигульс М., Фарре Бернадо Н., Макбет Ф. (июнь 2010 г.). «Параллельная химиолучевая терапия при немелкоклеточном раке легкого». Кокрановская база данных систематических обзоров (6): CD002140. Дои:10.1002 / 14651858.CD002140.pub3. PMID 20556756.
- ^ Арриагада Р., Голдстроу П., Ле Шевалье Т. (2002). Оксфордский учебник онкологии (2-е изд.). Издательство Оксфордского университета. п. 2094. ISBN 978-0-19-262926-5.
- ^ Hatton MQ, Мартин Дж. Э. (июнь 2010 г.). «Непрерывная гиперфракционированная ускоренная лучевая терапия (ДИАГРАММА) и условно фракционированная лучевая терапия в лечении немелкоклеточного рака легкого: обзор и рассмотрение будущих направлений». Клиническая онкология. 22 (5): 356–64. Дои:10.1016 / j.clon.2010.03.010. PMID 20399629.
- ^ а б Fuentes R, Bonfill X, Exposito J (январь 2006 г.). «Хирургия против радиохирургии для пациентов с одиночным метастазом в мозг от немелкоклеточного рака легкого». Кокрановская база данных систематических обзоров (1): CD004840. Дои:10.1002 / 14651858.CD004840.pub2. ЧВК 7388845. PMID 16437498.
- ^ Группа исследователей метаанализа ПОРТ (апрель 2005 г.). Rydzewska L (ред.). «Послеоперационная лучевая терапия немелкоклеточного рака легкого». Кокрановская база данных систематических обзоров. 10 (2): CD002142. Дои:10.1002 / 14651858.CD002142.pub2. PMID 15846628.
- ^ Ле Пешу C (2011). «Роль послеоперационной лучевой терапии в удаленном немелкоклеточном раке легкого: переоценка на основе новых данных». Онколог. 16 (5): 672–81. Дои:10.1634 / теонколог.2010-0150. ЧВК 3228187. PMID 21378080.
- ^ Pijls-Johannesma MC, De Ruysscher D, Lambin P, Rutten I, Vansteenkiste JF (январь 2005 г.). «Ранняя и поздняя лучевая терапия грудной клетки при мелкоклеточном раке легкого на ограниченной стадии». Кокрановская база данных систематических обзоров (1): CD004700. Дои:10.1002 / 14651858.CD004700.pub2. PMID 15674960.
- ^ Икусима Х (февраль 2010 г.). «Лучевая терапия: современное состояние и будущее». Журнал медицинских исследований. 57 (1–2): 1–11. Дои:10.2152 / jmi.57.1. PMID 20299738.
- ^ Ревейс Л., Руэда-младший, Кардона А.Ф. (декабрь 2012 г.). «Паллиативная эндобронхиальная брахитерапия немелкоклеточного рака легкого». Кокрановская база данных систематических обзоров. 12: CD004284. Дои:10.1002 / 14651858.CD004284.pub3. PMID 23235606.
- ^ Лестер Дж. Ф., Коулз Б., Макбет ФР (апрель 2005 г.). «Профилактическое облучение черепа для предотвращения метастазов в мозг у пациентов, проходящих радикальное лечение немелкоклеточного рака легкого». Кокрановская база данных систематических обзоров (2): CD005221. Дои:10.1002 / 14651858.CD005221. PMID 15846743.
- ^ Paumier A, Cuenca X, Le Péchoux C (июнь 2011 г.). «Профилактическое краниальное облучение при раке легкого». Отзывы о лечении рака. 37 (4): 261–5. Дои:10.1016 / j.ctrv.2010.08.009. PMID 20934256.
- ^ Жирар Н., Морнекс Ф (октябрь 2011 г.). «[Стереотаксическая лучевая терапия немелкоклеточного рака легкого: от концепции к клинической реальности. Обновление 2011 г.]». Радиотерапия рака. 15 (6–7): 522–6. Дои:10.1016 / j.canrad.2011.07.241. PMID 21889901.
- ^ Фэйрчайлд А., Харрис К., Барнс Э, Вонг Р., Лутц С., Безжак А. и др. (Август 2008 г.). «Паллиативная торакальная лучевая терапия при раке легких: систематический обзор». Журнал клинической онкологии. 26 (24): 4001–11. Дои:10.1200 / JCO.2007.15.3312. PMID 18711191.
- ^ а б Стивенс Р., Макбет Ф, Той Э, Коулз Б., Лестер Дж. Ф. (январь 2015 г.). Стивенс Р. (ред.). «Режимы паллиативной лучевой терапии для пациентов с торакальными симптомами немелкоклеточного рака легкого». Кокрановская база данных систематических обзоров. 1: CD002143. Дои:10.1002 / 14651858.CD002143.pub4. ЧВК 7017846. PMID 25586198.
- ^ Hann CL, Rudin CM (ноябрь 2008 г.). «Лечение мелкоклеточного рака легких: постепенные изменения, но надежда на будущее». Онкология. 22 (13): 1486–92. ЧВК 4124612. PMID 19133604.
- ^ Мюррей Н., Турриси А.Т. (март 2006 г.). «Обзор лечения первой линии мелкоклеточного рака легкого». Журнал торакальной онкологии. 1 (3): 270–8. Дои:10.1016 / с1556-0864 (15) 31579-3. PMID 17409868. S2CID 30651522.
- ^ Азим Х.А., Ганти А.К. (март 2007 г.). «Варианты лечения рецидивирующего мелкоклеточного рака легкого». Противораковые препараты. 18 (3): 255–61. Дои:10.1097 / CAD.0b013e328011a547. PMID 17264756. S2CID 37490814.
- ^ MacCallum C, Gillenwater HH (июль 2006 г.). «Вторая линия лечения мелкоклеточного рака легкого». Текущие онкологические отчеты. 8 (4): 258–64. Дои:10.1007 / s11912-006-0030-8. PMID 17254525. S2CID 3127080.
- ^ а б NSCLC Meta-Analyses Collaborative Group (октябрь 2008 г.). «Химиотерапия в дополнение к поддерживающей терапии улучшает выживаемость при распространенном немелкоклеточном раке легкого: систематический обзор и метаанализ данных отдельных пациентов из 16 рандомизированных контролируемых исследований». Журнал клинической онкологии. 26 (28): 4617–25. Дои:10.1200 / JCO.2008.17.7162. ЧВК 2653127. PMID 18678835.
- ^ Карр Л.Л., Джетт-младший (2015). «Глава 114: Лечение немелкоклеточного рака легкого: химиотерапия». В Grippi MA, Elias JA, Fishman JA, Kotloff RM, Pack AI, Senior RM (ред.). Легочные болезни и расстройства Фишмана (5-е изд.). Макгроу-Хилл. п. 1752 г. ISBN 978-0-07-179672-9.
- ^ а б Клегг А., Скотт Д.А., Хьюитсон П., Сидху М., Во Н. (январь 2002 г.). «Клиническая и экономическая эффективность паклитаксела, доцетаксела, гемцитабина и винорелбина при немелкоклеточном раке легкого: систематический обзор». Грудная клетка. 57 (1): 20–8. Дои:10.1136 / торакс.57.1.20. ЧВК 1746188. PMID 11809985.
- ^ Фулд А.Д., Драгнев К.Х., Ригас-младший (июнь 2010 г.). «Пеметрексед при запущенном немелкоклеточном раке легкого». Мнение эксперта по фармакотерапии. 11 (8): 1387–402. Дои:10.1517/14656566.2010.482560. PMID 20446853. S2CID 20242769.
- ^ а б Амарасена И.Ю., Чаттерджи С., Уолтерс Дж. А., Вуд-Бейкер Р., Фонг К. М. (август 2015 г.). «Платиновые и неплатиновые схемы химиотерапии при мелкоклеточном раке легких». Кокрановская база данных систематических обзоров (8): CD006849. Дои:10.1002 / 14651858.CD006849.pub3. ЧВК 7263420. PMID 26233609.
- ^ Santos FN, de Castria TB, Cruz MR, Riera R (октябрь 2015 г.). «Химиотерапия при запущенном немелкоклеточном раке легкого у пожилых людей». Кокрановская база данных систематических обзоров (10): CD010463. Дои:10.1002 / 14651858.CD010463.pub2. ЧВК 6759539. PMID 26482542.
- ^ Bonfill X, Serra C, Sacristán M, Nogué M, Losa F, Montesinos J (2002). «Химиотерапия второй линии немелкоклеточного рака легкого». Кокрановская база данных систематических обзоров (2): CD002804. Дои:10.1002 / 14651858.CD002804. ЧВК 6993946. PMID 12076452.
- ^ Карбон Д.П., Фелип Э. (сентябрь 2011 г.). «Адъювантная терапия немелкоклеточного рака легкого: перспективы и парадигмы лечения в будущем». Клинический рак легких. 12 (5): 261–71. Дои:10.1016 / j.cllc.2011.06.002. PMID 21831720.
- ^ а б Le Chevalier T (октябрь 2010 г.). «Адъювантная химиотерапия резектабельного немелкоклеточного рака легкого: куда она идет?». Анналы онкологии. 21 Дополнение 7 (Дополнение 7): vii196-8. Дои:10.1093 / annonc / mdq376. PMID 20943614.
- ^ Burdett S, Pignon JP, Tierney J, Tribodet H, Stewart L, Le Pechoux C и др. (Март 2015 г.). «Адъювантная химиотерапия при удаленном немелкоклеточном раке легкого на ранней стадии». Кокрановская база данных систематических обзоров (3): CD011430. Дои:10.1002 / 14651858.CD011430. HDL:1854 / LU-7072338. PMID 25730344.
- ^ Хэ Дж, Шен Дж, Ян Ц., Цзян Л., Лян В., Ши Х и др. (Июнь 2015 г.). «Адъювантная химиотерапия при полностью удаленном немелкоклеточном раке легкого на стадии IB: систематический обзор и метаанализ». Лекарство. 94 (22): e903. Дои:10.1097 / MD.0000000000000903. ЧВК 4616365. PMID 26039122.
- ^ NSCLC Meta-analysis Collaborative Group (май 2014 г.). «Предоперационная химиотерапия немелкоклеточного рака легкого: систематический обзор и метаанализ данных отдельных участников». Ланцет. 383 (9928): 1561–71. Дои:10.1016 / S0140-6736 (13) 62159-5. ЧВК 4022989. PMID 24576776.
- ^ Бурдетт С.С., Стюарт Л.А., Рыдзевска Л. (июль 2007 г.). «Химиотерапия и хирургия по сравнению с хирургией только при немелкоклеточном раке легкого». Кокрановская база данных систематических обзоров (3): CD006157. Дои:10.1002 / 14651858.CD006157.pub2. PMID 17636828.
- ^ а б Совместная группа по немелкоклеточному раку легких (2000). «Химиотерапия немелкоклеточного рака легкого». Кокрановская база данных систематических обзоров (2): CD002139. Дои:10.1002 / 14651858.CD002139. PMID 10796867.
- ^ Нунан К.Л., Хо Ц., Ласкин Дж., Мюррей Н. (ноябрь 2015 г.). «Влияние эволюции химиотерапии первой линии на неуклонное повышение выживаемости в расширенных клинических испытаниях немелкоклеточного рака легкого». Журнал торакальной онкологии. 10 (11): 1523–31. Дои:10.1097 / JTO.0000000000000667. PMID 26536194.
- ^ Соренсон С., Глимелиус Б., Нигрен П. (2001). «Систематический обзор эффектов химиотерапии при немелкоклеточном раке легкого». Acta Oncologica. 40 (2–3): 327–39. Дои:10.1080/02841860151116402. PMID 11441939.
- ^ Клегг А, Скотт Д.А., Сидху М., Хьюитсон П., Во Н. (2001). «Быстрый и систематический обзор клинической эффективности и экономической эффективности паклитаксела, доцетаксела, гемцитабина и винорелбина при немелкоклеточном раке легкого». Оценка медицинских технологий. 5 (32): 1–195. Дои:10,3310 / hta5320. PMID 12065068. В архиве с оригинала от 30 августа 2017 года.
- ^ Совместная группа по немелкоклеточному раку легких (май 2010 г.). «Химиотерапия и поддерживающая терапия по сравнению с одной только поддерживающей терапией при распространенном немелкоклеточном раке легкого». Кокрановская база данных систематических обзоров (5): CD007309. Дои:10.1002 / 14651858.CD007309.pub2. PMID 20464750.
- ^ а б c Гринхал Дж., Дван К., Боланд А., Бейтс В., Веккио Ф., Дандар Ю. и др. (Май 2016). «Лечение первой линии не плоскоклеточного немелкоклеточного рака легкого, вызывающего мутацию передового рецептора эпидермального фактора роста (EGFR)». Кокрановская база данных систематических обзоров (5): CD010383. Дои:10.1002 / 14651858.CD010383.pub2. PMID 27223332.
- ^ Сим Э. Х., Ян И. А., Вуд-Бейкер Р., Боуман Р. В., Фонг К. М. (январь 2018 г.). «Гефитиниб при запущенном немелкоклеточном раке легкого». Кокрановская база данных систематических обзоров. 1: CD006847. Дои:10.1002 / 14651858.CD006847.pub2. ЧВК 6491254. PMID 29336009.
- ^ Д'Антонио С., Пассаро А., Гори Б., Дель Синьор Е., Мильорино М.Р., Риккарди С. и др. (Май 2014 г.). «Метастазы в кости и мозг при раке легких: последние достижения в терапевтических стратегиях». Терапевтические достижения в медицинской онкологии. 6 (3): 101–14. Дои:10.1177/1758834014521110. ЧВК 3987652. PMID 24790650.
- ^ «Лечение немелкоклеточного рака легких». Национальный институт рака. 2019. Получено 18 июн 2019.
- ^ «Лечение мелкоклеточного рака легких». Национальный институт рака. 2019. Получено 18 июн 2019.
- ^ а б c d е Насер Н.Дж., Горенберг М., Агбарья А. (ноябрь 2020 г.). «Первая линия иммунотерапии немелкоклеточного рака легкого». Фармацевтические препараты. 13 (11): 373. Дои:10.3390 / ph13110373. ЧВК 7695295. PMID 33171686.
- ^ Чжу Дж., Ли Р., Тиселиус Э, Роуди Р., Тегарариан О, Суо С., Сонг Х. (декабрь 2017 г.). «Иммунотерапия (за исключением ингибиторов контрольных точек) немелкоклеточного рака легкого стадии I-III, леченная хирургическим путем или лучевой терапией с лечебной целью». Кокрановская база данных систематических обзоров. 12 (12): CD011300. Дои:10.1002 / 14651858.CD011300.pub2. ЧВК 6486009. PMID 29247502.
- ^ Лазарус Д.Р., Ипен Г.А. (2014). «Глава 16: Бронхоскопические вмешательства при раке легких». В Roth JA, Hong WK, Komaki RU (ред.). Рак легких (4-е изд.). Вили-Блэквелл. ISBN 978-1-118-46874-6.
- ^ Khemasuwan D, Mehta AC, Wang KP (декабрь 2015 г.). «Прошлое, настоящее и будущее эндобронхиальной лазерной фоторезекции». Журнал торакальных болезней. 7 (Приложение 4): S380-8. Дои:10.3978 / j.issn.2072-1439.2015.12.55. ЧВК 4700383. PMID 26807285.
- ^ Парих РБ, Кирч Р.А., Смит Т.Дж., Темел Дж.С. (декабрь 2013 г.). «Ранняя специализированная паллиативная помощь - перевод данных из онкологии в практику». Медицинский журнал Новой Англии. 369 (24): 2347–51. Дои:10.1056 / nejmsb1305469. ЧВК 3991113. PMID 24328469.
- ^ Келли А.С., Майер Д.Е. (август 2010 г.). «Паллиативная помощь - меняющаяся парадигма». Медицинский журнал Новой Англии. 363 (8): 781–2. Дои:10.1056 / NEJMe1004139. PMID 20818881.
- ^ а б Принц-Поль М (апрель 2009 г.). «Когда хоспис - лучший вариант: возможность пересмотреть цели». Онкология. 23 (4 Suppl Nurse Ed): 13–7. PMID 19856592.
- ^ а б c d е Руэда Дж. Р., Сола I, Паскуаль А., Субирана Казакуберта М. (сентябрь 2011 г.). «Неинвазивные вмешательства для улучшения самочувствия и качества жизни пациентов с раком легких». Кокрановская база данных систематических обзоров (9): CD004282. Дои:10.1002 / 14651858.CD004282.pub3. ЧВК 7197367. PMID 21901689.
- ^ Ridge CA, McErlean AM, Ginsberg MS (июнь 2013 г.). «Эпидемиология рака легких». Семинары по интервенционной радиологии. 30 (2): 93–8. Дои:10.1055 / с-0033-1342949. ЧВК 3709917. PMID 24436524.
- ^ «Статистика выживаемости при раке легких». Cancer Research UK. 15 мая 2015. В архиве из оригинала 7 октября 2014 г.
- ^ «Статистика выживаемости при раке легких». В архиве из оригинала 9 октября 2014 г.. Получено 28 октября 2014.
- ^ Редакционная коллегия PDQ по лечению взрослых (2002). «Лечение немелкоклеточного рака легких». PDQ для медицинских работников. PMID 26389304.
- ^ «Лечение мелкоклеточного рака легких». PDQ для медицинских работников. Национальный институт рака. 2012 г. В архиве из оригинала 13 мая 2012 г.. Получено 16 мая 2012.
- ^ Спиро SG (2010). «18.19.1». Оксфордский учебник медицины (5-е изд.). ОУП Оксфорд. ISBN 978-0-19-920485-4.
- ^ Рек М., Родригес-Абреу Д., Робинсон А.Г., Хуэй Р., Чёсзи Т., Фюлоп А. и др. (Ноябрь 2016 г.). «Пембролизумаб против химиотерапии для PD-L1-положительного немелкоклеточного рака легкого». Медицинский журнал Новой Англии. 375 (19): 1823–1833. Дои:10.1056 / NEJMoa1606774. PMID 27718847.
- ^ Данные SEER (SEER.cancer.gov) Средний возраст больных раком при постановке диагноза 2002–2003 гг. В архиве 16 мая 2011 г. Wayback Machine
- ^ Данные SEER (SEER.cancer.gov) Средний возраст больных раком на момент смерти, 2002–2006 гг. В архиве 22 июля 2011 г. Wayback Machine
- ^ Slatore CG, Au DH, Gould MK (ноябрь 2010 г.). «Официальный систематический обзор Американского торакального общества: статус страхования и различия в практике и результатах лечения рака легких». Американский журнал респираторной медицины и реанимации. 182 (9): 1195–205. Дои:10.1164 / rccm.2009-038ST. PMID 21041563.
- ^ Стюарт Б.В., Wild CP (2014). Мировой доклад о раке 2014 г.. Лион: IARC Press. С. 350–352. ISBN 978-92-832-0429-9.
- ^ Джемал А., Тивари Р.С., Мюррей Т., Гафур А., Сэмюэлс А., Уорд Е. и др. (2004). «Статистика рака, 2004». Ca. 54 (1): 8–29. Дои:10.3322 / canjclin.54.1.8. PMID 14974761. S2CID 46140579.
- ^ Проктор Р.Н. (март 2012 г.). «История открытия связи между сигаретой и раком легких: доказательные традиции, корпоративное отрицание, глобальные потери». Контроль над табаком. 21 (2): 87–91. Дои:10.1136 / tobaccocontrol-2011-050338. PMID 22345227.
- ^ Лум К.Л., Полански-младший, Джеклер Р.К., Гланц С.А. (октябрь 2008 г.). «Подписано, запечатано и доставлено:« Большой табак »в Голливуде, 1927–1951». Контроль над табаком. 17 (5): 313–23. Дои:10.1136 / tc.2008.025445. ЧВК 2602591. PMID 18818225. В архиве из оригинала от 4 апреля 2009 г.
- ^ Ловато К., Уоттс А., Стед Л.Ф. (октябрь 2011 г.). «Влияние рекламы и стимулирования продажи табачных изделий на рост курения среди подростков». Кокрановская база данных систематических обзоров (10): CD003439. Дои:10.1002 / 14651858.CD003439.pub2. ЧВК 7173757. PMID 21975739.
- ^ Кемп ФБ (июль – сентябрь 2009 г.). «Политика бездымной среды в Европе. Обзор». Пневмология. 58 (3): 155–8. PMID 19817310.
- ^ Шарлу А., Кууа Е., Волков Н., Смолл Д., Паули Г., Крейсман Н. (февраль 1997 г.). «Рост заболеваемости аденокарциномой легких: реальность или артефакт? Обзор эпидемиологии аденокарциномы легких». Международный журнал эпидемиологии. 26 (1): 14–23. Дои:10.1093 / ije / 26.1.14. PMID 9126499. В архиве из оригинала от 5 декабря 2008 г.
- ^ Кадара Х., Каббут М., Вистуба II (январь 2012 г.). «Легочная аденокарцинома: обновленная форма в 2011 году». Респирология. 17 (1): 50–65. Дои:10.1111 / j.1440-1843.2011.02095.x. ЧВК 3911779. PMID 22040022.
- ^ Национальный институт рака; Информационные бюллетени SEER stat: Lung and Bronchus. Эпидемиология надзора и конечные результаты. 2010 г. [1] В архиве 6 июля 2014 г. Wayback Machine
- ^ «Гендер в исследовании рака легких и курения» (PDF). Всемирная организация здоровья. 2004. В архиве (PDF) из оригинала 14 июня 2007 г.. Получено 26 мая 2007.
- ^ Чжан Дж., Оу Дж. Х., Бай С. Х. (ноябрь 2011 г.). «Табакокурение в Китае: распространенность, бремя болезней, проблемы и стратегии на будущее». Респирология. 16 (8): 1165–72. Дои:10.1111 / j.1440-1843.2011.02062.x. PMID 21910781. S2CID 29359959.
- ^ Бехера Д., Баламугеш Т. (2004). «Рак легких в Индии» (PDF). Индийский журнал болезней грудной клетки и смежных наук. 46 (4): 269–81. PMID 15515828. В архиве (PDF) из оригинала 17 декабря 2008 г.
- ^ «ПОЧИТАЕМ ВЕТЕРАНОВ ХОРОШИМ ЗДОРОВЬЕМ». 7 ноября 2014 г. Архивировано с оригинал 28 ноября 2015 г.. Получено 1 декабря 2015.
- ^ «Рак легких, поражающий ветеранов и военных». Архивировано из оригинал 8 декабря 2015 г.. Получено 1 декабря 2015.
- ^ «Статистика заболеваемости раком». Cancer Research UK. 13 мая 2015. В архиве из оригинала 2 января 2017 г.. Получено 20 декабря 2016.
- ^ «Статистика рака легких». Cancer Research UK. 14 мая 2015. В архиве из оригинала 12 мая 2015 г.. Получено 20 декабря 2016.
- ^ Морганьи ГБ (1761 г.). De sedibus et causis morborum per anatomen indagatis. ПР 24830495M.
- ^ Байль Г. (1810 г.). Recherches sur la phthisie pulmonaire (На французском). Париж. ПР 15355651W.
- ^ а б Витчи Х (ноябрь 2001 г.). «Краткий анамнез рака легких». Токсикологические науки. 64 (1): 4–6. Дои:10.1093 / toxsci / 64.1.4. PMID 11606795. В архиве из оригинала от 9 марта 2007 г.
- ^ Адлер I (1912). Первичные злокачественные новообразования легких и бронхов. Нью-Йорк: Лонгманс, Грин и компания. OCLC 14783544. ПР 24396062M., цитируется в Спиро С.Г., Сильвестри Г.А. (сентябрь 2005 г.). «Сто лет рака легких». Американский журнал респираторной медицины и реанимации. 172 (5): 523–9. Дои:10.1164 / rccm.200504-531OE. PMID 15961694.
- ^ Grannis FW. «История курения сигарет и рака легких». Smokinglungs.com. Архивировано из оригинал 18 июля 2007 г.. Получено 6 августа 2007.
- ^ Проктор Р. (2000). Нацистская война с раком. Издательство Принстонского университета. стр.173–246. ISBN 978-0-691-00196-8.
- ^ Doll R, Hill AB (ноябрь 1956 г.). «Рак легких и другие причины смерти в связи с курением; второй отчет о смертности британских врачей». Британский медицинский журнал. 2 (5001): 1071–81. Дои:10.1136 / bmj.2.5001.1071. ЧВК 2035864. PMID 13364389.
- ^ Министерство здравоохранения и социального обеспечения США (1964 г.). «Курение и здоровье: доклад консультативного комитета главному хирургу службы общественного здравоохранения» (PDF). Вашингтон, округ Колумбия: Типография правительства США. В архиве (PDF) из оригинала 17 декабря 2008 г.
- ^ а б Наголенники М (2000). Рак: эволюционное наследие. Издательство Оксфордского университета. стр.196–197. ISBN 978-0-19-262835-0.
- ^ Гринберг М., Селиков И. Дж. (Февраль 1993 г.). «Рак легкого в шахтах Шнеберг: переоценка данных, представленных Хартингом и Гессе в 1879 году». Анналы гигиены труда. 37 (1): 5–14. Дои:10.1093 / annhyg / 37.1.5. PMID 8460878.
- ^ Самет Дж. М. (апрель 2011 г.). «Радиация и риск рака: постоянная проблема для эпидемиологов». Состояние окружающей среды. 10 (Приложение 1): S4. Дои:10.1186 / 1476-069X-10-S1-S4. ЧВК 3073196. PMID 21489214.
- ^ Хорн Л., Джонсон Д.Х. (июль 2008 г.). «Эвартс А. Грэм и первая пневмонэктомия при раке легких». Журнал клинической онкологии. 26 (19): 3268–75. Дои:10.1200 / JCO.2008.16.8260. PMID 18591561.
- ^ Эдвардс А.Т. (март 1946 г.). «Карцинома бронха». Грудная клетка. 1 (1): 1–25. Дои:10.1136 / thx.1.1.1. ЧВК 1018207. PMID 20986395.
- ^ Кабела М (1956). «[Опыт радикального облучения рака бронхов]» [Опыт радикального облучения рака бронхов]. Ческословенская Онкология (на немецком). 3 (2): 109–15. PMID 13383622.
- ^ Сондерс М., Диш С., Барретт А., Харви А., Гибсон Д., Пармар М. (июль 1997 г.). «Непрерывная гиперфракционная ускоренная лучевая терапия (CHART) по сравнению с традиционной лучевой терапией при немелкоклеточном раке легкого: рандомизированное многоцентровое исследование. Руководящий комитет CHART». Ланцет. 350 (9072): 161–5. Дои:10.1016 / S0140-6736 (97) 06305-8. PMID 9250182. S2CID 6087156.
- ^ Lennox SC, Flavell G, Pollock DJ, Thompson VC, Wilkins JL (ноябрь 1968 г.). «Результаты резекции овсяноклеточного рака легкого». Ланцет. 2 (7575): 925–7. Дои:10.1016 / S0140-6736 (68) 91163-X. PMID 4176258.
- ^ Миллер А.Б., Фокс В., Высокий Р. (сентябрь 1969 г.). «Пятилетнее наблюдение за сравнительным исследованием хирургии и лучевой терапии для первичного лечения мелкоклеточного или овсяноклеточного рака бронхов, проведенного Советом по медицинским исследованиям». Ланцет. 2 (7619): 501–5. Дои:10.1016 / S0140-6736 (69) 90212-8. PMID 4184834.
- ^ Коэн MH, Creaven PJ, Fossieck BE, Broder LE, Selawry OS, Johnston AV и др. (1977). «Интенсивная химиотерапия мелкоклеточной бронхогенной карциномы». Отчеты о лечении рака. 61 (3): 349–54. PMID 194691.
- ^ а б c d Брамер-младший (февраль 2014 г.). «Блокада иммунных контрольных точек: надежда на иммунотерапию как лечение рака легких?». Семинары по онкологии. 41 (1): 126–32. Дои:10.1053 / j.seminoncol.2013.12.014. ЧВК 4732704. PMID 24565586.
- ^ а б c d е Syn NL, Teng MW, Mok TS, Soo RA (декабрь 2017 г.). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». Ланцет. Онкология. 18 (12): e731 – e741. Дои:10.1016 / с1470-2045 (17) 30607-1. PMID 29208439.
- ^ а б Форд П.М., Брамер-младший, Келли Р.Дж. (май 2014 г.). «Новые стратегии лечения рака легких: эпигенетическая терапия немелкоклеточного рака легких». Клинические исследования рака. 20 (9): 2244–8. Дои:10.1158 / 1078-0432.ccr-13-2088. ЧВК 4325981. PMID 24644000.
- ^ а б Джамал-Ханджани М., Хэкшоу А., Нгай Й., Шоу Дж., Нырок С, Кесада С. и др. (Июль 2014 г.). «Отслеживание эволюции геномного рака для точной медицины: исследование легких TRACERx». PLOS Биология. 12 (7): e1001906. Дои:10.1371 / journal.pbio.1001906. ЧВК 4086714. PMID 25003521.
- ^ Проект TRACERx, британский научный блог по исследованиям рака В архиве 29 ноября 2014 г. Wayback Machine
- ^ Спаанс Дж. Н., Госс Г. Д. (август 2014 г.). «Испытания по преодолению лекарственной устойчивости к таргетной терапии EGFR и ALK - прошлое, настоящее и будущее». Границы онкологии. 4 (233): 233. Дои:10.3389 / fonc.2014.00233. ЧВК 4145253. PMID 25221748.
- ^ Weart TC, Miller KD, Simone CB (апрель 2018 г.). «В центре внимания дабрафениб / траметиниб в лечении немелкоклеточного рака легких: место в терапии». Лечение рака и исследования. 10: 647–652. Дои:10.2147 / CMAR.S142269. ЧВК 5892608. PMID 29662327.
- ^ Хиви С., О'Бирн К.Дж., Гейтли К. (апрель 2014 г.). «Стратегии совместного нацеливания пути PI3K / AKT / mTOR в NSCLC». Отзывы о лечении рака. 40 (3): 445–56. Дои:10.1016 / j.ctrv.2013.08.006. PMID 24055012.
- ^ Прабавати Д., Сварналата Ю., Рамадосс Н. (март 2018 г.). «Стволовые клетки рака легкого - происхождение, характеристики и лечение». Исследование стволовых клеток. 5 (6): 6. Дои:10.21037 / sci.2018.02.01. ЧВК 5897668. PMID 29682513.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |










