Суперантиген - Superantigen


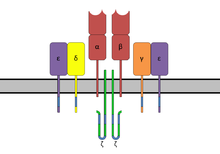
Суперантигены (SAgs) являются классом антигены которые приводят к чрезмерной активации иммунная система. В частности, это вызывает неспецифическую активацию Т-клетки в результате чего активация поликлональных Т-клеток и массивный цитокин релиз. САГ производятся некоторыми патогенный вирусы и бактерии, скорее всего, как защитный механизм против иммунной системы.[1] По сравнению с нормальным антиген -индуцированный Т-клеточный ответ, при котором активируется 0,0001-0,001% Т-клеток организма, эти SAg способны активировать до 20% Т-клеток организма.[2] Кроме того, Анти-CD3 и анти-CD28 антитела (CD28-SuperMAB ) также оказались очень мощными суперантигенами (и могут активировать до 100% Т-клеток).
Большое количество активированных Т-клеток порождает массивный иммунный ответ, который не специфичен для эпитоп на SAg, тем самым подрывая одну из основных сильных сторон адаптивная иммунная система, то есть его способность нацеливать антигены с высокой специфичностью. Что еще более важно, большое количество активированных Т-клеток секретируют большое количество цитокины, наиболее важным из которых является Интерферон гамма. Это избыточное количество IFN-гамма, в свою очередь, активирует макрофаги. Активированные макрофаги, в свою очередь, чрезмерно продуцируют провоспалительные цитокины, такие как Ил-1, Ил-6 и TNF-альфа. TNF-альфа особенно важен как часть воспалительной реакции организма. В нормальных условиях он высвобождается локально в небольших количествах и помогает иммунной системе победить патогены. Однако, когда он системно высвобождается в крови и в больших количествах (из-за массовой активации Т-клеток в результате связывания SAg), он может вызывать серьезные и опасные для жизни симптомы, в том числе шок и полиорганная недостаточность.
Структура
SAg продуцируются внутриклеточно бактериями и выделяются при инфекции в виде зрелых внеклеточных токсинов.[3]
Последовательности этих токсинов относительно консервативны среди различных подгрупп. Более важно, чем гомология последовательностей, трехмерная структура очень похожа среди различных SAg, что приводит к аналогичным функциональным эффектам среди разных групп.[4][5]
Кристаллические структуры энтеротоксинов показывает, что они компактны, эллипсоидальный белки разделяя характерную двух-домен шаблон складывания, содержащий β-цилиндр с NH2-концом шаровидный домен, известный как олигосахарид / олигонуклеотид сгиб, длинный α-спираль который по диагонали охватывает центр молекулы, и концевой глобулярный домен COOH.[4]
Домены имеют области связывания для главного комплекса гистосовместимости класса II (MHC класс II ) и Рецептор Т-клеток (TCR) соответственно.[6]
Привязка
Суперантигены сначала связываются с MHC класса II, а затем координируются с переменной альфа- или бета-цепочка рецепторов Т-клеток (TCR)[5][7][8]
MHC Класс II
SAgs отдают предпочтение HLA-DQ форма молекулы.[8] Связывание с α-цепью помещает SAg в соответствующее положение для координации с TCR.
Реже SAg прикрепляются к полиморфный MHC класс II β-цепь во взаимодействии, опосредованном координационным комплексом иона цинка между тремя остатками SAg и высококонсервативной областью HLA-DR β-цепь.[5] Использование иона цинка для связывания приводит к более высокому сродству взаимодействия.[4] Некоторые стафилококковые САГ способны к сшивание Молекулы MHC путем связывания как с α, так и с β цепями.[4][5] Этот механизм стимулирует цитокин экспрессия и высвобождение в антигенпрезентирующих клетках, а также индукция выработки костимулирующих молекул, которые позволяют клетке более эффективно связываться с Т-клетками и активировать их.[5]
Рецептор Т-клеток
Т-клеточная связывающая область SAg взаимодействует с вариабельной областью бета-цепи Т-клеточного рецептора. Данная SAg может активировать большую часть популяции Т-клеток, потому что репертуар Т-клеток человека включает только около 50 типов элементов Vβ, а некоторые SAg способны связываться с несколькими типами областей Vβ. Это взаимодействие незначительно варьируется среди разных групп SAg.[6] Вариабельность преобладающих типов Т-клеточных областей у разных людей объясняет, почему некоторые люди сильнее реагируют на определенные SAg. SAg группы I связываются с Vβ на CDR2 и каркасная область молекулы.[9][10] SAg группы II взаимодействуют с областью Vβ, используя механизмы, которые конформация -зависимый. Эти взаимодействия по большей части не зависят от конкретных боковых цепей аминокислоты Vβ. Было показано, что SAg группы IV задействуют все три петли CDR определенных форм Vβ.[9][10] Взаимодействие происходит в щели между малым и большим доменами SAg и позволяет SAg действовать как клин между TCR и MHC. Это вытесняет антигенный пептид от TCR и обходит нормальный механизм активации Т-клеток.[5][11]
Биологическая сила SAg (его способность стимулировать) определяется его близость для TCR. SAg с самым высоким сродством к TCR вызывают самый сильный ответ.[12] СПМЭЗ-2 - наиболее мощный из обнаруженных на сегодняшний день SAg.[12]
Передача сигналов Т-клеток
SAg связывает MHC и TCR, индуцируя сигнальный путь, который приводит к распространение клетки и выработка цитокинов. Это происходит потому, что родственный антиген активирует Т-клетку, а не из-за ее структуры. как таковой, но потому, что его сродство позволяет ему связывать TCR в течение достаточно длительного периода времени, а SAg имитирует эту временную связь. Низкий уровень Зап-70 были обнаружены в Т-клетках, активированных SAg, что указывает на нарушение нормального сигнального пути активации Т-клеток.[13]
Предполагается, что Fyn скорее, чем Lck активируется тирозинкиназа, что приводит к адаптивной индукции анергии.[14]
Как путь протеинкиназы С, так и пути протеинтирозинкиназы активируются, что приводит к усилению выработки провоспалительных цитокинов.[15]
Этот альтернативный сигнальный путь слегка нарушает пути кальций / кальциневрин и Ras / MAPkinase,[14] но позволяет получить целенаправленную воспалительную реакцию.
Прямые эффекты
Стимуляция SAg антигенпрезентирующих клеток и Т-клеток вызывает ответ, в основном воспалительный, сфокусированный на действии Th1 T-помощник клетки. Некоторые из основных продуктов Ил-1, Ил-2, Ил-6, TNF-α, гамма-интерферон (IFN-γ), воспалительный белок макрофагов 1α (MIP-1α), MIP-1β и моноцит хемоаттрактантный белок 1 (МКП-1 ).[15]
Это чрезмерное нескоординированное высвобождение цитокинов (особенно TNF-α) перегружает организм и приводит к высыпанию, лихорадке и может привести к полиорганной недостаточности, коме и смерти.[8][10]
Удаление или анергия активированных Т-клеток следует за инфекцией. Это результат производства Ил-4 и Ил-10 от длительного воздействия токсина. IL-4 и IL-10 подавляют выработку IFN-гамма, MHC Class II и костимулирующий молекулы на поверхности APC. Эти эффекты производят клетки памяти, которые не реагируют на стимуляцию антигеном.[16][17]
Один из механизмов, с помощью которого это возможно, включает опосредованное цитокинами подавление Т-клеток. Сшивание MHC также активирует сигнальный путь, который подавляет кроветворение и активирует Fas-опосредованную апоптоз.[18]
IFN-α - еще один продукт длительного воздействия SAg. Этот цитокин тесно связан с индукцией аутоиммунитета,[19] и аутоиммунное заболевание Болезнь Кавасаки как известно, вызывается инфекцией SAg.[12]
Активация SAg в Т-клетках приводит к выработке CD40 лиганд, который активирует переключение изотипа в В-клетках к IgG и IgM и IgE.[20]
Подводя итог, можно сказать, что Т-клетки стимулируются и производят избыточное количество цитокинов, что приводит к опосредованному цитокинами подавлению Т-клеток и удалению активированных клеток по мере того, как организм возвращается к гомеостазу. Токсическое действие микроба и SAg также повреждает ткани и системы органов, состояние, известное как синдром токсического шока.[20]
Если первоначальное воспаление сохраняется, клетки-хозяева становятся анергическими или удаляются, что приводит к серьезному нарушению иммунной системы.
Независимые от суперантигенности (косвенные) эффекты
Помимо своей митогенной активности, SAg способны вызывать симптомы, характерные для инфекции.[1]
Один из таких эффектов рвота. Этот эффект ощущается в случаях пищевое отравление, когда продуцирующие SAg бактерии выделяют токсин, обладающий высокой термостойкостью. Существует отдельная область молекулы, которая активно индуцирует желудочно-кишечный токсичность.[1] Эта деятельность также очень мощный и даже такие небольшие количества, как 20-35 мкг SAg, способны вызвать рвоту.[8]
САГ способны стимулировать набор нейтрофилы к месту инфекции способом, который не зависит от стимуляции Т-клеток. Этот эффект связан со способностью SAg активировать моноцитарный клетки, стимулирующие высвобождение цитокина TNF-α, что приводит к повышенной экспрессии молекул адгезии, которые привлекают лейкоциты в инфицированные области. Это вызывает воспаление в легких, кишечной ткани и в любом месте, где находятся бактерии. колонизированный.[21] Хотя небольшие воспаления естественны и полезны, чрезмерные воспаление может привести к разрушению тканей.
Один из наиболее опасных косвенных эффектов инфекции SAg касается способности SAg усиливать эффекты эндотоксины в организме. Это достигается за счет снижения порога эндотоксичности. Шливерт продемонстрировал, что при совместном применении эффекты SAg и эндотоксина усиливаются в 50 000 раз.[7] Это может быть связано со снижением эффективности иммунной системы, вызванным инфекцией SAg. Помимо синергетический взаимосвязь между эндотоксином и SAg, эффект «двойного удара» активности эндотоксина и SAg приводит к более опасным эффектам, чем те, которые наблюдаются при типичной бактериальной инфекции. Это также вовлекает САГ в прогрессирование сепсис у пациентов с бактериальными инфекциями.[20]
Заболевания, связанные с производством суперантигенов
- Сахарный диабет
- Экзема
- Каплевидный псориаз
- Болезнь Кавасаки
- Носовые полипы[22]
- Ревматическая лихорадка
- Ревматоидный артрит
- Скарлатина[8]
- Синдром токсического шока
- Инфекционный эндокардит [23]
Уход
Основными целями медицинского лечения являются гемодинамическая стабилизация пациента и, при его наличии, устранение микробов, продуцирующих SAg. Это достигается за счет использования вазопрессоры, жидкостная реанимация и антибиотики.[1]
Организм естественным образом производит антитела к некоторым САГ, и этот эффект можно усилить, стимулируя В-клетка производство этих антител.[24]
Иммуноглобулин пулы способны нейтрализовать специфические антитела и предотвратить активацию Т-клеток. Синтетические антитела и пептиды были созданы для имитации SAg-связывающих областей на MHC класса II, блокируя взаимодействие и предотвращая активацию Т-клеток.[1]
Иммунодепрессанты также используются для предотвращения активации Т-клеток и высвобождения цитокинов. Кортикостероиды используются для уменьшения воспалительных эффектов.[20]
Эволюция производства суперантигенов
Производство SAg эффективно разрушает иммунный ответ, позволяя микробу, секретирующему SAg, беспрепятственно переноситься и передаваться. Один из механизмов, с помощью которого это происходит, - это индукция анергии Т-клеток к антигенам и SAg.[13][16] Луссоу и Макдональд продемонстрировали это, систематически подвергая животных воздействию стрептококкового антигена. Они обнаружили, что воздействие других антигенов после заражения SAg не вызывает иммунного ответа.[16] В другом эксперименте Уотсон и Ли обнаружили, что Т-клетки памяти созданные в результате нормальной стимуляции антигеном, были анергичны стимуляции SAg, и что Т-клетки памяти, созданные после инфекции SAg, были анергичны ко всей стимуляции антигенами. Механизм, с помощью которого это произошло, не установлен.[13] Гены, которые регулируют экспрессию SAg, также регулируют механизмы уклонения от иммунитета, такие как М белок и Бактериальная капсула экспрессия, подтверждая гипотезу о том, что продукция SAg развивалась в первую очередь как механизм уклонения от иммунитета.[25]
Когда структуру отдельных SAg доменов сравнивали с другими иммуноглобулин-связывающими стрептококковыми белками (такими как токсины, продуцируемые Кишечная палочка ) было обнаружено, что домены по отдельности напоминают членов этих семейств. Этот гомология предполагает, что SAg эволюционировали в результате рекомбинации двух меньших мотивов β-цепи.[26]
Эндогенные САГ
Незначительные экзотоксины, стимулирующие лимфоциты (Mls), были первоначально обнаружены в тимус стромальные клетки мышей. Эти токсины кодируются генами SAg, которые были включены в геном мыши из вирус опухоли молочной железы мыши (ММТВ). Присутствие этих генов в геноме мыши позволяет мыши экспрессировать антиген в вилочковая железа как средство отрицательного отбора лимфоцитов с вариабельной бета-областью, чувствительной к стимуляции вирусным SAg. В результате эти мыши становятся невосприимчивыми к заражению вирусом в более позднем возрасте.[1]
Подобный эндогенный SAg-зависимый отбор еще предстоит идентифицировать в геноме человека, но были обнаружены эндогенные SAg, которые, как предполагается, играют неотъемлемую роль в вирусной инфекции. Заражение Вирус Эпштейна-Барра, например, известно, что он вызывает продуцирование SAg в инфицированных клетках, однако в геноме вируса не обнаружен ген токсина. Вирус манипулирует инфицированной клеткой, чтобы экспрессировать собственные гены SAg, и это помогает ей уклоняться от иммунной системы хозяина. Похожие результаты были получены с бешенство, цитомегаловирус, и ВИЧ.[1]
Рекомендации
- ^ а б c d е ж грамм Ллевелин М., Коэн Дж. (Март 2002 г.). «Суперантигены: микробные агенты, разрушающие иммунитет». Ланцет Инфекция Дис. 2 (3): 156–62. Дои:10.1016 / S1473-3099 (02) 00222-0. PMID 11944185.
- ^ Ли Х., Ллера А., Малчиоди Э.Л., Мариуцца Р.А. Структурная основа активации Т-клеток суперантигенами. Анну. Rev. Immunol. 1999; 17: 435–466. DOI: 10.1146 / annurev.immunol.17.1.435.
- ^ Срискандан С., Фолкнер Л., Хопкинс П. (2007). «Streptococcus pyogenes: понимание функции стрептококковых суперантигенов». Int. J. Biochem. Cell Biol. 39 (1): 12–9. Дои:10.1016 / j.biocel.2006.08.009. PMID 17029999.
- ^ а б c d Петерсон К., Форсберг Г., Уолс Б. (апрель 2004 г.). «Взаимодействие суперантигенов и иммунорецепторов». Сканд. J. Immunol. 59 (4): 345–55. Дои:10.1111 / j.0300-9475.2004.01404.x. PMID 15049778.
- ^ а б c d е ж Мехиндейт К., Тибодо Дж., Дольстен М., Калланд Т., Секали Р.П., Мурад В. (ноябрь 1995 г.). «Перекрестное сшивание молекул класса II главного комплекса гистосовместимости суперантигеном стафилококкового энтеротоксина А является необходимым условием для экспрессии гена воспалительных цитокинов». J. Exp. Med. 182 (5): 1573–7. Дои:10.1084 / jem.182.5.1573. ЧВК 2192187. PMID 7595227.
- ^ а б Папагеоргиу А.С., Трантер Х.С., Ачарья К.Р. (март 1998 г.). «Кристаллическая структура микробного суперантигена стафилококкового энтеротоксина B при разрешении 1,5 A: значение для распознавания суперантигена молекулами MHC класса II и рецепторами Т-клеток». J. Mol. Биол. 277 (1): 61–79. Дои:10.1006 / jmbi.1997.1577. PMID 9514739.
- ^ а б Шливерт PM (апрель 1982 г.). «Повышение восприимчивости хозяина к летальному эндотоксиновому шоку за счет стафилококкового пирогенного экзотоксина типа С». Заразить. Иммунная. 36 (1): 123–8. Дои:10.1128 / IAI.36.1.123-128.1982. ЧВК 351193. PMID 7042568.
- ^ а б c d е Алуф Дж. Э., Мюллер-Алуф Х (февраль 2003 г.). «Стафилококковые и стрептококковые суперантигены: молекулярные, биологические и клинические аспекты». Int. J. Med. Микробиол. 292 (7–8): 429–40. Дои:10.1078/1438-4221-00232. PMID 12635926.
- ^ а б Бруйяр Дж. Н., Гюнтер С., Варма А. К. и др. (Апрель 2007 г.). «Кристаллическая структура стрептококкового суперантигена SpeI и функциональная роль нового петлевого домена в активации Т-клеток суперантигенами группы V». J. Mol. Биол. 367 (4): 925–34. Дои:10.1016 / j.jmb.2007.01.024. PMID 17303163.
- ^ а б c Буонпане Р.А., Моза Б., Сундберг Э.Дж., Кранц Д.М. (октябрь 2005 г.). «Характеристика рецепторов Т-клеток, разработанных для обеспечения высокого сродства против токсина-1 синдрома токсического шока». J. Mol. Биол. 353 (2): 308–21. Дои:10.1016 / j.jmb.2005.08.041. PMID 16171815.
- ^ Ли Х., Ллера А., Цучия Д. и др. (Декабрь 1998 г.). «Трехмерная структура комплекса между бета-цепью Т-клеточного рецептора и суперантигенным стафилококковым энтеротоксином B». Иммунитет. 9 (6): 807–16. Дои:10.1016 / S1074-7613 (00) 80646-9. PMID 9881971.
- ^ а б c Arcus VL, Proft T, Sigrell JA, Baker HM, Fraser JD, Baker EN (май 2000 г.). «Сохранение и вариация суперантигенной структуры и активности, выявленные трехмерными структурами двух новых суперантигенов из Streptococcus pyogenes». J. Mol. Биол. 299 (1): 157–68. Дои:10.1006 / jmbi.2000.3725. PMID 10860729.
- ^ а б c Уотсон А.Р., Ли В.Т. (август 2006 г.). «Дефектная Т-клеточная рецептор-опосредованная передача сигнала в Т-лимфоцитах CD4 памяти, подвергшихся действию суперантигена или антител против Т-клеточного рецептора». Клетка. Иммунол. 242 (2): 80–90. Дои:10.1016 / j.cellimm.2006.09.008. ЧВК 1829409. PMID 17083922.
- ^ а б Чой С., Шварц Р.Х. (июнь 2007 г.). «Молекулярные механизмы адаптивной толерантности и другие модели анергии Т-клеток». Семин. Иммунол. 19 (3): 140–52. Дои:10.1016 / j.smim.2007.02.005. ЧВК 2045643. PMID 17400472.
- ^ а б Стайлз Б.Г., Кракауэр (2005). «Стафилококковые энтеротоксины: обзор опыта очистки, часть I». Информационный бюллетень по клинической микробиологии. 27 (23): 23. Дои:10.1016 / j.clinmicnews.2005.11.001.
- ^ а б c Луссов А.Р., Макдональд HR (февраль 1994 г.). «Дифференциальные эффекты индуцированной суперантигеном« анергии »на прайминговую и эффекторную стадии зависимого от Т-клеток ответа антител». Евро. J. Immunol. 24 (2): 445–9. Дои:10.1002 / eji.1830240227. PMID 8299694.
- ^ Миллер С., Рагхеб Дж. А., Шварц Р. Х. (июль 1999 г.). «Анергия и подавление, опосредованное цитокинами, как отдельные механизмы толерантности, индуцированной суперантигеном, in vivo». J. Exp. Med. 190 (1): 53–64. Дои:10.1084 / jem.190.1.53. ЧВК 2195559. PMID 10429670.
- ^ Ямагути М., Надлер С., Ли Дж. У., Диг Х. Дж. (Сентябрь 1999 г.). «Индукция негативных регуляторов гемопоэза в клетках костного мозга человека путем перекрестного связывания HLA-DR». Транспл. Иммунол. 7 (3): 159–68. Дои:10.1016 / S0966-3274 (99) 80035-5. PMID 10608299.
- ^ Stauffer Y, Marguerat S, Meylan F, et al. (Октябрь 2001 г.). «Интерферон-альфа-индуцированный эндогенный суперантиген. Модель, связывающая среду и аутоиммунитет». Иммунитет. 15 (4): 591–601. Дои:10.1016 / S1074-7613 (01) 00212-6. PMID 11672541.
- ^ а б c d Джабара Х. Х., Геха Р. С. (октябрь 1996 г.). «Токсин-1 синдрома токсического шока суперантигена индуцирует экспрессию лиганда CD40 и модулирует переключение изотипа IgE». Int. Иммунол. 8 (10): 1503–10. Дои:10.1093 / intimm / 8.10.1503. PMID 8921429.
- ^ Динер К., Тессье П., Фрейзер Дж., Кентген Ф., Макколл С.Р. (июнь 1998 г.). «Вызвание острого воспаления in vivo с помощью стафилококковых суперантигенов I: рекрутирование лейкоцитов происходит независимо от Т-лимфоцитов и молекул класса II главного комплекса гистосовместимости». Лаборатория. Вкладывать деньги. 78 (6): 647–56. PMID 9645755.
- ^ Ван Каувенберге П., Геваерт П., Ван Хокке Х., Ван Зеле Т., Бахерт С. (2005). «Новые взгляды на патологию полипоза носа: роль суперантигенов и IgE». Verh K Acad Geneeskd Belg. 67 (5–28): 5–28, обсуждение 29–32. PMID 15828304.
- ^ Салгадо-Пабон В. и др. (2013) Суперантигены имеют решающее значение при инфекционном эндокардите, сепсисе и остром повреждении почек, вызванном Staphylococcus aureus. MBio 4: e00494-00413.
- ^ Эрландссон Э., Андерссон К., Каваллин А., Нильссон А. и др. (2003). «Идентификация антигенных эпитопов в стафилококковых энтеротоксинах A и E и разработка суперантигена для терапии рака человека». J. Mol. Биол. 333 (5): 893–905. Дои:10.1016 / j.jmb.2003.09.009. PMID 14583188.
- ^ Клири П.П., Маклендсборо Л., Икеда Л., Кью Д., Кравчак Дж., Лам Х (апрель 1998 г.). «Высокочастотная внутриклеточная инфекция и экспрессия эритрогенного токсина А претерпевают фазовые изменения в стрептококках группы А M1». Мол. Микробиол. 28 (1): 157–67. Дои:10.1046 / j.1365-2958.1998.00786.x. PMID 9593304.
- ^ Bachert C, Gevaert P, van Cauwenberge P (июнь 2002 г.). "Золотистый стафилококк энтеротоксины: ключ к заболеванию дыхательных путей? ». Аллергия. 57 (6): 480–7. Дои:10.1034 / j.1398-9995.2002.02156.x. PMID 12028112.
Rasooly, R., Do, P. и Hernlem, B. (2011) Самопрезентация стафилококкового энтеротоксина A CD4 + T-клетками мыши. Открытый журнал иммунологии, 1, 8-14.
дальнейшее чтение
- Суперантиген веб-база данных в Биркбек, Лондонский университет
- Список суперантигенных белков из UniProt
- Суперантигены в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
внешняя ссылка
 СМИ, связанные с Суперантигены в Wikimedia Commons
СМИ, связанные с Суперантигены в Wikimedia Commons

