Змеиный яд - Snake venom
 Vipera berus - Аппарат для доставки яда | |||||||||
| Идентификаторы | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Символ | Toxin_TOLIP | ||||||||
| Pfam | PF00087 | ||||||||
| ИнтерПро | IPR003571 | ||||||||
| PROSITE | PDOC00245 | ||||||||
| SCOP2 | 2ctx / Объем / СУПФАМ | ||||||||
| OPM суперсемейство | 53 | ||||||||
| Белок OPM | 1txa | ||||||||
| |||||||||
Змеиный яд сильно модифицированный слюна[1] содержащий зоотоксины которые способствуют иммобилизации и перевариванию добыча, и защита от угроз. Вводится уникальным клыки во время кусать, и некоторые виды также могут плевать своим ядом.[2]
Железы, выделяющие зоотоксины, являются модификацией околоушные слюнные железы найдено в других позвоночные, и обычно располагаются по обе стороны головы, ниже и позади глаза и заключены в мышечную оболочку. Железы имеют большие альвеолы в котором синтезированы яд хранится перед транспортировкой по каналу к основанию канальных или трубчатых клыков, через которые он выбрасывается.[3][4]
Яды содержат более 20 различных соединений, в основном белки и полипептиды.[3] Сложная смесь белков, ферментов и различных других веществ с токсическими и смертельными свойствами.[2] служит для обездвиживания животного-жертвы,[5] ферменты играют важную роль в переваривании добычи,[4] и различные другие вещества ответственны за важные, но несмертельные биологические эффекты.[2] Некоторые белки змеиного яда обладают очень специфическим действием на различные биологические функции, включая свертывание крови, регуляцию артериального давления и передачу нервных или мышечных импульсов, и были разработаны для использования в качестве фармакологических или диагностических инструментов и даже полезных лекарств.[2]
Химия
Шарль Люсьен Бонапарт, сын Люсьен Бонапарт, младший брат Наполеон Бонапарт, был первым, кто установил белковую природу змеиного яда в 1843 году.[нужна цитата ]
Белки составляют 90-95% от сухого веса яда и ответственны почти за все его биологические эффекты. Среди сотен, даже тысяч белков, содержащихся в яде, есть токсины, нейротоксины в частности, а также нетоксичные белки (которые также обладают фармакологическими свойствами) и многие ферменты, особенно гидролитические.[2] Ферменты (молекулярный вес 13-150 кДа) составляют 80-90% виперидов и 25-70% ядов элапидов, включая пищеварительные гидролазы, оксидазу L-аминокислот, фосфолипазы, тромбиноподобный прокоагулянт и калликреин-подобные сериновые протеазы и металлопротеиназы (геморрагины), повреждающие эндотелий сосудов. Полипептид токсины (молекулярная масса 5-10 кДа) включают цитотоксины, кардиотоксины, и постсинаптические нейротоксины (такие как α-бунгаротоксин и α-кобратоксин ), которые связаны с рецепторы ацетилхолина в нервно-мышечных соединениях. Соединения с низкой молекулярной массой (до 1,5 кДа) включают металлы, пептиды, липиды, нуклеозиды, углеводы, амины и олигопептиды, которые ингибируют ангиотензин-превращающий фермент (АПФ) и усиливают брадикинин (ВРР). Межвидовая и внутривидовая изменчивость химического состава яда носит географический и онтогенный характер.[3] Фосфодиэстеразы вмешиваться в сердечную систему жертвы, в основном, чтобы снизить артериальное давление. Фосфолипаза А2 причины гемолиз лизируя фосфолипид клеточные мембраны из красные кровяные тельца.[6] Аминокислота оксидазы и протеазы используются для пищеварения. Аминокислотная оксидаза также запускает некоторые другие ферменты и отвечает за желтый цвет яда некоторых видов. Гиалуронидаза увеличивает проницаемость тканей, чтобы ускорить всасывание других ферментов тканями. Некоторые змеиные яды несут фасцикулины, словно мамбы (Дендроаспис), которые подавляют холинэстераза чтобы жертва потеряла контроль над мышцами.[7]
| Тип | Имя | Источник |
|---|---|---|
| Оксидоредуктазы | лактат дегидрогеназы | Elapidae |
| L-аминокислотная оксидаза | Все виды | |
| Каталаза | Все виды | |
| Трансферазы | Аланин-аминотрансфераза | |
| Гидролазы | Фосфолипаза А2 | Все виды |
| Лизофосфолипаза | Elapidae, Viperidae | |
| Ацетилхолинэстераза | Elapidae | |
| Щелочная фосфатаза | Ботропс атрокс | |
| Кислая фосфатаза | Deinagkistrodon acutus | |
| 5'-нуклеотидаза | Все виды | |
| Фосфодиэстераза | Все виды | |
| Дезоксирибонуклеаза | Все виды | |
| Рибонуклеаза 1 | Все виды | |
| Аденозинтрифосфатаза | Все виды | |
| Амилаза | Все виды | |
| Гиалуронидаза | Все виды | |
| НАД-нуклеотидаза | Все виды | |
| Кининогеназа | Гадюки | |
| Активатор фактора-X | Змеиные, Crotalinae | |
| Гепариназа | Crotalinae | |
| α-фибриногеназа | Гадюки, Кроталины | |
| β-фибриногеназа | Гадюки, Кроталины | |
| α-β-фибриногеназа | Bitis gabonica | |
| Фибринолитический фермент | Crotalinae | |
| Активатор протромбина | Crotalinae | |
| Коллагеназа | Гадюки | |
| Эластаза | Гадюки | |
| Лиасы | Глюкозамин-аммоний-лиаза |
Змеиные токсины сильно различаются по своим функциям. Два широких класса токсинов, содержащихся в змеином яде: нейротоксины (в основном встречается у elapids) и гемотоксины (в основном встречается у гадюк). Однако бывают исключения - яд черная кобра (Naja nigricollis), elapid, состоит в основном из цитотоксины, в то время как Гремучая змея Мохаве (Crotalus scutulatus), гадюка, в первую очередь нейротоксична. И элапиды, и гадюки могут переносить множество других типов токсинов.
| α-нейротоксины | α-бунгаротоксин, α-токсин, эрабутоксин, кобратоксин |
|---|---|
| β-нейротоксины (PLA2 ) | β-бунгаротоксин, Нотексин, аммодитоксин, кротоксин, тайпоксин |
| κ-нейротоксины | Каппа-бунгаротоксин |
| Дендротоксины (Куниц ) | Дендротоксин, токсины I и K; возможно, цепь B β-бунгаротоксина |
| Кардиотоксины | Naja nigricollis у-токсин, кардиотоксин III (также известный как цитотоксины) |
| Миотоксины | Миотоксин -а, кротамин |
| Сарафотоксины | Сарафотоксины а, б и в |
| Геморрагины (металлопротеиназа) | Мукролизин, Атролизины, Акутолизины, так далее.[8] |
| Гемотоксины (сериновая протеаза) | Веномбин А |
Токсины
Нейротоксины
| Структура типового химический синапс |
|---|
Начало нового нервного импульса выглядит следующим образом:
- Обмен ионами (заряженными атомами) через мембрану нервной клетки посылает деполяризующий ток к концу нервной клетки (окончанию клетки).
- Когда деполяризующий ток достигает конца нервной клетки, нейромедиатор ацетилхолин (ACh), который содержится в пузырьках, высвобождается в пространство между двумя нервами (синапс). Он перемещается по синапсу к постсинаптическим рецепторам.
- ACh связывается с рецепторами и передает сигнал клетке-мишени, и через короткое время он разрушается ацетилхолинэстеразой.
- Фасцикулины
- Эти токсины атакуют холинергические нейроны (те, которые используют ACh в качестве медиатора), разрушая ацетилхолинэстеразу (AChE). Следовательно, ACh не может расщепляться и остается в рецепторе. Это вызывает тетанию (непроизвольное сокращение мышц), что может привести к смерти. Токсины были названы фасцикулинами, так как после инъекции в мышей, они вызывают тяжелые, генерализованные и продолжительные (5-7 ч) фасцикуляции (быстрые мышечные сокращения).
- Пример змеи: встречается в основном в яде мамбы (Дендроаспис spp.) и некоторые гремучие змеи (Crotalus виды)
- Дендротоксины
- Дендротоксины подавляют нейротрансмиссию, блокируя обмен положительными и отрицательными ионами через мембрану нейронов, что приводит к отсутствию нервного импульса, тем самым парализуя нервы.
- Пример змеи: мамбы
- α-нейротоксины
- Альфа-нейротоксины представляют собой большую группу, в которой идентифицировано и секвенировано более 100 постсинаптических нейротоксинов.[9] α-нейротоксины атакуют Никотиновые рецепторы ацетилхолина холинергических нейронов. Они имитируют форму молекулы ацетилхолина, поэтому вписываются в рецепторы → они блокируют ток ACh → чувство онемения и паралича.
- Примеры змей: Королевская кобра (Офиофаг ханна) (известный как ханнахтоксин, содержащий α-нейротоксины),[10] морские змеи (Hydrophiinae) (известный как эрабутоксин), многополосный крайт (Bungarus multicinctus) (известный как α-бунгаротоксин ), и кобры (Naja spp.) (известный как кобратоксин )
Цитотоксины
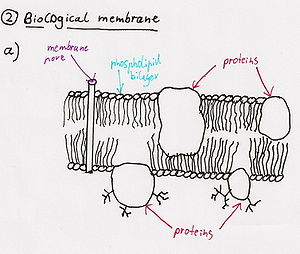

- Фосфолипазы
- Фосфолипаза представляет собой фермент, который превращает молекулу фосфолипида в лизофосфолипид (мыло) → новая молекула притягивает и связывает жир и разрывает клеточные мембраны. Фосфолипаза А2 это один из специфических типов фосфолипаз, содержащихся в змеином яде.
- Пример змеи: Окинавский хабу (Trimeresurus flavoviridis)
- Кардиотоксины / цитотоксины
- Кардиотоксины компоненты, которые особенно токсичны для сердца. Они связываются с определенными участками на поверхности мышечных клеток и вызывают деполяризацию → токсин предотвращает сокращение мышц. Эти токсины могут вызвать нерегулярное сердцебиение или остановку биения, что приведет к смерти. Примером может служить трехпалый кардиотоксин III от кобры, пример семейства коротких трехпалых (ИнтерПро: IPR003572 ).
- Пример змеи: мамбы, и немного Naja разновидность
- Гемотоксины
- Гемотоксины вызывают гемолиз, разрушение эритроцитов (эритроцитов) или вызывают свертывание крови (свертывание, например мукроцетин ). Обычное семейство гемотоксинов включает металлопротеиназы змеиного яда, такие как мукролизин.[8][11]
- Примеры змей: большинство гадюки и много кобра виды: тропическая гремучая змея Crotalus durissus производит конвульксин, коагулянт.[12]
Определение токсичности яда (LD50)
Токсичность змеиного яда оценивается с помощью токсикологического теста, называемого средняя летальная доза, LD50, (сокращение от «смертельная доза, 50%»), которая определяет концентрацию токсина, необходимую для уничтожения половины членов исследуемой популяции животных. Сила яда диких змей значительно различается даже в пределах одного вида из-за различных факторов, таких как биофизическая среда, физиологический статус, экологические переменные, генетическая изменчивость (либо адаптивный или случайные), а также различные другие молекулярные и экологические эволюционные факторы. Такая вариация обязательно меньше у содержащихся в неволе популяций в контролируемых лабораторных условиях, хотя полностью исключить ее нельзя. Однако исследования по определению летальности или эффективности змеиного яда должны быть спланированы таким образом, чтобы свести к минимуму вариабельность, поэтому для этого было разработано несколько методов. Один из подходов, который считается особенно полезным, - это использование 0,1% бычьего сывороточного альбумина (также известного как «фракция V» в Кон процесс ) в качестве разбавителя при определении LD50 значения для различных видов. Это приводит к гораздо более точному и последовательному LD50 определений, чем, например, с использованием 0,1% физиологического раствора в качестве разбавителя. Фракция V дает около 95% очищенного альбумина, который представляет собой высушенный сырой яд. Физиологический раствор в качестве разбавителя постоянно дает широко варьирующуюся LD.50 результаты почти для всех ядовитых змей; это приводит к непредсказуемым изменениям чистоты осадка (от 35 до 60%).[13] Фракция V структурно стабильна, поскольку имеет семнадцать дисульфидные связи; он уникален тем, что имеет самую высокую растворимость и самую низкую изоэлектрическая точка всех основных белков плазмы. Это делает его последней фракцией, которая осаждается из раствора. Бычий сывороточный альбумин находится во фракции V. Осаждение альбумина осуществляется снижением pH до 4,8, что близко к pI белков, и поддержанием концентрации этанола на уровне 40% при концентрации белка 1%. Таким образом, в пятой фракции остается только 1% исходной плазмы.[14] Когда конечной целью плазменной обработки является очищенный плазменный компонент для инъекция или же переливание, плазменная составляющая должна быть высокочистой. Первый практический крупномасштабный метод фракционирования плазмы крови был разработан Эдвин Дж. Кон в течение Вторая Мировая Война. Он известен как Кон процесс (или метод Кона). Этот процесс также известен как фракционирование холодного этанола, поскольку он включает постепенное увеличение концентрация из этиловый спирт в решение при 5 ° C и 3 ° C.[15] Процесс Кона использует различия в свойствах различных белков плазмы, в частности, высокий растворимость и низкий число Пи альбумина. По мере постепенного увеличения концентрации этанола от 0 до 40% [pH] понижается с нейтрального (pH ~ 7) до примерно 4,8, что близко к pI альбумина.[15] На каждом этапе определенные белки осажден раствора и удалили. Финал осадок очищенный альбумин. Существует несколько вариаций этого процесса, в том числе адаптированный метод Ничманна и Кистлера, который использует меньше шагов и заменяет центрифугирование и замораживание больших объемов фильтрация и диафильтрация.[15][16] Некоторые новые методы очистки альбумина добавляют дополнительные стадии очистки к процессу Кона и его разновидностям. Хроматографическая обработка альбумина как альтернатива процессу Кона возникла в начале 1980-х годов, однако она не получила широкого распространения до более позднего времени из-за недостаточной доступности крупномасштабного хроматографического оборудования. Методы, включающие хроматографию, обычно начинаются с крио-обедненной плазмы, подвергающейся замене буфера посредством диафильтрации или хроматографии с обменным буфером, чтобы подготовить плазму для следующих ионообменная хроматография шаги. После ионного обмена обычно проводятся дополнительные стадии хроматографической очистки и замены буфера.[15]
Однако хроматографические методы разделения начали применяться в начале 1980-х годов. Разработки продолжались в то время, когда фракционирование по Кону начало использоваться в 1946 году, и когда хроматография начал использоваться в 1983 году. В 1962 году был создан процесс Кистлера и Нистчмана, который был побочным продуктом процесса Кона. Хроматографические процессы начали формироваться в 1983 году. В 1990-х годах были созданы процессы Zenalb и CSL Albumex, которые включали хроматографию с несколькими вариациями. Общий подход к использованию хроматографии для фракционирования плазмы на альбумин: извлечение супернатанта I, делипидация, анионообменная хроматография, катионообменная хроматография и гель-фильтрационная хроматография. Восстановленный очищенный материал состоит из комбинаций октаноата натрия и N-ацетилтриптофаната натрия, а затем подвергается процедурам вирусной инактивации, включая пастеризацию при 60 ° C. Это более эффективная альтернатива, чем процесс Кона, по четырем основным причинам: 1) требовалась плавная автоматизация и относительно недорогой завод, 2) легче стерилизовать оборудование и поддерживать хорошие производственные условия, 3) хроматографические процессы менее повреждают альбумин. белок, и 4) может быть достигнут более успешный конечный результат по альбумину. По сравнению с процессом Кона чистота альбумина повысилась с 95% до 98% при использовании хроматографии, а выход увеличился с 65% до 85%. Небольшое процентное увеличение имеет значение в отношении чувствительных измерений, таких как чистота. Один большой недостаток использования хроматографии связан с экономичностью процесса. Хотя метод был эффективен с точки зрения обработки, приобретение необходимого оборудования - сложная задача. Необходима крупная техника, и долгое время отсутствие оборудования не способствовало его широкому использованию. Компоненты стали более доступными, но работа еще не завершена.
Эволюция
Веном развился только однажды среди всех Токсикофера около 170 миллионов лет назад, а затем превратились в огромное разнообразие ядов, наблюдаемое сегодня.[17] Исходный яд токсикоферана представлял собой очень простой набор белков, собранных в паре желез. Впоследствии этот набор белков независимо эволюционировал в различных линиях токсикоферанов, включая Змеи, Anguimorpha, и Игуания.[18] Некоторые змеиные линии с тех пор потеряли способность производить яд, часто из-за изменения диеты или изменения тактики хищников.[17] Считается, что эволюция яда ответственна за огромное распространение змей по всему миру.[17][19]
Механизм эволюции в большинстве случаев был дупликация гена в тканях, не связанных с ядом, с последующей экспрессией нового белка в ядовитой железе.[18] Затем последовали естественный отбор за адаптивные черты следуя модели рождения и смерти, где за дупликацией следует функциональная диверсификация, приводящая к созданию структурно родственных белков, которые имеют несколько разные функции.[17][18][20] Изучение эволюции яда было приоритетом для ученых с точки зрения научных исследований из-за медицинской значимости змеиного яда с точки зрения проведения исследований противоядия и рака. Очень полезно знать больше о составе яда и способах его развития. На эволюцию яда влияют три основных фактора, которые были тщательно изучены: хищники змеи, устойчивые к змеиному яду, жертвы, которые находятся в эволюционной гонке вооружений со змеями, и особые диеты, которые влияют на внутривидовую эволюцию яда. Яды продолжают развиваться как специфические токсины и модифицируются, чтобы нацеливаться на конкретную жертву, и обнаружено, что токсины варьируются в зависимости от диеты у некоторых видов.[21][22]
Быстрое развитие яда также можно объяснить гонкой вооружений между молекулами, нацеленными на яд, у устойчивых хищников, таких как опоссум, и змеиный яд, нацеленный на молекулы. Ученые провели эксперименты с опоссумами и обнаружили, что многочисленные испытания показали замену молчаливых замен в факторе фон Виллебранда (vWf) ген, кодирующий нацеленный на яд гемостатический белок крови. Считается, что эти замены ослабляют связь между vWf и лигандом токсичного змеиного яда (ботроцетином), что изменяет общий заряд и гидрофобность. Эти результаты важны для эволюции яда, потому что это первое упоминание о быстрой эволюции молекулы, нацеленной на яд. Это показывает, что эволюционная гонка вооружений может происходить в оборонительных целях. Альтернативные гипотезы предполагают, что эволюция яда происходит из-за трофической адаптации, тогда как эти ученые полагают, что в этом случае отбор будет происходить по признакам, которые помогают выжить жертве с точки зрения эволюции яда, а не успеха хищничества. Несколько других хищников ямочной гадюки (мангусты и ежи) демонстрируют такие же отношения между змеями, что помогает подтвердить гипотезу о том, что яд играет очень сильную защитную роль наряду с трофической ролью. Что, в свою очередь, поддерживает идею о том, что хищничество змей может быть гонкой вооружений, которая приводит к эволюции змеиного яда.[23]
Некоторые из различных адаптаций, производимых этим процессом, включают яд, более токсичный для конкретной жертвы в нескольких линиях происхождения,[22][24][25] белки, которые предварительно переваривают добычу,[26] а также способ выследить добычу после укуса.[27] Наличие пищеварительные ферменты в змеином яде когда-то считалось приспособлением, способствующим пищеварению. Однако исследования западная гремучая змея (Crotalus atrox), змея с высокой протеолитический яд, покажите, что яд не влияет на время, необходимое для прохождения пищи через кишка.[28] Эти различные адаптации яда также привели к серьезным спорам по поводу определения яда и ядовитых змей.[17]
Инъекция
Змеи
в гадюки, которые имеют наиболее развитый аппарат доставки яда, ядовитая железа очень большая и окружена жеребец или же височная мышца, который состоит из двух полос: верхняя идет из-за глаза, а нижняя - от железы до нижней челюсти. Проток переносит яд от железы к клыку. У гадюк и элапид эта борозда полностью закрыта, образуя игольчатую трубку для подкожных инъекций. У других видов бороздки не закрыты или закрыты частично. От переднего конца железы проток проходит ниже глаза и выше верхнечелюстная кость, к базальному отверстию ядовитого клыка, заключенного в толстую складку слизистая оболочка. С помощью подвижной верхнечелюстной кости, шарнирно соединенной с префронтальной костью и соединенной с поперечной костью, которая продвигается вперед мышцами, приводимыми в действие открытием рта, клык поднимается, и яд выходит через дистальное отверстие. Когда змея кусает, челюсти смыкаются, а мышцы, окружающие железу, сокращаются, в результате чего яд выходит через клыки.
Elapids
в протероглифный elapids, клыки трубчатые, но короткие и не обладают подвижностью, характерной для гадюк.
Colubrids
Опистоглифный Colubrids имеют увеличенные зубцы с бороздками, расположенные на задней конечности верхняя челюсть, где небольшая задняя часть верхней губной или слюнной железы выделяет яд.
Механика укуса

Несколько родов, в том числе Азиатские коралловые змеи (Каллиофис), роющий жерех (Атрактаспис), и ночные сумматоры (Причина), примечательны тем, что имеют исключительно длинные ядовитые железы, простирающиеся вдоль каждой стороны тела, в некоторых случаях простирающиеся назад до сердца. Вместо мышц височной области, служащих для выталкивания яда в проток, это действие выполняется мышцами боковой части тела.
Среди змей наблюдается значительная изменчивость поведения при укусе. При укусе змеи-гадюки часто нападают быстро, выделяя яд, когда клыки проникают в кожу, а затем сразу же выпускают. В качестве альтернативы, как и в случае реакции на кормление, некоторые гадюки (например, Lachesis) кусай и держи. А протероглиф или же опистоглиф может сомкнуть челюсти и в течение значительного времени твердо кусать или жевать.
Различия в длине клыков у разных ядовитых змей, вероятно, связаны с эволюцией различных стратегий нанесения ударов.[29]
Механика плевка
Плюющиеся кобры родов Naja и Гемахат при раздражении или угрозе может выбрасывать потоки или брызги яда на расстояние от 4 до 8 футов. Клыки этих змей были модифицированы для того, чтобы плеваться; внутри клыков канал изгибается на 90 ° к нижней передней части клыка. Плевальщики могут несколько раз плюнуть и все же укусить их со смертельным исходом.
Плевание - это только защитная реакция. Змеи стремятся попасть в глаза предполагаемой угрозе. Прямое попадание может вызвать временный шок и слепоту из-за тяжелого воспаление из роговица и конъюнктива. Хотя обычно серьезные симптомы не возникают, если яд немедленно смывается большим количеством воды, слепота может стать постоянной, если ее не лечить. Кратковременный контакт с кожей не представляет непосредственной опасности, но открытые раны могут быть переносчиками отравления.
Физиологические эффекты
Четыре различных типа яда действуют на организм по-разному:
- Протеолитический яд разрушает молекулярное окружение, включая укус.
- Гемотоксичный яд действуют на сердце и сердечно-сосудистую систему.
- Нейротоксичный яд действует на нервную систему и мозг.
- Цитотоксический яд оказывает локализованное действие на место укуса.
Протероглифные змеи
Эффект яда протероглифный змеи (морские змеи, крайтс, мамбы, черные змеи, тигровые змеи, и гадюки смерти ) в основном на нервная система, респираторный паралич быстро вырабатывается при контакте яда с центральным нервным механизмом, контролирующим дыхание; боль и местный отек, возникающие после укуса, обычно не сильны. Укус всех протероглифных элапидов, даже самых маленьких и нежных, таких как коралловые змеи, насколько известно, смертельно опасен для человека. Тем не менее, некоторые умеренно ядовитые elapids остаются, например, змеи с капюшонами (Парасута ), хоккей с мячом (Вермицелла ), так далее.
Змеи
Яд гадюки (Гадюка Рассела, чешуйчатые гадюки, бушмастеры, и гремучие змеи ) больше действует на сосудистую систему, вызывая свертывание крови и свертывание легочных артерий; его действие на нервную систему невелико, ни одна отдельная группа нервные клетки кажется выделенным, и влияние на дыхание не такое прямое; влияние на кровообращение объясняет большую депрессию, которая является симптомом отравления гадюкой. Боль в ране сильная, быстро сменяющаяся отеком и изменением цвета. Мартин и Лэмб так описали симптомы, вызываемые укусом европейской гадюки:[30]
Укус немедленно сопровождается местной болью жгучего характера; конечность вскоре отекает и обесцвечивается, и в течение одного-трех часов сильная прострация, сопровождающаяся рвота, и часто понос Обычно наступает холодный липкий пот. Пульс становится очень слабым и слабым. одышка и может быть видно беспокойство. В тяжелых случаях, которые чаще встречаются у детей, пульс может стать незаметным, а конечности холодными; пациент может перейти в кома. Обычно эти тяжелые конституциональные симптомы проходят от двенадцати до двадцати четырех часов; но тем временем опухоль и изменение цвета сильно распространились. Конечность становится флегмоничной и иногда нагнаивается. В течение нескольких дней выздоровление обычно происходит внезапно, но смерть может возникнуть в результате тяжелой депрессии или побочных эффектов нагноение. О том, что случаи смерти как взрослых, так и детей, нередки в некоторых частях континента, упоминается в последней главе этого Введения.
Гадюки сильно различаются между собой по токсичности своих ядов. Некоторые, например гадюка Рассела индийская (Дабоя Расселли) и чешуйчатая гадюка (E. carinatus); американские гремучие змеи (Crotalus spp.), кустарники (Lachesis spp.), и копья (Ботропс виды); и Африканские гадюки (Укус виды), ночные сумматоры (Причина spp.), и рогатая гадюка (Cerastes spp.), могут привести к летальному исходу, если не применить лекарство быстро. Укус более крупных европейских гадюк может быть очень опасным и приводить к летальному исходу, особенно у детей, по крайней мере в более жарких частях континента; пока маленький луговая гадюка (Гадюка обыкновенная), который почти никогда не кусает, если с ним не обращаться грубо, не похоже, что он обладает очень сильным ядом, и хотя очень часто встречается в некоторых частях Австрия и Венгрия, не известно, когда-либо приводил к серьезным авариям.
Опистоглифные колубриды
Биологи давно знали, что у некоторых змей есть задние клыки, «низшие» механизмы инъекции яда, которые могут обездвижить добычу; хотя было зарегистрировано несколько смертельных случаев, до 1957 года возможность того, что такие змеи были смертельными для человека, казалась весьма маловероятной. Смерть двух известных герпетологов, Роберт Мертенс и Карл Шмидт Из-за укусов африканских колубридов эта оценка изменилась, и недавние события показали, что у некоторых других видов змей с задними клыками есть яды, потенциально смертельные для крупных позвоночных.
Бумсланг (Тип дисфолидуса) и веточка змея (Телоторнис spp.) яды токсичны для клеток крови и разжижают кровь (гемотоксические, геморрагические). Ранние симптомы включают головные боли, тошноту, диарею, летаргию, психическую дезориентацию, синяки и кровотечение на месте поражения и во всех отверстиях тела. Обескровливание - основная причина смерти от такого укуса.
Яд бумсланга - самый сильный из всех зубастых змей в мире, согласно LD.50. Хотя его яд может быть более сильным, чем у некоторых гадюк и элапид, он вызывает меньшее количество смертельных случаев из-за различных факторов (например, эффективность клыков невысока по сравнению со многими другими змеями, доза доза мала, а бумсланги, как правило, меньше агрессивен по сравнению с другими ядовитыми змеями, такими как кобры и мамбы). Симптомы укуса этих змей включают тошноту и внутреннее кровотечение, и можно умереть от кровоизлияние в мозг и респираторный коллапс.
Аглифные змеи
Эксперименты, проведенные с секретом околоушной железы из Рабдофис и Заменис показали, что даже аглифный змеи не полностью лишены яда и указывают на вывод о том, что физиологическое различие между так называемыми безобидными и ядовитыми змеями является лишь одной степенью, точно так же, как существуют различные этапы превращения обычной околоушной железы в ядовитую железу или твердый зуб в трубчатый или зубчатый клык.
Использование змеиного яда для лечения болезней
Учитывая, что змеиный яд содержит много биологически активных ингредиентов, некоторые из них могут быть полезны для лечения болезней.[31]
Например, фосфолипазы типа А2 (PLA2s) от тунисских гадюк Cerastes cerastes и Макровипера лебетина обнаружено противоопухолевое действие.[32] Сообщалось также о противоопухолевой активности других соединений змеиного яда.[33][34] PLA2 гидролизуют фосфолипиды, таким образом, могут действовать на поверхности бактериальных клеток, обеспечивая новые антимикробные (антибиотические) действия.[35]
В обезболивающее (обезболивающая) активность многих белков змеиного яда известна давно.[36][37] Однако основная проблема заключается в доставке белка в нервные клетки, поскольку белки обычно не применяются в виде таблеток.
Иммунитет
Среди змей
Вопрос о том, обладают ли отдельные змеи иммунитетом к их собственному яду, еще окончательно не решен, хотя известен пример кобры, которая подверглась самоотравлению, что привело к большой абсцесс требует хирургического вмешательства, но не демонстрирует никаких других эффектов, которые оказались бы смертельными для жертв или людей.[38] Кроме того, некоторые безвредные виды, такие как североамериканский обычная королевская змея (Lampropeltis getula) и Центральная и южноамериканец Mussurana (Клелия spp.), являются стойкими против яда кроталины, которые часто посещают одни и те же районы, и которые они могут подавлять и кормить. В куриная змея (Spilotes pullatus) является врагом Fer-de-Lance (Ботропс карибский) в Сент-Люсии, и в их столкновениях куриная змея неизменно побеждает. Неоднократные эксперименты показали, что европейская травяная змея (Натрикс Натрикс) не пострадать от укуса Европейская гадюка (Vipera berus) и Европейский жерех (Гипера аспис), это происходит из-за присутствия в крови безобидной змеи токсичных веществ, выделяемых околоушными и губными железами, и аналогичных яду этих гадюк. Доказано, что несколько североамериканских видов крысиных змей, а также королевские змеи обладают иммунитетом или высокой устойчивостью к яду видов гремучих змей. Говорят, что королевская кобра, которая действительно охотится на кобр, неуязвима к их яду.
Среди других животных
В Ежик (Erinaceidae), мангуста (Herpestidae), медоед (Mellivora capensis), опоссум, и еще несколько птицы которые питаются змеями, как известно, невосприимчивы к дозе змеиного яда.[нужна цитата ] Недавно было обнаружено, что у медоеда и домашней свиньи конвергентно эволюционировали аминокислотные замены в никотиновом ацетилхолиновом рецепторе, которые, как известно, придают ежам устойчивость к альфа-нейротоксинам.[39] Был ли свинья может считаться иммунным, все еще сомнительно, хотя ранние исследования показывают эндогенную резистентность свиней, протестированных против нейротоксинов.[40] Хотя свиньи подкожный слой жира может защитить его от змеиного яда, большинство ядов легко проходит через сосудистые жировые слои, поэтому маловероятно, что это влияет на его способность сопротивляться ядам. В садовая соня (Элиомис quercinus) недавно был добавлен в список животных, невосприимчивых к яду гадюки. Некоторые популяции Калифорнийский суслик (Otospermophilus beecheyi) по крайней мере частично невосприимчивы к яду гремучей змеи во взрослом возрасте.
Среди людей
Обретение человеком иммунитета против змеиного яда является древним (примерно с 60 г. н.э. Psylli племя). Исследования по разработке вакцин, которые приведут к иммунитету, продолжаются. Билл Хааст, владелец и директор Серпентария в Майами, большую часть своей взрослой жизни вводил себе змеиный яд, пытаясь выработать иммунитет к широкому спектру ядовитых змей, в практике, известной как митридатизм. Хааст дожил до 100 лет и пережил 172 укуса змей. Он сдал свою кровь для лечения жертв укусов змей, когда подходящего противоядия не было. Выздоровели более 20 человек, подвергшихся такому лечению.[41][42][43] Исследователь-любитель Тим Фриде также позволяет ядовитым змеям укусить себя в надежде на разработку вакцины против змеиного яда, и по состоянию на январь 2016 года он пережил более 160 укусов разных видов.[44]
Традиционные методы лечения
В Всемирная организация здоровья По оценкам, 80% населения мира зависит от традиционной медицины в плане оказания первичной медико-санитарной помощи.[45] Методы традиционного лечения змеиных укусов, хотя и сомнительная эффективность и, возможно, даже вредны, тем не менее актуальны.
Из растений, используемых для лечения укусов змей на Тринидаде и Тобаго, делают настойки на спирте или оливковом масле и хранят в сосудах для рома, называемых змеиными бутылками, которые содержат несколько различных растений и / или насекомых. Используемые растения включают виноградную лозу, называемую обезьяньей лестницей (Bauhinia cumanensis или же Bauhinia excisa, Fabaceae), которую растирают и кладут на укус. Как вариант, настойку готовят из кусочка виноградной лозы и хранят в бутылке со змеей. Другие используемые растения включают матовый корень (Aristolochia rugosa ), кошачий коготь (Pithecellobim unguis-cati ), табак (Nicotiana tabacum ), змеиный куст (Барлерия лупулина ), семя оби (Кола нитида ) и корень дикого гри-гри (Acrocomia aculeata ). Некоторые бутылки со змеями содержат также гусениц (Battus polydamas, Papilionidae), поедающие листья деревьев (Аристолохия трилобата ). Экстренные лекарства от змей получают, пережевывая трехдюймовый кусок корня буа канот (Cecropia peltata ) и введение раствора жевательного корня укушенному субъекту (обычно охотничьей собаке). Это обычное местное растение Латинской Америки и Карибского бассейна, что делает его подходящим в качестве средства неотложной помощи. Еще одно используемое местное растение - марди гра (Renealmia alpinia ) (ягоды), измельченные вместе с соком дикого тростника (Костус скабер ) и отдать укушенному. Быстрые решения включают применение жевательного табака от сигарет, сигар или трубок.[46] В прошлом считалось полезным делать надрезы вокруг прокола или высасывание яда, но сейчас этот курс лечения категорически не рекомендуется из-за риска самоотравления через порезы ножом или порезы во рту (присоски от укуса змеи можно использовать наборы, но отсасывание редко дает ощутимую пользу).[47][48]
Серотерапия
Особого внимания заслуживает прогресс в отношении защитной реакции, посредством которой кровь может быть защищена от яда, с помощью процессов, аналогичных вакцинации - противоядной серотерапии. Исследования показали, что антитоксический сыворотка не действуют как химические противоядия в уничтожении яда, но как физиологическое противоядие; что, помимо ядовитых желез, у змей есть и другие железы, снабжающие их кровь веществами, антагонистичными яду, например, существующие у различных животных, невосприимчивых к змеиному яду, Ежик и мангуста например.
Региональная специфичность яда
К сожалению, специфичность различных ядов змей такова, что даже когда физиологическое действие кажется идентичным, инъекции сыворотки или постепенные прямые прививки дают иммунитет только к одному виду или нескольким родственным видам.
Таким образом, Европейский в Австралия кто стал невосприимчивым к яду смертоносного австралийского тигровая змея (Notechis scutatus), безнаказанно манипулируя этими змеями, и у него создалось впечатление, что его иммунитет распространяется и на другие виды, когда его укусил низинная медная голова (Austrelaps superbus), родственный elapine, умер на следующий день.
В Индия, сыворотка, приготовленная с ядом моноклед кобра Наджа Каутия было обнаружено, что не действует на яд двух видов крайтс (Bungarus), Гадюка Рассела (Дабоя Расселли), гадюка чешуйчатая (Echis carinatus), и Папская яма гадюка (Trimeresurus popeiorum). Сыворотка гадюки Рассела не действует на колубриновые яды или Echis и Тримерурус.
В Бразилия, сыворотка, приготовленная с ядом копьевидных (Ботропс spp.) не действует на гремучую змею (Crotalus spp.) яд.
Лечение змеиного укуса противоядием должно соответствовать типу произошедшего отравления. В Америке доступны поливалентные противоядия, которые эффективны против укусов большинства гадюк. Crofab противоядие, разработанное для лечения укусов североамериканской гадюки.[49] Они не эффективны против коралловая змея отравление, которое требует специфического противоядия к их нейротоксическому яду. Ситуация еще более сложная в таких странах, как Индия, с ее богатым сочетанием гадюк (Viperidae) и крайне нейротоксичных кобр и крайтов Elapidae.
Эта статья основана на книге 1913 года. Змеи Европы, авторства Г. А. Буленджера, который сейчас находится в всеобщее достояние в США (и, возможно, в других местах). Из-за своего возраста текст этой статьи не обязательно следует рассматривать как отражающий современные знания о змеином яде.
Смотрите также
Рекомендации
- ^ "Исследование яда рептилий". Австралийский парк рептилий. Архивировано из оригинал 2 февраля 2010 г.. Получено 21 декабря 2010.
- ^ а б c d е ж Bauchot R (1994). Змеи: естественная история. Нью-Йорк, штат Нью-Йорк, США: Sterling Publishing Co., Inc., стр.194–209. ISBN 978-1-4027-3181-5.
- ^ а б c Халлидей А., Крейг Т., ред. (2002). Энциклопедия рептилий и амфибий Firefly. Торонто, Канада: Firefly Books Ltd., стр.202–203. ISBN 978-1-55297-613-5.
- ^ а б Bottrall JL, Madaras F, Biven CD, Venning MG, Mirtschin PJ (сентябрь 2010 г.). «Протеолитическая активность ядов Elapid и Viperid Snake и ее влияние на пищеварение». Журнал исследований яда. 1 (3): 18–28. ЧВК 3086185. PMID 21544178.
- ^ Мэттисон С (2007). Новая энциклопедия змей. Нью-Джерси, США (впервые опубликовано в Великобритании): Издательство Принстонского университета (Принстон и Оксфорд) впервые опубликовано в Блендфорде. п. 117. ISBN 978-0-691-13295-2.
- ^ Кондреа Е., Деврис А., Магер Дж. (Февраль 1964 г.). «Гемолиз и расщепление фосфолипидов эритроцитов человека змеиным ядом». Biochimica et Biophysica Acta (BBA) - Специализированный раздел по липидам и связанным с ними предметам. 84 (1): 60–73. Дои:10.1016/0926-6542(64)90101-5. PMID 14124757.

- ^ Родригес-Итурральде Д., Сильвейра Р., Барбейто Л., Дахас Ф (1983). «Фасцикулин, мощный антихолинэстеразный полипептид из яда Dendroaspis angusticeps». Международная нейрохимия. 5 (3): 267–74. Дои:10.1016/0197-0186(83)90028-1. PMID 20487949. S2CID 8952817.

- ^ а б «Ключевое слово: геморрагический токсин KW-1200». UniProt. Получено 1 июня 2019.
- ^ Ходжсон В. К., Викрамаратна Дж. К. (сентябрь 2002 г.). «Нервно-мышечная активность ядов змей in vitro». Клиническая и экспериментальная фармакология и физиология. 29 (9): 807–14. Дои:10.1046 / j.1440-1681.2002.03740.x. PMID 12165047. S2CID 20158638.

- ^ He YY, Lee WH, Zhang Y (сентябрь 2004 г.). «Клонирование и очистка альфа-нейротоксинов из королевской кобры (Ophiophagus hannah)». Токсикон. 44 (3): 295–303. Дои:10.1016 / j.toxicon.2004.06.003. PMID 15302536.

- ^ Бернардони Дж. Л., Соуза Л. Ф., Вермелингер Л. С., Лопес А. С., Презото BC, Серрано С. М., Зингали Р. Б., Моура-да-Силва А. М. (14 октября 2014 г.). «Функциональная изменчивость металлопротеиназ змеиного яда: адаптивные преимущества при нацеливании на различные жертвы и последствия для заражения человека». PLOS ONE. 9 (10): e109651. Bibcode:2014PLoSO ... 9j9651B. Дои:10.1371 / journal.pone.0109651. ЧВК 4196926. PMID 25313513.
- ^ Германс К., Виттевронгель С., Тис С., Сметурст П.А., Ван Гит С., Фресон К. (август 2009 г.). «Сложная гетерозиготная мутация гликопротеина VI у пациента с нарушением свертываемости крови». Журнал тромбоза и гемостаза. 7 (8): 1356–63. Дои:10.1111 / j.1538-7836.2009.03520.x. PMID 19552682. S2CID 205728095.

- ^ Broad AJ, Sutherland SK, Coulter AR (17 мая 1979 г.). «Смертоносность мышей опасного австралийского и другого змеиного яда» (PDF). Токсикон. 17 (6): 661–4. Дои:10.1016/0041-0101(79)90245-9. PMID 524395.
- ^ Розен Ф.С. (31 июля 2003 г.). "Эдвин Дж. Кон и развитие химии белков". Медицинский журнал Новой Англии. 349 (5): 511–512. Дои:10.1056 / NEJM200307313490522.
- ^ а б c d Матейчук П., Даш СН, Гаскойн Э.В. (декабрь 2000 г.). «Производство раствора человеческого альбумина: постоянно развивающийся коллоид». Британский журнал анестезии. 85 (6): 887–95. Дои:10.1093 / bja / 85.6.887. PMID 11732525.
- ^ Brodniewicz-Proba T (декабрь 1991 г.). «Фракционирование плазмы человека и влияние новых технологий на использование и качество продуктов, полученных из плазмы». Отзывы о крови. 5 (4): 245–57. Дои:10.1016 / 0268-960х (91) 90016-6. PMID 1782484.
- ^ а б c d е Фрай Б.Г., Казуэлл Н.Р., Вюстер В., Видал Н., Янг Б., Джексон Т.Н. (сентябрь 2012 г.). «Структурная и функциональная диверсификация системы яда рептилий Toxicofera». Токсикон. 60 (4): 434–48. Дои:10.1016 / j.toxicon.2012.02.013. PMID 22446061.
- ^ а б c Casewell NR, Wüster W, Vonk FJ, Harrison RA, Fry BG (апрель 2013 г.). «Сложные коктейли: эволюционная новизна ядов». Тенденции в экологии и эволюции. 28 (4): 219–29. Дои:10.1016 / j.tree.2012.10.020. PMID 23219381.
- ^ Ломонте Б., Фернандес Дж., Санс Л., Ангуло Ю., Саса М., Гутьеррес Дж. М., Кальвет Дж. Дж. (Июнь 2014 г.). «Ядовитые змеи Коста-Рики: биологические и медицинские последствия протеомных профилей их яда, проанализированные с помощью стратегии змеиного яда». Журнал протеомики. 105: 323–39. Дои:10.1016 / j.jprot.2014.02.020. PMID 24576642.
- ^ Линч VJ (январь 2007 г.). «Изобретая арсенал: адаптивная эволюция и неофункционализация генов фосфолипазы A2 змеиного яда». BMC Эволюционная биология. 7 (2): 2. Дои:10.1186/1471-2148-7-2. ЧВК 1783844. PMID 17233905.

- ^ Пахари С., Бикфорд Д., Фрай Б.Г., Кини Р.М. (сентябрь 2007 г.). «Характер экспрессии генов трехпальцевого токсина и фосфолипазы А2 в ядовитых железах двух морских змей, Lapemis curtus и Acalyptophis peronii: сравнение эволюции этих токсинов у наземных змей, морских крайтов и морских змей». BMC Эволюционная биология. 7: 175. Дои:10.1186/1471-2148-7-175. ЧВК 2174459. PMID 17900344.

- ^ а б Барлоу А., Пок CE, Харрисон Р.А., Вюстер (июль 2009 г.). «Коэволюция диеты и активности яда, специфичного для жертвы, поддерживает роль отбора в эволюции змеиного яда». Труды: Биологические науки.. 276 (1666): 2443–9. Дои:10.1098 / rspb.2009.0048. JSTOR 30244073. ЧВК 2690460. PMID 19364745.

- ^ Янса С.А., Восс Р.С. (22 июня 2011 г.). «Адаптивная эволюция белка vWF, нацеленного на яд, у опоссумов, питающихся гадюками». PLOS ONE. 6 (6): e20997. Bibcode:2011PLoSO ... 620997J. Дои:10.1371 / journal.pone.0020997. ЧВК 3120824. PMID 21731638.
- ^ Кальвет Дж. Дж., Гезеллу П., Пайва О., Матаинахо Т., Гассемпур А., Гударзи Х., Краус Ф., Санз Л., Уильямс Д. Д. (июль 2012 г.). «Змеиный яд двух малоизвестных Hydrophiinae: сравнительная протеомика ядов наземных Toxicocalamus longissimus и морских Hydrophis cyanocinctus». Журнал протеомики. 75 (13): 4091–101. Дои:10.1016 / j.jprot.2012.05.026. PMID 22643073.
- ^ Ли М., Фрай Б.Г., Кини Р.М. (январь 2005 г.). «Диета, состоящая только из яиц: ее последствия для изменения токсинного профиля и экологии мраморной морской змеи (Aipysurus eydouxii)». Журнал молекулярной эволюции. 60 (1): 81–9. Bibcode:2005JMolE..60 ... 81L. Дои:10.1007 / s00239-004-0138-0. PMID 15696370. S2CID 17572816.
- ^ Mackessy SP (июль 2010 г.). «Эволюционные тенденции в составе яда западных гремучих змей (Crotalus viridis sensu lato): токсичность против смягчителей». Токсикон. 55 (8): 1463–74. Дои:10.1016 / j.toxicon.2010.02.028. PMID 20227433.
- ^ Савиола А.Дж., Чисар Д., Буш С., Макесси С.П. (март 2013 г.). «Молекулярная основа перемещения добычи у гадюк». BMC Биология. 11 (1): 20. Дои:10.1186/1741-7007-11-20. ЧВК 3635877. PMID 23452837.
- ^ МакКью, доктор медицины (октябрь 2007 г.). «Отравление добычи не улучшает пищеварение у западных гремучих змей (Crotalus atrox)». Журнал экспериментальной зоологии, часть А. 307 (10): 568–77. Дои:10.1002 / jez.411. PMID 17671964.

- ^ Broeckhoven C, du Plessis A (август 2017 г.). «Неужели эволюция змеиного клыка потеряла укус? Новые открытия с точки зрения структурной механики». Письма о биологии. 13 (8): 20170293. Дои:10.1098 / rsbl.2017.0293. ЧВК 5582107. PMID 28768797.
- ^ Мартин CJ, Лэмб G (1907). «Змеиный яд и змеиный укус». В Allbutt TC, Rolleston ND (ред.). Система медицины. Лондон: Макмиллан. С. 783–821.
- ^ McCleary RJ, Kini RM (февраль 2013 г.). «Неферментные белки из змеиного яда: золотая жила фармакологических инструментов и лекарств». Токсикон. 62: 56–74. Дои:10.1016 / j.toxicon.2012.09.008. PMID 23058997.
- ^ Зуари-Кессентини Р., Срайри-Абид Н., Базаа А., Эль-Айеб М., Луис Дж., Марракчи Н. (2013). «Противоопухолевый потенциал тунисских змей, секретируемых фосфолипазой А2». BioMed Research International. 2013: 1–9. Дои:10.1155/2013/391389. ЧВК 3581298. PMID 23509718.
- ^ Вьяс В.К., Брамбхатт К., Бхатт Х., Пармар У. (февраль 2013 г.). «Терапевтический потенциал змеиного яда в терапии рака: современные перспективы». Азиатско-Тихоокеанский журнал тропической биомедицины. 3 (2): 156–62. Дои:10.1016 / S2221-1691 (13) 60042-8. ЧВК 3627178. PMID 23593597.
- ^ Джайн Д., Кумар С. (2012). «Змеиный яд: сильнодействующее противораковое средство». Азиатско-Тихоокеанский журнал профилактики рака. 13 (10): 4855–60. Дои:10.7314 / apjcp.2012.13.10.4855. PMID 23244070.
- ^ de Oliveira Junior NG, e Silva Cardoso MH, Franco OL (декабрь 2013 г.). «Змеиные яды: привлекательные антимикробные белковые соединения для терапевтических целей». Клеточные и молекулярные науки о жизни. 70 (24): 4645–58. Дои:10.1007 / s00018-013-1345-х. PMID 23657358. S2CID 15127065.
- ^ Вульф CJ (январь 2013 г.). «Боль: морфин, метаболиты, мамбы и мутации». Ланцет. Неврология. 12 (1): 18–20. Дои:10.1016 / S1474-4422 (12) 70287-9. PMID 23237896. S2CID 8697382.
- ^ Осипов А, Уткин Ю. (декабрь 2012). «Влияние полипептидов змеиного яда на центральную нервную систему». Агенты центральной нервной системы в медицинской химии. 12 (4): 315–28. Дои:10.2174/187152412803760618. PMID 23270323. S2CID 36274766.
- ^ «Стерильный абсцесс хвоста у Naja annulifera - случай самоотравления». Архивировано из оригинал 27 октября 2004 г.. Получено 2 апреля 2009.
- ^ Драбек Д., Янса С. (2015). «Почему медовый барсук не заботится: независимая эволюция устойчивости к трехпальцевым токсинам в никотиновых ацетилхолиновых рецепторах». Токсикон. 99: 68–72. Дои:10.1016 / j.toxicon.2015.03.007. PMID 25796346.
- ^ Grasset E, Zoutendykanda A, Schaafsma A (1935). «Исследования токсических и антигенных свойств ядов южноафриканских змей с особым упором на поливалентность южноафриканского противоядия». Пер. R. Soc. Троп. Med. Гигиена. 28 (6): 601–612. Дои:10.1016 / S0035-9203 (35) 90031-1.
- ^ «Прощай, эти знаменитые флоридцы». Флорида Тренд. 19 декабря 2011 г.. Получено 2 апреля 2012.
- ^ Розенберг С. (21 июня 2011 г.). "Билл Хааст умирает в возрасте 100 лет; змеи были очарованием знаменитостей южной Флориды". Лос-Анджелес Таймс. Получено 16 октября 2012.
- ^ Шудель М. (18 июня 2011 г.). «Билл Хааст умер в возрасте 100 лет: человек-змея из Флориды предоставил яд для сыворотки от укуса змеи». Вашингтон Пост. Получено 16 октября 2012.
- ^ «Человек заставляет смертоносных змей укусить себя 160 раз в поисках противоядия для человека | Америка | Новости | The Independent». 21 января 2016 г.. Получено 7 июля 2016.
- ^ Hiremath VT, Taranath TC (февраль 2010 г.). «Традиционная фитотерапия от укусов змей племенами района Читрадурга, Карнатака, Индия». Этноботанические буклеты. 14 (2): 120–125.
- ^ Зетелиус М., Балик М.Дж. (март 1982 г.). «Современная медицина и шаманский ритуал: случай положительного синергетического ответа при лечении укуса змеи» (PDF). Журнал этнофармакологии. 5 (2): 181–5. Дои:10.1016/0378-8741(82)90042-3. PMID 7057657.

- ^ «Лечение укусов змей». Ces.ncsu.edu. Получено 16 октября 2012.
- ^ "CDC - Venomous Snakes - NIOSH Workplace Safety and Health Topic". CDC.gov. 1 июля 2016 г.. Получено 7 июля 2016.
- ^ http://www.savagelabs.com/Products/CroFab/Home/crofab_frame.htm Ссылка на PDF для получения полной информации по рецептам, получено 11/12/12
дальнейшее чтение
- Йонассен И., Коллинз Дж. Ф., Хиггинс Д. Г. (август 1995 г.). «Поиск гибких паттернов в невыровненных белковых последовательностях». Белковая наука. 4 (8): 1587–95. Дои:10.1002 / pro.5560040817. ЧВК 2143188. PMID 8520485.
- Шоу IC (2007). «Глава 19: Змеиные токсины». В Waring RH, Steventon GB, Mitchell SC (ред.). Молекулы смерти (Второе изд.). Ривер Эдж, штат Нью-Джерси: Imperial College Press. стр.329 –344. ISBN 978-1-86094-815-2.
внешняя ссылка
- Обзор разнообразия и эволюции змеиных клыков.
- Змеиные ядыUMich Ориентация белков в мембранах семьи / суперсемейство-55 - Расчетные ориентации фосфолипаз A2 змеиного яда и миотоксинов в липидном бислое.
- LD50 для большинства токсичных ядов.
- Австралийский отдел исследования яда - общий источник информации о ядовитых существах Австралии.
- biomedcentral.com - Лечебные и этноветеринарные средства охотников в Тринидад.
- reptilis.net - Как работает яд.
- snakevenom.net - Сушка и хранение змеиного яда.

