Ответ поликлональных В-клеток - Polyclonal B cell response

Ответ поликлональных В-клеток это естественный способ иммунного ответа, проявляемый адаптивная иммунная система из млекопитающие. Это гарантирует, что один антиген распознается и атакуется через перекрывающиеся части, называемые эпитопы, несколькими клоны из В клетка.[1][2]
При нормальном иммунном ответе части патогены (например. бактерии ) распознаются иммунной системой как чужеродные (чужеродные) и устраняются или эффективно нейтрализуются, чтобы уменьшить их потенциальный ущерб. Такое узнаваемое вещество называется антиген. Иммунная система может по-разному реагировать на антиген; ключевой особенностью этого ответа является производство антитела В-клетками (или В-лимфоцитами) с участием одного из звеньев иммунной системы, известного как гуморальный иммунитет. Антитела растворимы и не требуют прямого межклеточного контакта между патогеном и B-клеткой для функционирования.
Антигены могут быть крупными и сложными веществами, и любое отдельное антитело может связываться только с небольшой специфической областью антигена. Следовательно, эффективный иммунный ответ часто включает выработку множества различных антител множеством различных В-клеток против одно и тоже антиген. Отсюда термин «поликлональный», происходящий от слов поли, смысл много, и клоны («Клон» = по-гречески росток или веточка);[3][4][5] клон - это группа клеток, происходящая из общей «материнской» клетки. Антитела, продуцируемые таким образом в поликлональном ответе, известны как поликлональные антитела. В неоднородный поликлональные антитела отличаются от моноклональное антитело молекулы, которые идентичны и реагируют только против одного эпитопа, т.е. более специфичны.
Хотя поликлональный ответ дает преимущества для иммунной системы, в частности, большую вероятность реакции против патогенов, он также увеличивает шансы развития определенных аутоиммунных заболеваний, возникающих в результате реакции иммунной системы на нативные молекулы, продуцируемые в организме хозяина.
Гуморальный ответ на инфекцию
Заболевания, которые могут передаваться от одного организма к другому, известны как инфекционные заболевания, а причинный биологический агент известен как возбудитель. Процесс, посредством которого возбудитель попадает в организм, известен как прививка,[примечание 1][6] и организм, на который он влияет, известен как биологический хозяин. Когда патоген закрепляется на этапе, известном как колонизация,[7] это может привести к инфекционное заболевание,[7] следовательно, причинение вреда хозяину напрямую или через вредные вещества, называемые токсины он может производить.[7] Это приводит к различным симптомы и приметы характеристика инфекционного заболевания, такого как пневмония или же дифтерия.
Противодействие различным инфекционным заболеваниям очень важно для выживания восприимчивый организм, в частности, и вид в целом. Это достигается хозяином, устраняя патоген и его токсины или делая их нефункциональными. Коллекция различных клетки, ткани и органы который специализируется на защите организма от инфекций, известен как иммунная система. Иммунная система достигает этого посредством прямого контакта с определенными белые кровяные клетки с вторгающимся патогеном, вовлекающим часть иммунной системы, известную как клеточный иммунитет, или производя вещества, которые перемещаются на сайты далекий откуда они производятся, «ищут» болезнетворные клетки и токсины, специально[заметка 2] связываться с ними и нейтрализовать их в процессе, известном как гуморальная рука иммунной системы. Такие вещества известны как растворимые антитела и выполняют важные функции в борьбе с инфекциями.[заметка 3][8]
- Виды белые кровяные клетки (WBC)
В-клеточный ответ

Антитела служат различным функции в защите хозяина от патогена. Их растворимые формы, которые выполняют эти функции, производятся плазматические В-клетки, тип лейкоцитов. Это производство строго регулируется и требует активации В-клеток путем активации Т-клетки (другой тип лейкоцитов), который представляет собой последовательную процедуру. Основные этапы:[9]
- Специфическое или неспецифическое распознавание патогена (из-за его антигенов) с последующим поглощением его В-клетками или макрофаги. Это активирует только В-клетку. частично.
- Обработка антигена.
- Презентация антигена.
- Активация Т-хелперные клетки к антигенпрезентирующие клетки.
- Совместная стимуляция В-клетки активирован Т-клетка, в результате полный активация.
- Распространение[примечание 4] B-клеток с получением растворимых антител.

Распознавание возбудителей болезней
Патогены синтезируют белки что может служить "узнаваемый " антигены; они могут экспрессировать молекулы на своей поверхности или выпускать их в окружающую среду (жидкости организма). Что делает эти вещества узнаваемыми, так это то, что они очень специфично и несколько прочно связываются с определенными белками хозяина, называемыми антитела. Эти же антитела могут быть прикреплены к поверхности клеток иммунной системы, и в этом случае они служат рецепторы, или они могут секретироваться в кровь, известные как растворимые антитела. В молекулярном масштабе белки относительно большие, поэтому их нельзя распознать целиком; вместо этого их сегменты, называемые эпитопы, можно узнать.[1] Эпитоп контактирует с очень маленькой областью (из 15–22 аминокислот) молекулы антитела; этот регион известен как паратоп.[1] В иммунной системе мембраносвязанные антитела являются В-клеточный рецептор (BCR). Кроме того, хотя Т-клеточный рецептор не классифицируется биохимически как антитело, он выполняет аналогичную функцию, поскольку он специфически связывается с эпитопами в комплексе с главный комплекс гистосовместимости (MHC) молекулы.[примечание 5][10] Связывание между паратопом и его соответствующим антигеном очень специфично из-за его структуры и определяется различными нековалентные связи, мало чем отличается от пары других типов лиганды (любой атом, ион или молекула, которая связывается с любым рецептором, по крайней мере, с некоторой степенью специфичность и сила). Специфичность связывания не возникает из-за жесткого замок и ключ типа взаимодействия, а скорее требует, чтобы паратоп и эпитоп претерпели небольшие конформационные изменения в присутствии друг друга.[11]
Специфическое распознавание эпитопа В-клетками

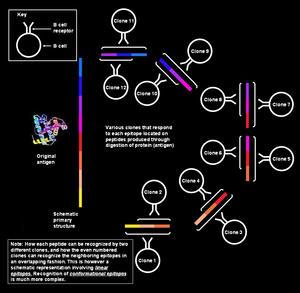
На рисунке слева показано, что различные сегменты, образующие эпитоп, непрерывно коллинеарны, что означает, что они показаны как последовательные; однако для обсуждаемой здесь ситуации (т.е. распознавания антигена B-клеткой) это объяснение слишком упрощенно. Такие эпитопы известны как последовательный или же линейные эпитопы, поскольку все аминокислоты на них находятся в одной последовательности (линии). Этот способ распознавания возможен только в том случае, если пептид небольшой (от шести до восьми аминокислот в длину),[1] и используется Т-клетками (Т-лимфоцитами).
Однако B-клетки памяти / наивные клетки распознают интактные белки, присутствующие на поверхности патогена.[примечание 6] В этой ситуации белок в своем третичная структура настолько сложен, что некоторые петли аминокислот оказываются внутри белка, а сегменты, фланкирующие их, могут лежать на поверхности. Паратоп на рецепторе В-клеток контактирует только с теми аминокислотами, которые лежат на поверхность белка. Поверхностные аминокислоты могут фактически не входить в состав белка. первичная структура, но получить сопоставлен из-за сложных паттернов сворачивания белков (как на следующем рисунке). Такие эпитопы известны как конформационный эпитопы и имеют тенденцию быть длиннее (15–22 аминокислотных остатка), чем линейные эпитопы.[1] Точно так же антитела, продуцируемые плазматическими клетками, принадлежащими к одному и тому же клону, будут связываться с одними и теми же конформационными эпитопами на белках патогенов.[12][13][14][15]
Связывание специфического антигена с соответствующими молекулами BCR приводит к увеличению продукции молекул MHC-II. Это имеет значение, поскольку того же не происходит, когда один и тот же антиген интернализуется в результате относительно неспецифического процесса, называемого пиноцитоз, в котором антиген с окружающей жидкостью «поглощается» В-клеткой в виде небольшого пузырька.[16] Следовательно, такой антиген известен как неспецифический антиген и не приводит к активации В-клетки или последующему образованию антител против нее.
Неспецифическое распознавание макрофагами
Макрофаги и родственные клетки использовать другой механизм для распознавания патогена. Их рецепторы распознают определенные мотивы присутствуют на вторгающемся патогене, которые очень вряд ли присутствовать на клетке-хозяине. Такие повторяющиеся мотивы распознаются рецепторы распознавания образов (PRR) как толл-подобные рецепторы (TLR), экспрессируемые макрофагами.[1][17] Поскольку один и тот же рецептор может связываться с данным мотивом, присутствующим на поверхностях очень разных микроорганизмы, этот способ распознавания относительно неспецифичен и представляет собой врожденный иммунный ответ.
Обработка антигена

Узнав антиген, антигенпрезентирующая клетка такой как макрофаг или B-лимфоцит полностью поглощает его с помощью процесса, называемого фагоцитоз. Поглощенная частица вместе с некоторым окружающим ее материалом образует эндоцитарный пузырек ( фагосома ), который сливается с лизосомы. Внутри лизосомы антиген разбивается на более мелкие части, называемые пептиды к протеазы (ферменты которые разрушают более крупные белки). Затем отдельные пептиды образуют комплекс с основным комплексом гистосовместимости класса II (MHC класс II ) молекул, расположенных в лизосоме - этот метод «обращения» с антигеном известен как экзогенный или эндоцитарный путь процессинга антигена в отличие от эндогенный или цитозольный путь,[17][18][19] что составляет комплекс аномальный белки, продуцируемые внутри клетки (например, под влиянием вирусная инфекция или в опухоль ячейка) с MHC класс I молекулы.
Также был продемонстрирован альтернативный путь эндоцитарного процессинга, при котором определенные белки, такие как фибриноген и миоглобин могут связываться в целом с молекулами MHC-II после того, как они денатурированный и их дисульфидные связи находятся уменьшенный (разрыв связи путем добавления водород атомы поперек него). Затем протеазы разрушают экспонированные области комплекса белок-MHC II.[19]
Презентация антигена
После того, как процессированный антиген (пептид) образует комплекс с молекулой MHC, они оба вместе мигрируют в клеточная мембрана, где они представлены (проработаны) как комплекс, узнаваемый CD 4+ (Т-хелперная клетка) - разновидность лейкоцитов.[примечание 7][20] Это известно как презентация антигена. Однако эпитопы (конформационные эпитопы), которые распознаются В-клеткой до их переваривания, могут отличаться от эпитопов, представленных Т-хелперной клетке. Кроме того, В-клетка может представлять разные пептиды в комплексе с разными молекулами MHC-II.[16]
Стимуляция Т-хелперных клеток
Клетки CD 4+ через свой Т-клеточный рецептор -CD3 комплекс распознает связанные с эпитопом молекулы MHC II на поверхности антигенпрезентирующих клеток и получает 'активировано'. После этой активации эти Т-клетки пролиферируют и дифференцируются в Тчас2 ячейки.[16][21] Это заставляет их производить растворимые химические сигналы, способствующие их собственному выживанию. Однако другой важной функцией, которую они выполняют, является стимуляция В-клеток путем установления непосредственный физический контакт с ними.[10]
Костимуляция В-клетки активированной Т-хелперной клеткой
Полная стимуляция Т-хелперных клеток требует B7 молекула, присутствующая на антигенпрезентирующей клетке, чтобы связываться с CD28 молекула присутствует на поверхности Т-клеток (в непосредственной близости с рецептором Т-клеток).[10] Аналогичным образом, второе взаимодействие между лигандом CD40 или CD154 (CD40L ) присутствует на поверхности Т-клеток и CD40 присутствует на поверхности В-клеток, также необходимо.[21] Те же взаимодействия, которые стимулируют Т-хелперные клетки, также стимулируют В-клетки, отсюда и термин костимуляция. Весь механизм гарантирует, что активированная Т-клетка стимулирует только В-клетку, которая распознает антиген, содержащий одно и тоже эпитоп, распознаваемый Т-клеточным рецептором «костимулирующей» Т-хелперной клетки. Помимо прямой костимуляции, В-клетка стимулируется определенными факторами роста, а именно: интерлейкины 2, 4, 5, и 6 в паракринный мода. Эти факторы обычно производятся вновь активированными Т-хелперами.[22] Однако эта активация происходит только после того, как рецептор В-клеток, присутствующий на объем памяти или наивный Сама В-клетка связалась бы с соответствующим эпитопом, без чего не произошли бы инициирующие стадии фагоцитоза и процессинга антигена.
Пролиферация и дифференцировка В-клеток
Наивный (или неопытный) В-клетка - это клетка, которая принадлежит клону, который никогда не встречал эпитопа, к которому она специфична. Напротив, B-клетка памяти - это та, которая происходит от активированной наивной B-клетки или B-клетки памяти. Активация наивной B-клетки или B-клетки памяти сопровождается многократной пролиферацией этой конкретной B-клетки, большая часть потомства которой окончательно дифференцируется в плазматические В-клетки;[примечание 8] остальные выживают как В-клетки памяти. Итак, когда наивные клетки, принадлежащие к определенному клону, сталкиваются со своим специфическим антигеном, чтобы дать начало плазматическим клеткам, а также оставляют несколько клеток памяти, это известно как первичный иммунный ответ. В ходе пролиферации этого клона рецептор В-клеток гены может подвергаться частым (один из каждых два деления клеток)[8] мутации в генах, кодирующих паратопы антител. Эти частые мутации называют соматическая гипермутация. Каждая такая мутация незначительно изменяет способность паратопа связываться с эпитопом, создавая при этом новые клоны В-клеток. Некоторые из недавно созданных паратопов связывают сильнее к тому же эпитопу (что приводит к отбор клонов, обладающих ими), который известен как созревание аффинности.[примечание 9][8][21] Другие паратопы лучше связываются с эпитопами, которые немного отличается от исходного эпитопа, который стимулировал пролиферацию. Вариации в структуре эпитопа также обычно вызываются мутациями в генах патогена, кодирующего их антиген. Таким образом, соматическая гипермутация делает рецепторы В-клеток и растворимые антитела при последующих встречах с антигенами более инклюзивными в их потенциале распознавания антигенов. изменен эпитопов, помимо придания большей специфичности антигену, который в первую очередь индуцировал пролиферацию. Когда клетки памяти стимулируются антигеном для производства плазматических клеток (точно так же, как в случае первичного ответа клона) и оставляют в процессе еще больше клеток памяти, это известно как вторичный иммунный ответ,[21] что приводит к увеличению количества плазматических клеток и увеличению выработки антител в течение более длительных периодов времени. В-клетки памяти, продуцируемые как часть вторичного ответа, быстрее распознают соответствующий антиген и более прочно связываются с ним (т.е. с большей аффинностью связывания) благодаря созреванию аффинности. Растворимые антитела, продуцируемые клоном, демонстрируют аналогичное усиление связывания антигена.[21]
Основа поликлональности
Ответы являются поликлональными по своей природе, поскольку каждый клон в некоторой степени специализируется на продукции антител против данного эпитопа, и поскольку каждый антиген содержит несколько эпитопов, каждый из которых, в свою очередь, может распознаваться более чем одним клоном В-клеток. Чтобы иметь возможность реагировать на бесчисленные антигены, а также на несколько составляющих эпитопов, иммунная система требует способности распознавать очень большое количество эпитопов в целом, то есть должно быть большое разнообразие клонов В-клеток.
Клональность В-клеток
объем памяти а наивные В-клетки обычно существуют в относительно небольших количествах. Поскольку организм должен быть в состоянии реагировать на большое количество потенциальных патогенов, он поддерживает пул В-клеток с широким спектром специфичности.[17] Следовательно, хотя почти всегда есть по крайней мере одна В (наивная или память) клетка, способная реагировать на любой данный эпитоп (из всего, против чего может реагировать иммунная система), существует очень мало точных дубликатов. Однако, когда одна В-клетка встречает антиген, с которым она может связываться, она может очень быстро пролиферировать.[21] Такая группа клеток с идентичной специфичностью по отношению к эпитопу известна как клон, и происходит от общей «материнской» клетки. Все «дочерние» В-клетки соответствуют исходной «материнской» клетке по своей эпитопной специфичности и секретируют антитела с идентичными паратопами. Эти антитела моноклональные антитела, поскольку они происходят от клонов одной и той же родительской клетки. Поликлональный ответ - это ответ, при котором клоны нескольких В-клеток реагируют на один и тот же антиген.
Один антиген содержит несколько перекрывающихся эпитопов

Один антиген можно рассматривать как последовательность множества перекрывающихся эпитопов. Многие уникальные клоны В-клеток могут связываться с отдельными эпитопами. Это придает еще большую множественность общему отклику.[3] Все эти В-клетки могут активироваться и производить большие колонии клонов плазматических клеток, каждая из которых может секретировать до 1000 молекул антител против каждого эпитопа в секунду.[21]
Множественные клоны распознают один эпитоп
В дополнение к различным В-клеткам, реагирующим на разные эпитопов на одном и том же антигене, В-клетки, принадлежащие к разным клонам, также могут реагировать на одно и тоже эпитоп. Эпитоп, который может быть атакован множеством различных В-клеток, считается высокоэффективным. иммуногенный. В этих случаях связывающее сродство для соответствующих пар эпитоп-паратоп различаются, при этом некоторые клоны В-клеток продуцируют антитела, которые сильно связываются с эпитопом, а другие продуцируют антитела, которые связываются слабо.[1]
Клональный отбор
Клоны, которые связываются с конкретным эпитопом с большей силой, с большей вероятностью будут выбранный для дальнейшего распространения в зародышевых центрах фолликулов в различных лимфоидных тканях, таких как лимфатический узел. Это не похоже на естественный отбор: клоны отбираются по их способности атаковать эпитопы (силу связывания) на встреченном патогене.[23]Что делает аналогию еще более сильной, так это то, что В-лимфоциты должны конкурировать друг с другом за сигналы, которые способствуют их выживанию в зародышевых центрах.
Разнообразие клонов В-клеток
Хотя существует множество разнообразных патогенов, многие из которых постоянно мутируют, удивительно, что большинство людей остаются свободными от инфекций. Таким образом, для поддержания здоровья организм должен распознавать все возможные патогены (антигены, которые они представляют или вырабатывают). Это достигается за счет поддержания чрезвычайно большого пула (около 109) клоны В-клеток, каждый из которых реагирует против определенного эпитопа, узнавая и продуцируя антитела против него. Однако в любой момент времени очень немногие клоны остаются восприимчивыми к своему специфическому эпитопу. Таким образом, примерно 107 разные эпитопы могут распознаваться всеми клонами В-клеток вместе взятыми.[21] Более того, в течение жизни человеку обычно требуется выработка антител против очень небольшого числа антигенов по сравнению с количеством, которое организм может распознать и отреагировать.[21]
Значение явления
Повышенная вероятность распознавания любого антигена
Если антиген может быть распознан более чем одним компонентом своей структуры, вероятность того, что он будет «пропущен» иммунной системой, меньше.[примечание 10] Мутация патогенных организмов может привести к модификации структуры антигена и, следовательно, эпитопа. Если иммунная система «помнит», как выглядят другие эпитопы, антиген и организм все равно будут распознаваться и подвергаться иммунному ответу организма. Таким образом, поликлональный ответ расширяет круг распознаваемых патогенов.[24]
Ограничение иммунной системы против быстро мутирующих вирусов
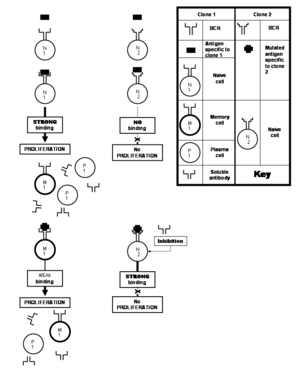
Многие вирусы часто подвергаются мутации что приводит к изменениям аминокислотного состава их важных белков. Эпитопы, расположенные на белке, также могут претерпевать изменения в этом процессе. Такой измененный эпитоп менее прочно связывается с антителами, специфичными к неизмененному эпитопу, которые стимулировали бы иммунную систему. Это прискорбно, потому что соматическая гипермутация действительно дает клоны, способные продуцировать растворимые антитела, которые связывали бы измененный эпитоп достаточно активно, чтобы нейтрализовать его. Но эти клоны могут состоять из наивных клеток, которым не позволяют пролиферировать слабо связывающиеся антитела, продуцируемые ранее стимулированным клоном. Эта доктрина известна как изначальный антигенный грех.[21] Этот феномен проявляется, в частности, в иммунных ответах против грипп, денге и ВИЧ вирусы.[25] Однако это ограничение не налагается. к явление поликлонального ответа, а скорее, против этого иммунным ответом, который смещен в пользу опытных клеток памяти против «новичков» наивных клеток.
Повышенная вероятность аутоиммунных реакций
В аутоиммунитет иммунная система ошибочно распознает определенные нативные молекулы в организме как чужеродные (аутоантиген) и вызывает против них иммунный ответ. Поскольку эти нативные молекулы, как нормальные части тела, естественным образом всегда существуют в организме, атаки на них могут со временем усилиться (аналогично вторичному иммунному ответу). Более того, многие организмы проявляют молекулярная мимикрия, который включает демонстрацию на своей поверхности тех антигенов, которые антигенно сходны с белками хозяина. Это имеет два возможных последствия: во-первых, либо организм будет сохранен как аутоантиген; или, во-вторых, антитела, продуцируемые против него, также будут связываться с имитируемыми нативными белками. Антитела будут атаковать аутоантигены и ткани, в которых они находятся, путем активации различных механизмов, таких как активация комплемента и антителозависимая клеточно-опосредованная цитотоксичность. Следовательно, чем шире диапазон специфичности антител, тем выше вероятность того, что тот или другой будет реагировать против аутоантигенов (нативных молекул организма).[26][27]
Сложность производства моноклональных антител
Моноклональные антитела представляют собой структурно идентичные молекулы иммуноглобулинов с идентичной эпитоп-специфичностью (все они связываются с одним и тем же эпитопом с одинаковым сродством) по сравнению с их поликлональными аналогами, которые имеют различное сродство к одному и тому же эпитопу. Они обычно не образуются в естественном иммунном ответе, а только в болезненных состояниях, таких как множественная миелома, или с помощью специализированных лабораторных методов. Из-за своей специфичности моноклональные антитела используются в определенных приложениях для количественной оценки или обнаружения присутствия веществ (которые действуют как антиген для моноклональных антител) и для нацеливания на отдельные клетки (например, раковые клетки). Моноклональные антитела находят применение в различных диагностических методах (см .: вестерн-блот и иммунофлуоресценция ) и терапии - особенно рака и заболеваний с аутоиммунным компонентом. Но поскольку практически все ответы в природе являются поликлональными, это делает производство чрезвычайно полезных моноклональных антител. менее простой.[8]
История
Первые свидетельства наличия в крови нейтрализующего вещества, которое могло бы противостоять инфекциям, были получены, когда Эмиль фон Беринг вместе с Китасато Шибасабуро в 1890 г. разработаны эффективные сыворотка против дифтерии. Они сделали это, передав сыворотку, полученную от животных, иммунизированных против дифтерии, животным, страдающим от нее. Таким образом, перенос сыворотки может вылечить инфицированных животных. Беринг был награжден Нобелевская премия за эту работу в 1901 г.[28]
В то время, однако, не была известна химическая природа того, что именно в крови дает эту защиту. Через несколько десятилетий было показано, что защитная сыворотка может нейтрализовать и осаждать токсины и скапливать бактерии. Все эти функции были приписаны различным веществам в сыворотке и названы соответственно как антитоксин, осаждение и агглютинин.[17] Что все три субстанции были одним целым (гамма-глобулины ) был продемонстрирован Эльвин А. Кабат в 1939 г. В предыдущем году Кабат продемонстрировал гетерогенность антител через ультрацентрифугирование исследования сывороток лошадей.[29]
До этого времени клеточный иммунитет и гуморальный иммунитет считались конкурирующими теориями, объясняющими эффективный иммунный ответ, но первые отставали из-за отсутствия передовых методов.[17] Клеточный иммунитет получил импульс в своем признании и изучении, когда в 1942 г. Меррил Чейз успешно передан иммунитет против туберкулез между свиньями путем передачи лейкоцитов.[17][30]
Позже в 1948 году Астрид Фагрей в своей докторской диссертации показала, что плазматические В-клетки специфически участвуют в производстве антител.[31] Роль лимфоцитов в опосредовании как клеточно-опосредованных, так и гуморальных реакций была продемонстрирована Джеймсом Гоуэнсом в 1959 году.[30]
Чтобы учесть широкий спектр антигенов, которые может распознавать иммунная система, Пол Эрлих в 1900 г. выдвинули гипотезу, что существовавшие ранее "рецепторы боковой цепи" связывают данный патоген, и это взаимодействие заставляет клетку, демонстрирующую рецептор, размножаться и производить больше копий того же рецептора. Эта теория, названная селективная теория не было доказано в течение следующих пяти десятилетий, и несколько учебные теории которые основывались на представлении о том, что антитело принимает свою эффективную структуру за счет укладки вокруг антигена.[17] Однако в конце 1950-х годов работы трех ученых -Jerne, Талмаж и Кровохлебка (который в значительной степени изменил теорию) - дал начало теория клонального отбора, который подтвердил все элементы гипотезы Эрлиха, за исключением того, что специфические рецепторы, которые могли нейтрализовать агент, были растворимы и не связаны с мембраной.[17][30]
Теория клонального отбора оказалась верной, когда сэр Густав Носсаль показали, что каждая В-клетка всегда производит только одно антитело.[32]
В 1974 г. роль MHC в презентации антигена была продемонстрирована Рольф Цинкернагель и Питер С. Доэрти.[30]
Смотрите также
- Поликлональные антитела
- Обработка антигена
- Антисыворотка, препарат поликлональных антител, используемый для лечения отравления
Примечания
- ^ Период, термин "прививка" обычно используется в контексте активная иммунизация то есть сознательное введение антигенного вещества в организм хозяина. Но во многих дискуссиях об инфекционных заболеваниях нередко используют этот термин для обозначения спонтанного (то есть без вмешательства человека) события, приводящего к проникновению возбудителя в организм, например, употребление воды, загрязненной Сальмонелла тиф - возбудитель брюшной тиф. В таких случаях сам возбудитель известен как возбудитель болезни. инокулят, и количество организмов, введенных как «доза инокулята».
- ^ Специфика подразумевает, что два разных патогена будут фактически рассматриваться как две разные сущности, которым противодействуют разные молекулы антител.
- ^ Действия антител:
- Покрытие патогена, предотвращающее его прилипание к клетке-хозяину и, таким образом, предотвращение колонизации
- Осаждение (заставляя частицы «тонуть», прикрепляясь к ним) растворимых антигенов и способствуя их удалению другими клетками иммунной системы из различных тканей и крови.
- Покрытие микроорганизмов для привлечения клеток, способных поглотить возбудителя. Это известно как опсонизация. Таким образом, антитело действует как опсонин. Процесс поглощения известен как фагоцитоз (в прямом смысле, клеточное питание)
- Активация система комплемента, что наиболее важно проделывает дыры во внешней оболочке возбудителя (его клеточная мембрана ), убивая его в процессе
- Маркировка клеток-хозяев, инфицированных вирусами, для уничтожения в процессе, известном как Антителозависимая клеточно-опосредованная цитотоксичность (ADCC)
- ^ Распространение в данном контексте означает умножение на деление клеток и дифференциация
- ^ В главный комплекс гистосовместимости это область гена на ДНК что кодирует синтез Основная молекула класса I гистосовместимости, Основная молекула класса гистосовместимости II и другие белки, участвующие в функции система комплемента (MHC класс III). Первые два продукта важны в презентация антигена. Совместимость с MHC является важным аспектом в трансплантация органов, а у людей также известен как человеческий лейкоцитарный антиген (HLA).
- ^ Здесь, нетронутый означает, что непереваренный белок распознается, и нет что паратоп на рецепторе В-клеток вступает в контакт с весь белковый состав при этом; паратоп будет по-прежнему контактировать только с ограниченной частью антигена, экспонированной на его поверхности.
- ^ Есть много типов лейкоцитов. Обычный способ их классификации - по их внешнему виду под оптический микроскоп после того, как они окрашенный химическими красителями. Но с развитием технологий появились новые методы классификации. Один из методов предполагает использование моноклональные антитела, который может связываться конкретно с каждым типом ячейки. Более того, один и тот же тип лейкоцита будет экспрессировать на своей клеточной мембране типичные для него молекулы на разных стадиях развития. Моноклональные антитела, которые могут специфически связываться с определенной поверхностной молекулой, будут рассматриваться как один кластер дифференциации (CD). Любое моноклональное антитело или группа моноклональных антител, которые реагируют не с известными поверхностными молекулами лимфоцитов, а скорее с еще нераспознанной поверхностной молекулой, будут обозначены как новый кластера дифференциации и пронумерованы соответственно. Каждый кластер дифференциации обозначается аббревиатурой «CD», за которым следует число (обычно указывающее порядок обнаружения). Итак, клетка, имеющая поверхностную молекулу (называемую лиганд ), который специфически связывается с кластером дифференцировки 4 будет известен как CD4 + клетка. Точно так же CD8 + клетка это тот, который мог бы обладать лигандом CD8 и связываться с моноклональными антителами CD8.
- ^ Плазматические клетки секретируют антитела, которые связываются с одно и тоже структура, которая стимулировала В-клетку в первую очередь за счет связывания с ее рецептором В-клетки.
- ^ Близость примерно переводится как Привлечение от лат. Смотрите также: Значение Близость из Интернет-этимологического словаря и Значение Близость из TheFreeDictionary пользователя Farlex
- ^ Аналогично, если в людном месте предполагается узнать человека, лучше узнать как можно больше физических характеристик. Если вы знаете человека только по прическе, есть шанс не заметить человека, если ситуация изменится. Между тем, если помимо прически, если вы также знаете черты лица и то, что человек будет носить в конкретный день, становится гораздо более маловероятным, что вы пропустите этого человека.
Рекомендации
- ^ а б c d е ж грамм час я Голдсби, Ричард; Киндт, TJ; Осборн, BA; Янис Куби (2003). «Антигены (Глава 3)». Иммунология (Пятое изд.). Нью-Йорк: В. Х. Фриман и компания. стр.57–75. ISBN 978-0716749479.
- ^ «Определение поликлонального от MedicineNet.com». Медицинский словарь нового мира Вебстера. Получено 2008-05-03.
- ^ а б Франк, Стивен А. (2002). «Специфичность и перекрестная реактивность (Глава 4)». Иммунология и эволюция инфекционных заболеваний. Университет Принстона. С. 33–56. ISBN 978-0691095950. Получено 2008-06-23.
- ^ «Этимология» клона"". Интернет-словарь этимологии. Получено 2008-06-26.
- ^ Бансал, Р. (2005). "Репродуктивное клонирование - акт нарушения прав человека". Журнал Индийской ассоциации судебной медицины. 27 (3): 971–973. Получено 2008-06-23.
- ^ "Значение прививка". TheFreeDictionary.com (со ссылкой на «Медицинский словарь Дорланда для потребителей здравоохранения». © 2007 г., Saunders, отпечаток Elsevier, Inc.). Получено 2008-06-10.
- ^ а б c Пьер, Джеральд Б. (2005) [1945]. «Молекулярные механизмы микробного патогенеза (Глава 105)». В Каспере; Браунвальд; Фаучи; Хаузер; Лонго; Джеймсон (ред.). Принципы внутренней медицины Харрисона. 1 (Шестнадцатое изд.). Макгроу-Хилл. п. 700. ISBN 978-0-07-123983-7.
- ^ а б c d е Голдсби (2007). «Организация и экспрессия генов иммуноглобулинов (глава 5)». Иммунология (Пятое изд.). Нью-Йорк. С. 105–136. ISBN 978-0-7167-6764-0.
- ^ Нэрн, Родерик (2004) [1954]. «Иммунология (Глава 8)». В Гео Ф. Брукс; Джанет С. Бутель; Стивен А. Морс (ред.). Медицинская микробиология Явца, Мельника и Адельберга (Двадцать третье издание, международное изд.). Публикации Ланге / Макгроу-Хилл. С. 133–135, 138–139. ISBN 978-0-07-123983-7.
- ^ а б c Голдсби (2007). «Созревание, активация и дифференциация Т-клеток (Глава 10)». Иммунология (Пятое изд.). С. 221–246. ISBN 978-0-7167-6764-0.
- ^ Наир, Дипак; Сингх Кавита; Сиддики Завед; Наяк Бишну; Рао Канури; Салунке Динакар (9 января 2002 г.). «Распознавание эпитопа различными антителами указывает на конформационную конформацию в ответе антител» (PDF). Журнал иммунологии. 168 (5): 2371–2382. Дои:10.4049 / jimmunol.168.5.2371. PMID 11859128. Получено 2008-05-03.
- ^ «Иммунохимические приложения». Технические советы. EMD бионауки. Архивировано из оригинал на 2008-04-11. Получено 2008-05-07.
- ^ Дэвис, Шерил. «Антигены». Курс биологии. Университет Западного Кентукки. Архивировано из оригинал на 2008-03-29. Получено 2008-05-12.
- ^ Кери, Ховард. «Антигены». Курс иммунологии. Университет Калгари. Архивировано из оригинал на 2008-10-05. Получено 2008-05-12.
- ^ Худяков, Юрий; Ховард А. Филдс (2002). Искусственная ДНК: методы и применение. Флорида: CRC Press. п. 227. ISBN 978-0-8493-1426-1.
- ^ а б c Майерс, CD (1991). «Роль процессинга и презентации В-клеточного антигена в гуморальном иммунном ответе» (PDF). Журнал FASEB. 5 (11): 2547–2553. Дои:10.1096 / fasebj.5.11.1907935. PMID 1907935. Получено 2008-06-20.
- ^ а б c d е ж грамм час Голдсби (2007). «Обзор иммунной системы (Глава 1)». Иммунология (Пятое изд.). С. 1–23. ISBN 978-0-7167-6764-0.
- ^ Голдсби (2007). «Процессинг и представление антигена (Глава 8)». Иммунология (Пятое изд.). С. 188–194. ISBN 978-0-7167-6764-0.
- ^ а б Ojcius, DM; Л. Гапин; JM Kanellopoulos; П. Курильский (сентябрь 1994 г.). «Управляется ли процессинг антигена основными молекулами комплекса гистосовместимости?» (PDF). Журнал FASEB. 8 (5): 974–978. Дои:10.1096 / fasebj.8.12.8088463. PMID 8088463. Получено 2008-06-20.
- ^ Голдсби (2007). «Клетки и органы иммунной системы (глава 2)». Иммунология (Пятое изд.). С. 24–56. ISBN 978-0-7167-6764-0.
- ^ а б c d е ж грамм час я j k Голдсби (2007). «Генерация, активация и дифференциация B-клеток (Глава 11)». Иммунология (Пятое изд.). Нью-Йорк. С. 247–275. ISBN 978-0-7167-6764-0.
- ^ Макфи, Стивен; Ганонг, Уильям (2006). Патофизиология болезней: введение в клиническую медицину. Lange Medical Books / McGraw-Hill. п. 39. ISBN 978-0-07-144159-9.
- ^ Чико, Гэри (1995). «Иммунная система: отбор врагом». Без чудес: универсальная теория отбора и вторая дарвиновская революция (Пятое изд.). Массачусетс: MIT Press. стр.39–48. ISBN 978-0-262-03232-2. Получено 2008-05-12.
- ^ Гринер, Марк (14 февраля 2005 г.). «Моноклональным антителам (МАт) исполняется 30 лет». Ученый. 19 (3): 14. Архивировано с оригинал на 31.08.2007. Получено 2008-06-06.
- ^ Считай, Майкл. "Майкл В. Дим". Официальная веб-страница. Университет Райса. Получено 2008-05-08.
- ^ Гранхольм, Норман; Тито Кавалло (1992). «Аутоиммунитет, активация поликлональных В-клеток и инфекция (аннотация)». Волчанка. 1 (2): 63–74. Дои:10.1177/096120339200100203. PMID 1301966.
- ^ Монтес К.Л., Акоста-Родригес Э.В., Мерино М.С., Бермехо Д.А., Gruppi A (2007). «Активация поликлональных В-клеток при инфекциях: чертовщина инфекционных агентов или защитный механизм хозяина? (Аннотация)». Журнал биологии лейкоцитов. 82 (5): 1027–1032. Дои:10.1189 / jlb.0407214. PMID 17615380. Архивировано из оригинал на 2009-04-13. Получено 2008-05-04.
- ^ "Эмиль фон Беринг: основоположник сывороточной терапии". Нобелевская премия по медицине. Архивировано из оригинал на 2008-06-12. Получено 2008-06-23.
- ^ Маг, Роза Дж .; Тен Фейзи. "Эльвин А. Кабат". Биографические воспоминания. Получено 2008-06-23.
- ^ а б c d Гринберг, Стивен. «Краткая история иммунологии» (PDF). Получено 2008-06-23.
- ^ "Новости МТК" (PDF). Каролинский институт. Получено 2008-06-23.
- ^ Тернер, Стивен (октябрь 2007 г.). "ЕДИНАЯ МОЩНАЯ идея" (PDF). Австралазийская наука. Архивировано из оригинал (PDF) на 2008-07-21. Получено 2008-06-23.
дальнейшее чтение
- Голдсби, Ричард; Киндт, TJ; Осборн, BA; Янис Куби (2003). Иммунология (Пятое изд.). Нью-Йорк: В. Х. Фриман и компания. ISBN 978-0-7167-4947-9.
- Кишияма, Джеффри Л. (2006) [1997]. «Расстройства иммунной системы (Глава 3)». В Стивене Дж. Макфи; Уильям Ф. Ганонг (ред.). Патофизиология болезней: введение в клиническую медицину (5-е изд.). Lange Medical Books / McGraw-Hill. С. 32–58. ISBN 978-0-07-110523-1.
- Нэрн, Родерик (2004) [1954]. «Иммунология (Глава 8)». В Гео Ф. Брукс; Джанет С. Бутель; Стивен А. Морс (ред.). Медицинская микробиология Явца, Мельника и Адельберга (Двадцать третье издание, международное изд.). Публикации Ланге / Макгроу-Хилл. С. 133–135, 138–139. ISBN 978-0-07-123983-7.