Диффузный панбронхиолит - Diffuse panbronchiolitis
| Диффузный панбронхиолит | |
|---|---|
 | |
| Компьютерная томография высокого разрешения изображения нижней части грудной клетки 16-летнего мальчика с диффузным панбронхиолитом | |
| Специальность | Пульмонология |
Диффузный панбронхиолит (DPB) является воспалительный заболевание легких по неизвестной причине. Это тяжелая прогрессирующая форма бронхиолит воспалительное состояние бронхиолы (небольшие дыхательные пути в легких). Период, термин размытый означает, что поражения появляются в обоих легких, а панбронхиолит относится к воспалению во всех слоях респираторные бронхиолы (те, кто участвует в газообмен ). DPB вызывает сильное воспаление и узелок -подобные поражения терминальные бронхиолы, хронический синусит, и интенсивный кашель с большим количеством мокрота производство.
Считается, что болезнь возникает, когда есть восприимчивость или отсутствие иммунная система сопротивление, вызывающее DPB бактерии или же вирусы, вызванные несколькими генами, которые встречаются преимущественно у особей Восточная Азия спуск. Самый высокий заболеваемость происходит среди японцы, с последующим корейцы. DPB чаще встречается у мужчин и обычно начинается в возрасте около 40 лет. Это было признано отдельным новым заболеванием в начале 1960-х годов и было официально названо диффузный панбронхиолит в 1969 г.
Если не лечить, DPB прогрессирует до бронхоэктазия, необратимое заболевание легких, которое включает увеличение бронхиол и накопление слизь в бронхиолярных ходах. Ежедневное лечение DPB с макролид антибиотики Такие как эритромицин облегчает симптомы и увеличивает время выживания, но в настоящее время лекарство от этой болезни не известно. Конечный результат DPB может быть нарушение дыхания и проблемы с сердцем.
Классификация
Термин «бронхиолит» обычно относится к воспалению бронхиол.[1] DPB классифицируется как форма «первичного бронхиолита», что означает, что основная причина бронхиолита происходит из бронхиол или ограничена ими.[2][3] К дополнительным формам первичного бронхиолита, помимо ДПБ, относятся: облитерирующий бронхиолит, фолликулярный бронхиолит, респираторный бронхиолит, болезнь дыхательных путей из-за минеральной пыли, и ряд других.[2] В отличие от DPB, бронхиолит, который не считается «первичным», может быть связан с заболеваниями более крупных дыхательных путей, такими как хронический бронхит.[2][3]
Признаки и симптомы
Симптомы DPB включают: хронический синусит (воспаленный околоносовых пазух ), хрипы, треск (дыхательные звуки сделанные препятствиями, такими как мокрота и выделения в легких), одышка (одышка) и сильный кашель с выделением большого количества мокроты (откашливаемая мокрота). Может быть гной в мокроте, и у пораженных людей может подняться температура. Типичные признаки прогрессирования DPB включают: расширение (увеличение) бронхиолярных ходов и гипоксемия (низкий уровень кислорода в крови). Если не лечить DPB, возникнут бронхоэктазы; для него характерно расширение и утолщение стенок бронхиол, воспалительное поражение органов дыхания и терминальные бронхиолы и скопление слизи в легких.[4][5] DPB ассоциируется с прогрессивным нарушение дыхания, гиперкапния (повышенный уровень углекислого газа в крови) и в конечном итоге может привести к легочная гипертония (высокое кровяное давление в легочная артерия и артерия ) и легочное сердце (расширение Правый желудочек сердца, или «правожелудочковая недостаточность»).[6][7]
Причина

DPB - это идиопатический, что означает точное физиологический, относящийся к окружающей среде, или же патогенный причина заболевания неизвестна. Однако предполагается, что несколько факторов связаны с его патогенез (способ действия болезни).[4]
В главный комплекс гистосовместимости (MHC) - большой геномный регион находится в большинстве позвоночные что связано с иммунной системой. Он расположен на хромосома 6 в людях. Подмножество MHC у людей - это человеческий лейкоцитарный антиген (HLA), который контролирует антигенпрезентирующая система, как часть адаптивный иммунитет против патогенов, таких как бактерии и вирусы. Когда человеческие клетки инфицированы патогеном, некоторые из них могут представлять на своей поверхности части белков патогена; это называется «презентацией антигена». Затем инфицированные клетки становятся мишенями для типов цитотоксические Т-клетки, которые убивают инфицированные клетки, чтобы их можно было удалить из организма.[8]
Генетическая предрасположенность к восприимчивости к DPB локализована в двух HLA. гаплотипы (а нуклеотид или разница в последовательности генов между парные хромосомы, что с большей вероятностью встречается среди людей общей этнической принадлежности или черт), общих для людей восточноазиатского происхождения. HLA-B54 ассоциируется с DPB на японском языке, а HLA-A11 связано с заболеванием у корейцев.[9] Несколько генов в этой области HLA класса I считаются ответственными за DPB, повышая восприимчивость к болезни.[7][10] Общий генетический фон и сходство в HLA-профиле затронутых японцев и корейцев были рассмотрены при поиске гена DPB.[10] Было высказано предположение, что мутация гена предполагаемой предрасположенности к заболеванию расположена где-то между HLA-B[11] и HLA-A[12] произошла на наследственной хромосоме, несущей как HLA-B54, так и HLA-A11. Кроме того, возможно, что ряд генетическая рекомбинация события вокруг болезни локус (расположение на хромосоме) могло привести к тому, что болезнь была связана с HLA-B54 у японцев и HLA-A11 у корейцев. После дальнейшего изучения был сделан вывод, что ген восприимчивости к DPB расположен рядом с локусом HLA-B на хромосоме 6p21.3. В этой области продолжаются поиски генетической причины заболевания.[9][10]
Поскольку многие гены, принадлежащие HLA, остаются неидентифицированными, позиционное клонирование (метод, используемый для идентификации конкретного гена, когда известно только его расположение на хромосоме), был использован для определения того, что муциноподобный ген связан с DPB. Кроме того, были исследованы заболевания, вызываемые идентифицированными генами HLA в области чувствительности к DPB. Один из них, синдром голых лимфоцитов I (BLS I), имеет ряд сходств с DPB у пораженных, включая хронический синусит, бронхиолярное воспаление и узелки, а также наличие H. influenzae. Также как и DPB, BLS I благоприятно реагирует на терапию эритромицином, демонстрируя исчезновение симптомов. Сходство между этими двумя заболеваниями, соответствующий успех одного и того же метода лечения и тот факт, что ген, ответственный за BLS I, расположен в области HLA, вызывающей DPB, сужает создание гена, ответственного за DPB.[9] Считается, что факторы окружающей среды, такие как вдыхание токсичных паров и курение сигарет, не играют роли в DPB, и неизвестные экологические и другие негенетические причины, такие как неидентифицированные бактерии или вирусы, не исключены.[4][6][7]
Кистозный фиброз (CF), прогрессирующее мультисистемное заболевание легких, рассматривалось в поисках генетической причины DPB. Это по ряду причин. CF, как и DPB, вызывает тяжелое воспаление легких, обильное выделение слизи, инфекцию и показывает генетическое преобладание среди кавказцев одной географической группы по сравнению с другими; тогда как DPB преобладает среди жителей Восточной Азии, CF в основном поражает лиц европейского происхождения. Хотя ни один ген не считается причиной DPB, мутации в конкретном гене - с гораздо большей вероятностью встречающиеся у европейцев - вызывают МВ. Эта мутация в Ген, вызывающий МВ не фактор DPB, а уникальный полиморфизм (вариация) в этом гене, как известно, встречается у многих азиатов, не обязательно пораженных ни одной из болезней. Сейчас исследуется, может ли этот ген в каком-либо состоянии мутации вносить вклад в DPB.[4][9]
Патофизиология
Воспаление - нормальная часть иммунного ответа человека, в результате чего лейкоциты (лейкоциты), в том числе нейтрофилы (белые кровяные тельца, которые вызывают воспаление), собираются и хемокины (белки, высвобождаемые из определенных клеток, которые активируют или вызывают ответ других клеток) накапливаются в любом месте тела, где возникают бактериальные или вирусные инфекции. Воспаление препятствует деятельности бактерий и вирусов и способствует их выведению из организма. В DPB такие бактерии, как Haemophilus influenzae и Синегнойная палочка может вызвать распространение воспалительных клеток в ткани бронхов. Однако, когда ни одна из бактерий не присутствует в DPB, воспаление продолжается по пока неизвестной причине.[4][5] В любом случае воспаление при DPB может быть настолько серьезным, что в стенках бронхиол образуются узелки, содержащие воспалительные клетки.[4][13] Присутствие воспаления и инфекции в дыхательных путях также приводит к образованию избыточной слизи, которую необходимо откашлять в виде мокроты.[4][6] Сочетание воспаления, образования узелков, инфекции, слизи и частого кашля способствует затрудненному дыханию при DPB.[4][5]
Тот факт, что воспаление в DPB сохраняется при наличии или отсутствии P. aeruginosa и H. influenzae предоставляет средства для определения нескольких механизмов патогенеза DPB.[5] Лейкотриены находятся эйкозаноиды, сигнальные молекулы сделан из незаменимые жирные кислоты, которые играют роль во многих заболеваниях легких, вызывая разрастание воспалительных клеток и избыточное производство слизи в дыхательных путях.[14] При DPB и других заболеваниях легких преобладающим медиатором воспаления, связанного с нейтрофилами, является лейкотриен B4, который специализируется на пролиферации нейтрофилов через хемотаксис (движение некоторых типов клеток к определенным молекулам или от них).[4][9]
Воспаление в DPB также вызвано хемокином. МИП-1альфа и его участие в CD8+ Т-клетки. Бета-дефенсины, семья противомикробный пептиды обнаружены в дыхательных путях, несут ответственность за дальнейшее воспаление в DPB, когда патоген, такой как P. aeruginosa настоящее. Если присутствует с DPB, человеческий Т-лимфотропный вирус, тип I, а ретровирус, изменяет патогенез DPB, заражая Т-хелперные клетки и изменение их эффективности в распознавании присутствия известных или неизвестных патогенов, связанных с DPB.[4][9]
Диагностика

Диагностика DPB требует анализ легких и бронхиолярных тканей, для чего может потребоваться легкое биопсия, или более предпочтительно компьютерная томография высокого разрешения (HRCT) сканирование легких.[7] Диагностические критерии включают тяжелое воспаление во всех слоях респираторных бронхиол и поражения легочной ткани, которые проявляются в виде узелков внутри Терминал и респираторные бронхиолы в обоих легких.[4] Узлы в DPB выглядят как непрозрачный комки при просмотре на Рентгеновские лучи легкого и может вызвать обструкция дыхательных путей, который оценивается легочная функциональная проба, или PFT.[6] Рентген легких также может выявить расширение бронхиолярных проходов, еще один признак ДАД. Сканирование HRCT часто показывает закупорку некоторых бронхиолярных проходов слизью, которую называют "дерево в бутоне" шаблон.[7] Гипоксемия, еще один признак затрудненного дыхания, выявляется путем измерения содержания кислорода и углекислого газа в крови с помощью анализа крови, называемого газ артериальной крови. Другие результаты, наблюдаемые с DPB, включают распространение лимфоциты (белые кровяные клетки борются с инфекцией), нейтрофилы и пенистые гистиоциты (ткань макрофаги ) в легком оболочка. Бактерии, такие как H. influenzae и P. aeruginosa также обнаруживаются, причем последние становятся более заметными по мере прогрессирования заболевания.[4][5] Содержание лейкоцитов, бактерий и других клеток в крови можно измерить с помощью полный анализ крови (CBC). Повышенные уровни IgG и IgA (классы иммуноглобулины ), а также наличие ревматоидный фактор (индикатор аутоиммунитет ). Гемагглютинация, скопление эритроцитов в ответ на присутствие антитела в крови также может возникнуть. Нейтрофилы, бета-дефенсины, лейкотриены и хемокины также могут быть обнаружены в бронхоальвеолярный лаваж Введенная жидкость затем удаляется из бронхиолярных путей пациентов с DPB для оценки.[4][9]
Дифференциальная диагностика
в дифференциальная диагностика (при установлении правильного диагноза между заболеваниями, которые имеют частично совпадающие черты) некоторых обструктивных заболеваний легких, часто рассматривается DPB. Некоторые симптомы DPB напоминают симптомы других обструктивных заболеваний легких, таких как: астма, хронический бронхит, и эмфизема. Хрипы кашель с мокрота продуктивность и одышка являются обычными симптомами таких заболеваний, а обструктивное респираторное функциональное нарушение обнаруживается на исследование функции легких.[6] Муковисцидоз, как и ДПБ, вызывает тяжелое воспаление легких, избыточное производство слизи и инфекцию; но DPB не вызывает нарушений поджелудочной железы или электролиты, как и МВ, поэтому эти два заболевания разные и, вероятно, не связаны.[4][9] DPB отличается наличием поражений, которые на рентгеновских снимках проявляются в виде узелков в бронхиолах обоих легких; воспаление во всех ткань слои респираторных бронхиол; и его более высокая распространенность среди лиц восточноазиатского происхождения.[4]
DPB и облитерирующий бронхиолит две формы первичного бронхиолита.[2] Характерные особенности обоих заболеваний включают сильный кашель с большим количеством мокроты, часто заполненной гноем; узелки, видимые на рентгенограммах легких, в нижних бронхах и бронхиолярной области; и хронический синусит. При DPB узелки в большей степени ограничены респираторными бронхиолами, тогда как при OB они часто обнаруживаются в перепончатых бронхиолах (начальный нехрящевой участок бронхиолы, который отделяется от третичный бронх ) вверх к вторичный бронх. OB - это бронхиолярное заболевание, распространенное во всем мире, тогда как DPB имеет более локализованное распространение, преимущественно в Японии.[2][6] До клинического признания DPB в последние годы его часто ошибочно диагностировали как бронхоэктазия, ХОБЛ, IPF, туберкулезный туберкулез, саркоидоз или же альвеолярно-клеточная карцинома.[15]
Уход
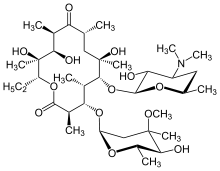
Макролид антибиотики, такие как эритромицин, являются эффективным средством лечения DPB при регулярном приеме в течение длительного периода времени.[16][17][18] Кларитромицин или же рокситромицин также широко используются.[19] Успешные результаты применения макролидов при DPB и подобных заболеваниях легких связаны с устранением определенных симптомов с помощью иммуномодуляция (регулировка иммунного ответа),[17] чего можно достичь, принимая антибиотики в низком дозы. Лечение заключается в ежедневном пероральном приеме эритромицина.[7] в течение двух-трех лет, продолжительный период, который, как было показано, значительно улучшает эффекты DPB. Это очевидно, когда у человека, проходящего курс лечения ДПБ, среди ряда критериев ремиссии, связанных с заболеванием, обнаружено нормальное количество нейтрофилов в ЖБАЛ, и газ крови (ан артериальный анализ крови измеряет количество кислорода и углекислого газа в крови) показания показывают, что свободный кислород в крови находится в пределах нормы.[16][17][20] В этих случаях было предложено сделать временный перерыв в терапии эритромицином, чтобы уменьшить образование устойчивых к макролидам P. aeruginosa.[16] Однако симптомы DPB обычно возвращаются, и лечение необходимо возобновить. Несмотря на свою высокую эффективность, эритромицин может оказаться неэффективным у всех людей с этим заболеванием, особенно если он устойчив к макролидам. P. aeruginosa присутствует или ранее не леченный DPB прогрессировал до точки, где возникает дыхательная недостаточность.[17][20]
При терапии эритромицином в DPB значительное уменьшение воспаления и повреждения бронхиол достигается за счет подавления не только нейтрофил пролиферация, но также активность лимфоцитов и обструктивная слизь и вода выделения в дыхательных путях.[16] Антибиотические эффекты макролидов не влияют на их положительное влияние на уменьшение воспаления при DPB.[20] Это очевидно, потому что лечебная доза слишком мала для борьбы с инфекцией, а в случаях DPB с возникновением макролидорезистентных P. aeruginosa, терапия эритромицином по-прежнему уменьшает воспаление.[16]
Ряд факторов участвует в подавлении воспаления эритромицином и другими макролидами. Они особенно эффективны при подавлении пролиферации нейтрофилов, уменьшая способность интерлейкин 8 и лейкотриен B4 чтобы привлечь их.[21] Макролиды также снижают эффективность молекулы адгезии которые позволяют нейтрофилам прилипать к тканям бронхиол. Производство слизи в дыхательных путях является основной причиной заболеваемости и смертности от DPB и других респираторных заболеваний. Значительное уменьшение воспаления в DPB, связанное с терапией эритромицином, также помогает подавить выработку избыточной слизи.[21]
Прогноз
Отсутствие лечения DPB приводит к бронхоэктатической болезни, дыхательной недостаточности и смерти. В журнальном отчете за 1983 г. указано, что у нелеченых DPB пятилетняя выживаемость составляла 62,1%, а 10-летняя выживаемость составляла 33,2%.[6] Благодаря лечению эритромицином люди с DPB теперь имеют гораздо более длительную продолжительность жизни благодаря лучшему лечению симптомов, замедлению прогрессирования и предотвращению сопутствующих инфекций, таких как P. aeruginosa.[20] 10-летняя выживаемость при лечении DPB составляет около 90%.[4] В случаях DPB, когда лечение привело к значительному улучшению, что иногда происходит примерно через два года, лечение было разрешено прекратить на некоторое время. Однако за лицами, которым разрешено прекратить лечение в это время, ведется тщательное наблюдение. Поскольку доказано, что DPB рецидивирует, терапию эритромицином следует немедленно возобновить, как только симптомы заболевания начнут появляться снова. Несмотря на улучшение прогноза при лечении, DPB в настоящее время не имеет известного лечения.[4][9]
Эпидемиология
DPB имеет высшую распространенность среди японцев - 11 на 100 000 населения.[4] Корейский,[22] Китайский,[23] и тайский[24] также сообщалось о людях с этим заболеванием. Предполагается генетическая предрасположенность жителей Восточной Азии.[9] Заболевание чаще встречается у мужчин,[25] при соотношении мужчин и женщин 1,4–2: 1 (или примерно 5 мужчин на 3 женщины).[4] Среднее начало заболевания составляет около 40 лет, и две трети заболевших - некурящие, хотя курение не считается причиной.[7] Присутствие HLA-Bw54 увеличивает риск диффузного панбронхиолита в 13,3 раза.[26]
В Европе и Америке относительно небольшое количество случаев DPB было зарегистрировано у иммигрантов и жителей Азии, а также у лиц неазиатского происхождения.[27][28][29] Ошибочный диагноз имел место на Западе из-за меньшего признания болезни, чем в странах Азии. По сравнению с большим количеством азиатов, живущих на западе, небольшое количество из них, которое, как считается, затронуто DPB, предполагает, что негенетические факторы могут играть некоторую роль в его причине. Эта редкость, наблюдаемая у жителей Западной Азии, также может быть частично связана с неправильным диагнозом.[7][30]
История
В начале 1960-х годов врачи Японии наблюдали и описывали относительно новое хроническое заболевание легких. В 1969 г.[31] название «диффузный панбронхиолит» было введено, чтобы отличить его от хронического бронхита, эмфиземы, альвеолит, и другие обструктивные заболевания легких с воспалением. В период с 1978 по 1980 год результаты общенационального исследования, инициированного Министерством здравоохранения и социального обеспечения Японии, выявили более 1000 возможных случаев DPB, 82 из которых были подтверждены гистологически. К 1980-м годам это было признано во всем мире как отдельное заболевание легких.[4][6]
До 1980-х годов прогноз или ожидаемый исход DPB был плохим, особенно в случаях с суперинфекция (появление новой вирусной или бактериальной инфекции в дополнение к уже имеющейся инфекции) P. aeruginosa.[13] DPB продолжал иметь очень высокий уровень смертности до общего лечения антибиотиками и кислородная терапия начали регулярно использоваться для лечения симптомов. Примерно в 1985 году, когда длительное лечение антибиотиком эритромицином стало стандартом для лечения DPB, прогноз значительно улучшился.[20] В 1990 году первоначально было заявлено о связи DPB с HLA.[9]
Рекомендации
- ^ Visscher DW, Myers JL (2006). «Бронхиолит: взгляд патологоанатома» (Бесплатный полный текст). Труды Американского торакального общества. 3 (1): 41–7. Дои:10.1513 / pats.200512-124JH. PMID 16493150.
- ^ а б c d е Рю Дж. Х., Майерс Дж. Л., Свенсен С. Дж. (Декабрь 2003 г.). «Бронхиолярные расстройства» (Бесплатный полный текст). Американский журнал респираторной медицины и реанимации. 168 (11): 1277–92. Дои:10.1164 / rccm.200301-053SO. PMID 14644923.
- ^ а б Рю Дж. Х. (март 2006 г.). «Классификация и подход к бронхиолярным заболеваниям». Текущее мнение в области легочной медицины. 12 (2): 145–51. Дои:10.1097 / 01.mcp.0000208455.80725.2a. PMID 16456385. S2CID 23668839.
- ^ а б c d е ж грамм час я j k л м п о п q р s т Полетти В., Касони Г., Чилози М., Зомпатори М. (октябрь 2006 г.). «Диффузный панбронхиолит». Европейский респираторный журнал. 28 (4): 862–71. Дои:10.1183/09031936.06.00131805. PMID 17012632.
- ^ а б c d е Янагихара К., Кадото Дж., Коно С. (2001). «Диффузный панбронхиолит - патофизиология и механизмы лечения». Международный журнал противомикробных агентов. 18 Дополнение 1: S83-7. Дои:10.1016 / s0924-8579 (01) 00403-4. PMID 11574201.
- ^ а б c d е ж грамм час Хомма Х, Яманака А., Танимото С., Тамура М., Чидзимацу Й., Кира С., Изуми Т. (январь 1983 г.). «Диффузный панбронхиолит. Заболевание переходной зоны легкого». Грудь. 83 (1): 63–9. Дои:10.1378 / сундук.83.1.63. PMID 6848335.
- ^ а б c d е ж грамм час Энтони М., Сингхэм С., Соанс Б., Тайлер Г. (октябрь 2009 г.). «Диффузный панбронхиолит: не только азиатское заболевание: серия случаев в Австралии и обзор литературы». Журнал биомедицинской визуализации и вмешательства. 5 (4): e19. Дои:10.2349 / biij.5.4.e19. ЧВК 3097723. PMID 21610988.
- ^ Моррис А.Г., Хьюитт С., Янг С. (1994). Главный комплекс гистосовместимости: его гены и их роль в презентации антигена. 15. Пергамон.
- ^ а б c d е ж грамм час я j k Кэйчо Н., Хидзиката М. (май 2011 г.). «Генетическая предрасположенность к диффузному панбронхиолиту». Респирология. 16 (4): 581–8. Дои:10.1111 / j.1440-1843.2011.01946.x. PMID 21303426.
- ^ а б c Онлайн-менделевское наследование в человеке (OMIM): Панбронхиолит диффузный - 604809 Проверено 11 ноября 2011 года.
- ^ Онлайн-менделевское наследование в человеке (OMIM): Человеческий лейкоцитарный антиген B - 142830 Проверено 21 сентября 2011 года.
- ^ Онлайн-менделевское наследование в человеке (OMIM): Человеческий лейкоцитарный антиген А - 142800 Проверено 21 сентября 2011 года.
- ^ а б Адзума А., Кудо С. (май 2006 г.). «Диффузный панбронхиолит в Восточной Азии». Респирология. 11 (3): 249–61. Дои:10.1111 / j.1440-1843.2006.00845.x. PMID 16635082.
- ^ Busse WW (июнь 1998 г.). «Лейкотриены и воспаление» (Бесплатный полный текст). Американский журнал респираторной медицины и реанимации. 157 (6, п. 1): S210-3. Дои:10.1164 / ajrccm.157.6.mar-1. PMID 9620941.
- ^ Ли Х, Чжоу Й, Фань Ф, Чжан И, Ли Х, Ю Х и др. (Август 2011 г.). «Влияние азитромицина на пациентов с диффузным панбронхиолитом: ретроспективное исследование 51 случая». Медицина внутренних органов. 50 (16): 1663–9. Дои:10.2169 / internalmedicine.50.4727. PMID 21841323.
- ^ а б c d е Канох С., Рубин Б.К. (июль 2010 г.). «Механизмы действия и клиническое применение макролидов в качестве иммуномодулирующих препаратов». Обзоры клинической микробиологии (Бесплатный полный текст). 23 (3): 590–615. Дои:10.1128 / CMR.00078-09. ЧВК 2901655. PMID 20610825.
- ^ а б c d Лопес-Боадо Ю.С., Рубин Б.К. (июнь 2008 г.). «Макролиды как иммуномодулирующие препараты для терапии хронических заболеваний легких». Текущее мнение в фармакологии. 8 (3): 286–91. Дои:10.1016 / j.coph.2008.01.010. PMID 18339582.
- ^ Линь X, Лу Дж, Ян М., Донг Б.Р., У Х.М. (январь 2015 г.). «Макролиды при диффузном панбронхиолите». Кокрановская база данных систематических обзоров. 1 (1): CD007716. Дои:10.1002 / 14651858.CD007716.pub4. ЧВК 6464977. PMID 25618845.
- ^ Кэйчо Н., Кудох С. (2002). «Диффузный панбронхиолит: роль макролидов в терапии». Американский журнал респираторной медицины. 1 (2): 119–31. Дои:10.1007 / BF03256601. PMID 14720066. S2CID 39880028.
- ^ а б c d е Шульц MJ (июль 2004 г.). «Активность макролидов, выходящая за рамки их антимикробного эффекта: макролиды при диффузном панбронхиолите и муковисцидозе» (Бесплатный полный текст). Журнал антимикробной химиотерапии. 54 (1): 21–8. Дои:10.1093 / jac / dkh309. PMID 15190022.
- ^ а б Тамаоки Дж., Кадота Дж., Такидзава Х. (ноябрь 2004 г.). «Клинические последствия иммуномодулирующего действия макролидов». Американский журнал медицины. 117 Приложение 9A (9): 5S – 11S. Дои:10.1016 / j.amjmed.2004.07.023. PMID 15586558.
- ^ Ким Ю.В., Хан С.К., Шим Ю.С., Ким К.Й., Хан Ю.С., Со Дж.В., Им Дж.Г. (май 1992 г.). «Первое сообщение о диффузном панбронхиолите в Корее: пять клинических случаев». Медицина внутренних органов. 31 (5): 695–701. Дои:10.2169 / internalmedicine.31.695. PMID 1504438.
- ^ Чен Й, Кан Дж, Ли С. (январь 2005 г.). «Диффузный панбронхиолит в Китае». Респирология. 10 (1): 70–5. Дои:10.1111 / j.1440-1843.2005.00622.x. PMID 15691241.
- ^ Чантароторн С., Палватвичай А., Ваттанатхум А., Тантамачарик Д. (август 1999 г.). «Диффузный панбронхиолит, первый случай заболевания в Таиланде». Журнал Медицинской ассоциации Таиланда = Chotmaihet Thangphaet. 82 (8): 833–8. PMID 10511794.
- ^ Høiby N (июнь 1994 г.). «Диффузный панбронхиолит и муковисцидоз: Восток встречается с Западом». Грудная клетка. 49 (6): 531–2. Дои:10.1136 / thx.49.6.531. ЧВК 474936. PMID 8016786.
- ^ Лазарь SC (2005). Учебник респираторной медицины Мюррея и Наделя (4-е изд.). У. Б. Сондерс. п.1300. ISBN 978-0-7216-0327-8.
- ^ Фитцджеральд Дж. Э., Кинг Т. Е., Линч Д. А., Тудер Р. М., Шварц М. И. (август 1996 г.). «Диффузный панбронхиолит в США». Американский журнал респираторной медицины и реанимации. 154 (2 Pt 1): 497–503. Дои:10.1164 / ajrccm.154.2.8756828. PMID 8756828.
- ^ Мартинес Дж. А., Гимарайнш С. М., Феррейра Р. Г., Перейра, Калифорния (март 2000 г.). «Диффузный панбронхиолит в Латинской Америке». Американский журнал медицинских наук. 319 (3): 183–5. Дои:10.1097/00000441-200003000-00008. PMID 10746829.
- ^ Сандрини А., Балтер М.С., Чепмен К.Р. (2003). «Диффузный панбронхиолит у мужчины европеоидной расы в Канаде». Канадский респираторный журнал. 10 (8): 449–51. Дои:10.1155/2003/786531. PMID 14679410.
- ^ Брюгьер О., Миллерон Б., Антуан М., Каретт М.Ф., Филипп С., Майо С. (октябрь 1996 г.). «Диффузный панбронхиолит у азиатского иммигранта». Грудная клетка. 51 (10): 1065–7. Дои:10.1136 / thx.51.10.1065. ЧВК 472677. PMID 8977613.
- ^ Яманака А., Сайки С., Тамура С., Сайто К. (март 1969 г.). «[Проблемы при хронических обструктивных заболеваниях бронхов, с особым акцентом на диффузный панбронхиолит]». Найка. Медицина внутренних органов (на японском языке). 23 (3): 442–51. PMID 5783341.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
