Аминокислотные комплексы переходных металлов - Transition metal amino acid complexes - Wikipedia
Аминокислотные комплексы переходных металлов большая семья координационные комплексы содержащие сопряженные основания аминокислоты, 2-аминокарбоксилаты. Аминокислоты преобладают в природе, и все они действуют как лиганды по отношению к переходным металлам.[1] В эту статью не включены комплексы амидов (включая пептиды) и сложноэфирных производных аминокислот. Также исключены полиаминокислоты, включая хелатирующие агенты EDTA и NTA.
Режимы привязки
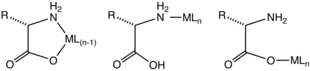
Чаще всего аминокислоты координируются с ионами металлов в виде бидентатных лигандов N, O с использованием аминогруппы и карбоксилата. Это лиганды L-X. Образуется пятичленное хелатное кольцо. Хелатное кольцо только слегка взъерошено на sp.3-гибридизированные углеродные и азотные центры.
Для тех аминокислот, которые содержат координирующие заместители, образующиеся комплексы более структурно разнообразны, поскольку эти заместители могут координироваться. Гистидин, аспарагиновая кислота, метионин, и цистеин иногда образуют тридентатные комплексы N, N, O, N, O, O, S, N, O и S, N, O соответственно.
С помощью кинетически инертных ионов металлов охарактеризованы комплексы, содержащие монодентатные аминокислоты. Эти комплексы существуют либо в изомерах связи N, либо в O-связях. Можно предположить, что такие монодентатные комплексы временно существуют для многих кинетически лабильных ионов металлов (например, Zn2+).
Стехиометрия и структура
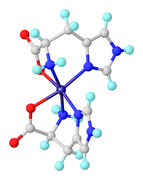
- Строение избранных комплексов аминокислот.
Гомолептические комплексы (только аминокислотные лиганды)
Смешивание простых солей металлов с растворами аминокислот, близких к нейтральным или повышенным pH, часто дает бис- или трис-комплексы. Для ионов металлов, предпочитающих октаэдрическую координацию, эти комплексы часто принимают стехиометрию M (aa)3 (aa = аминокарбоксилат, такой как глицинат, H2NCH2CO2−).
Комплексы стехиометрии 3: 1 имеют формулу [M (O2CC (R) HNH2)3]z. Такие комплексы принимают октаэдрическая координационная геометрия. Эти комплексы могут существовать в виде фациальных и меридиональных изомеров, оба из которых являются хиральными. Стереохимические возможности увеличиваются, когда аминокислотные лиганды не гомохиральный.
Комплексы со стехиометрией 2: 1 иллюстрируются глицинат меди (II) [Cu (O2CC (R) HNH2)2], который существует как в безводной, так и в пятикоординированной геометрии. Когда металл имеет плоскую квадратную форму, эти комплексы могут существовать в виде цис- и транс-изомеров. Стереохимические возможности увеличиваются, когда аминокислотные лиганды не гомохиральный.
Также известны гомолептические комплексы, в которых аминокарбоксилат представляет собой тридентатные аминокислоты. Одним из таких комплексов является Ni (κ3-гистидинат)2.
Гетеролептические комплексы (аминокислоты плюс другие лиганды)
Для аминокислот характерны смешанные лигандные комплексы. Хорошо известные примеры включают [Co (en)2(глицинат)]2+, где en (этилендиамин ) - зрительский лиганд. В области металлоорганических комплексов один пример Cp * Ir (κ3-метионин).
Рекомендации
- ^ Северин, К .; Bergs, R .; Бек, В. (1998). «Биоорганические химические комплексы переходных металлов с α-аминокислотами и пептидами». Энгью. Chem. Int. Эд. 37: 1635–1654. Дои:10.1002 / (SICI) 1521-3773 (19980703) 37:12 <1634 :: AID-ANIE1634> 3.0.CO; 2-C.CS1 maint: использует параметр авторов (связь)
- ^ К.-К. Гу, Ю.-Х. Сунь, Р. Чжан, Н.-В. Чжан, Х.-В. Че (2007). "Трис (глицинато-κ2N, O) кобальт (III) ». Acta Crystallogr. E63: m740 – m742. Дои:10.1107 / S1600536807005636.CS1 maint: использует параметр авторов (связь)
- ^ А. Аббаси, Б. Сафаркопайе, Н. Хосрави, А. Шайестех (217). «Структурные исследования бис (гистидинато) никеля (II): комбинированные экспериментальные и вычислительные исследования». Comptes Rendus Chimie. 20: 467. Дои:10.1016 / j.crci.2016.12.006.CS1 maint: несколько имен: список авторов (связь)
- ^ М. Шарвиц, Т. ван Алмсик, В. С. Шелдрик (2007). "(S-метилцистеинато) (η5-пентаметилциклопентадиенил) иридий (III) полугидрат трифторметансульфоната ». Acta Crystallogr. E63: m230-m232. Дои:10.1107 / S1600536806053360.CS1 maint: несколько имен: список авторов (связь)
- ^ Baidya, N .; Ndreu, D .; Olmstead, M. M .; Машарак, П. К. (1991). «Синтез, структура и свойства полуторного гидрата бис (L-цистеинато-N, S) никелата (II) калия». Неорганическая химия. 30: 2448–2451. Дои:10.1021 / ic00010a043.CS1 maint: несколько имен: список авторов (связь)