Т-образная молекулярная геометрия - T-shaped molecular geometry - Wikipedia
| Т-образная молекулярная геометрия | |
|---|---|
 | |
| Примеры | ClF3 |
| Группа точек | C2v |
| Координационный номер | 3 |
| Угол крепления | 90°, 180° |
| μ (полярность) | >0 |

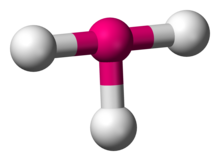
В химии, Т-образная молекулярная геометрия описывает структуры некоторых молекул, в которых центральный атом имеет три лиганды. Обычно трехкоординированные соединения принимают тригонально плоский или же пирамидальный геометрии. Примерами Т-образных молекул являются трифториды галогенов, такие как ClF3.[1]
В соответствии с Теория VSEPR, Т-образная геометрия получается, когда три лиганда и две неподеленные пары электронов связаны с центральным атомом, что записано в Обозначение AX как AX3E2. Т-образная геометрия связана с тригонально-бипирамидная молекулярная геометрия для AX5 молекулы с тремя экваториальными и двумя аксиальными лигандами. В ТОПОР3E2 молекулы, две неподеленные пары занимают две экваториальные позиции, а три атома лиганда занимают две аксиальные позиции, а также одну экваториальную позицию. Три атома связаны под углами 90 ° на одной стороне центрального атома, образуя Т-образную форму.[2]
Трифтороксенат (II) анион, XeF−
3, был исследован как возможный первый пример AX3E3 молекулы, которая, как можно было бы ожидать, рассуждая о VSEPR, будет иметь шесть электронных пар в восьмигранный расположение как с тремя неподеленными парами, так и с тремя лигандами в мер или Т-образной ориентации.[3] Хотя этот анион был обнаружен в газовой фазе, попытки синтеза в растворе и экспериментального определения структуры были безуспешными. А вычислительная химия исследование показало искаженную плоскую Y-образную геометрию с наименьшим валентным углом F – Xe – F, равным 69 °, а не 90 °, как в T-образной геометрии.[3]
Смотрите также
Рекомендации
- ^ Greenwood, N. N .; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 978-0-7506-3365-9.
- ^ Housecroft, C.E .; Шарп, А. Г. (2004). Неорганическая химия (2-е изд.). Прентис Холл. п. 47. ISBN 978-0-13-039913-7.
- ^ а б Васдев, Нил; Моран, Мэтью Д.; Tuononen, Heikki M .; Чиракал, Раман; Suontamo, Reijo J .; Bain, Alex D .; Шробильген, Гэри Дж. (2010). "ЯМР-спектроскопические доказательства промежуточности XeF−
3 в XeF2/ F− Обмен, попытки синтеза и термохимия XeF−
3 Соли и теоретические исследования XeF−
3 Анион". Неорг. Chem. 49 (19): 8997–9004. Дои:10.1021 / ic101275m. PMID 20799721.
