Квадратная плоская молекулярная геометрия - Square planar molecular geometry
| Квадратная плоская молекулярная геометрия | |
|---|---|
 | |
| Примеры | XeF4, PtCl2− 4 |
| Группа точек | D4ч |
| Координационный номер | 4 |
| Угол крепления | 90° |
| μ (полярность) | 0 |

В квадратный плоский молекулярная геометрия в химия описывает стереохимию (пространственное расположение атомов), принятую некоторыми химические соединения. Как следует из названия, атомы молекул этой геометрии расположены в углах квадрата в одной плоскости вокруг центрального атома.
Примеры
Многие соединения принимают эту геометрию, особенно много примеров для комплексов переходных металлов. Соединение благородных газов XeF4 принимает эту структуру, как предсказано Теория VSEPR. Геометрия преобладает для комплексов переходных металлов с d8 конфигурация, которая включает Rh (I), Ir (I), Pd (II), Pt (II) и Au (III). Известные примеры включают противораковые препараты. цисплатин [PtCl2(NH3)2] и карбоплатин. Многие гомогенные катализаторы в состоянии покоя имеют плоско-квадратную форму, например Катализатор Уилкинсона и Катализатор Крэбтри. Другие примеры включают Васьковский комплекс и Соль Цейзе. Определенные лиганды (например, порфирины ) стабилизируют эту геометрию.
Расщепление энергии d-орбиталей в плоских квадратных комплексах переходных металлов
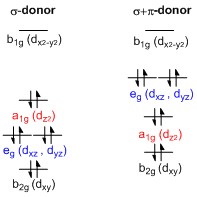
Генерал d-орбитальный диаграмма расщепления для плоского квадрата (D4ч) комплексы переходных металлов могут быть получены из общих октаэдрический (Oчас) диаграмма расщепления, в котором dz2 и dИкс2−y2 орбитали вырождены и имеют более высокую энергию, чем вырожденный набор dху, dxz и гyz орбитали. Когда два аксиальных лиганда удаляются для создания плоской квадратной геометрии, dz2 орбиталь управляется меньшей энергией, поскольку электрон-электронное отталкивание с лигандами на оси z больше не присутствует. Однако для чисто σ-донорных лигандов dz2 орбиталь по-прежнему выше по энергии, чем dху, dxz и гyz орбитали из-за тор образный лепесток dz2 орбитальный. Он несет электронную плотность на осях x и y и, следовательно, взаимодействует с заполненными орбиталями лиганда. Dху, dxz и гyz орбитали обычно представляются вырожденными, но они должны расщепляться на два разных энергетических уровня по отношению к неприводимые представления из точечная группа D4ч. Их относительный порядок зависит от характера конкретного комплекса. Кроме того, расщепление d-орбиталей нарушается π-донорными лигандами в отличие от октаэдрические комплексы. В плоско-квадратном случае сильно π-донорные лиганды могут вызывать dxz и гyz орбитали быть выше по энергии, чем dz2 орбиталь, тогда как в октаэдрическом случае π-донорные лиганды влияют только на величину d-орбитального расщепления, и относительное упорядочение орбиталей сохраняется.[1]
Смотрите также
использованная литература
- ^ Бёргель, Йонас; Кэмпбелл, Майкл Дж .; Риттер, Тобиас (12 января 2016 г.). "Диаграммы d-орбитального расщепления переходных металлов: обновленный образовательный ресурс для квадратных плоских комплексов переходных металлов". Журнал химического образования. 93 (1): 118–121. Bibcode:2016JChEd..93..118B. Дои:10.1021 / acs.jchemed.5b00542. ISSN 0021-9584.
внешние ссылки
- 3D Chem - Химия, структуры и трехмерные молекулы
- IUMSC - Центр молекулярной структуры Университета Индианы
- Интерактивные молекулярные примеры для точечных групп
- [1] - Координационные числа и комплексные ионы
