Додекаэдрическая молекулярная геометрия - Dodecahedral molecular geometry
| Додекаэдрическая молекулярная геометрия | |
|---|---|
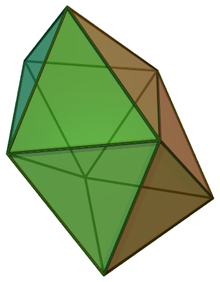 | |
| Примеры | Пн (CN)4− 8 |
| Группа точек | D2d |
| Координационный номер | 8 |
| μ (полярность) | 0 |
В химия, то додекаэдрическая молекулярная геометрия описывает форму соединений, в которых восемь атомов или групп атомов или лигандов расположены вокруг центрального атома, определяющего вершины курносый дисфеноид (также известный как тригональный додекаэдр). Эта форма имеет D2d симметрия и является одной из трех распространенных форм октакоординированных комплексов переходных металлов, наряду с квадратная антипризма и двуугольная тригональная призма.[1][2]
Одним из примеров додекаэдрической молекулярной геометрии является Пн (CN)4−
8 ион.[2]
использованная литература
- ^ Джереми К. Бёрдетт; Роальд Хоффманн; Роберт С. Фэй (1978). «Восьмерка-координация». Неорганическая химия. 17 (9): 2553–2568. Дои:10.1021 / ic50187a041.
- ^ а б Уэллс А.Ф. (1984) Структурная неорганическая химия 5-е издание Oxford Science Publications ISBN 0-19-855370-6
| Эта химия -связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |
