Изогнутая молекулярная геометрия - Bent molecular geometry
| Изогнутая молекулярная геометрия | |
|---|---|
 | |
| Примеры | ЧАС2О, ТАК2 |
| Группа точек | C2v |
| Координационный номер | 2 |
| Угол крепления | 90 ° <θ <120 ° |
| μ (полярность) | >0 |

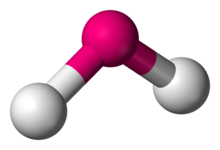
В химия, молекулы с неколлинеарным расположением двух смежных связей имеют изогнутая молекулярная геометрия. Определенные атомы, такие как кислород, почти всегда устанавливают свои два (или более) ковалентные связи в неколлинеарных направлениях из-за их электронная конфигурация. Вода (ЧАС2O) - пример изогнутой молекулы, а также его аналоги. Угол связи между двумя атомами водорода составляет приблизительно 104,45 °.[1] Нелинейная геометрия обычно наблюдается для других трехатомных молекул и ионов, содержащих только основные элементы группы, яркими примерами являются диоксид азота (НЕТ2), дихлорид серы (SCl2), и метилен (CH2).
Эта геометрия почти всегда соответствует Теория VSEPR, что обычно объясняет не-коллинеарность атомов с наличием одинокие пары. Существует несколько вариантов гибки, из которых наиболее распространен AX2E2 где две ковалентные связи и две неподеленные пары центрального атома (A) образуют полная 8-электронная оболочка. Они имеют центральные углы от 104 ° до 109,5 °, что согласуется с упрощенной теорией, которая предсказывает четырехгранный симметрия четырех sp3 гибридизированные орбитали. Наиболее распространенные фактические углы составляют 105 °, 107 ° и 109 °: они меняются из-за различных свойств периферийных атомов (X).
Другие случаи также испытывают орбитальная гибридизация, но в разной степени. ТОПОР2E1 молекулы, такие как SnCl2, имеют только одну неподеленную пару и центральный угол около 120 ° (центр и две вершины равносторонний треугольник ). У них три зр2 орбитали. Существуют также sd-гибридизированные AX2 соединения переходные металлы без одиночных пар: они имеют центральный угол около 90° и также классифицируются как гнутые.
Смотрите также
Рекомендации
- ^ Miessler, G.L .; Тарр, Д. А. (2004). Неорганическая химия (3-е изд.). Пирсон / Прентис Холл. ISBN 0-13-035471-6.
