Пятикратная связь - Quintuple bond

А пятикратная облигация в химия необычный тип химическая связь, впервые было сообщено в 2005 году для дихром соединение. Одинарные облигации, двойные связи, и тройные облигации обычное дело в химии. Четверные облигации встречаются реже, но в настоящее время известны только среди переходных металлов, особенно для Cr, Пн, W, и Re, например [Пн2Cl8]4− и [Re2Cl8]2−. В пятикратной связи десять электронов участвуют в связывании двух металлических центров, обозначенных как σ2π4δ4.
В некоторых случаях связей высокого порядка между атомами металлов связь металл-металл облегчается лигандами, которые связывают два металлических центра и уменьшают межатомное расстояние. Напротив, димер хрома с пятикратной связью стабилизирован объемным терфенил (2,6 - [(2,6-диизопропил) фенил] фенил) лиганды. Устойчив до 200 ° C.[1][2] Пятеричная связь хром – хром исследована с множественными ссылками. ab initio и DFT методы,[3] которые также использовались для выяснения роли терфенильного лиганда, в котором было показано, что фланкирующие арилы очень слабо взаимодействуют с атомами хрома, вызывая лишь небольшое ослабление пятимерной связи.[4] Теоретическое исследование 2007 года выявило два глобальных минимума для пятикомпонентно связанных соединений RMMR: транс-согнутый молекулярная геометрия и на удивление еще один трансгеометрия изгиба с заместителем R в мостиковом положении.[5]
В 2005 г. постулировалось существование пятикратной облигации в гипотетическом уран молекула U2 на основе вычислительная химия.[6][7] Соединения диурана редки, но существуют; например, U
2Cl2−
8 анион.
В 2007 году сообщалось, что самая короткая связь металл-металл (180,28 пм) существует также в соединении, содержащем пятерную хром-хромовую связь с диазадиеновыми мостиковыми лигандами.[8] Другие комплексы металл-металл, содержащие пятерку связей, о которых сообщалось, включают пятикратно связанный дихром с мостиковыми лигандами [6- (2,4,6-триизопропилфенил) пиридин-2-ил] (2,4,6-триметилфенил) амин[9] и комплекс дихрома с амидинат мостиковые лиганды.[10]
Синтез пятикратных связей обычно достигается за счет восстановления диметаллических частиц с использованием графит калия. Это добавляет валентные электроны к металлическим центрам, давая им необходимое количество электронов для участия в пятикратной связи. Ниже приведен рисунок типичного синтеза с пятью связями.
 Синтез пятикратной связи Cr – Cr
Синтез пятикратной связи Cr – Cr
Пятикратные связи димолибдена
В 2009 г. соединение димолибдена с пятеркой связью и двумя дифракционнымиамидо Сообщалось о мостиковых лигандах с длиной связи Mo – Mo 202 пм.[11] Соединение синтезировано, начиная с октахлордимолибдат калия (который уже содержит Mo2 четверная связь) и амидинат лития с последующим восстановлением графитом калия:
 синтез пятикратной связи димолибдена
синтез пятикратной связи димолибдена
Склеивание
Как указано выше, пятимерные связи металл-металл имеют σ2π4δ4 конфигурация. Среди пяти связей, имеющихся между металлическими центрами, одна является сигма-облигация, двое пи-облигации, и два дельта-облигации. Σ-связь является результатом смешения dz2 орбиталь на каждом металлическом центре. Первая π-связь возникает в результате смешения dyz орбитали от каждого металла, в то время как другая π-связь происходит от dxz орбитали при каждом перемешивании металлов. Наконец, δ-связи возникают в результате смешения dху орбитали, а также смешивание между dИкс2−у2 орбитали из каждого металла.
Расчеты молекулярных орбиталей выяснили относительные энергии орбиталей, создаваемых этими связывающими взаимодействиями. Как показано на рисунке ниже, орбитали с наименьшей энергией - это связывающие π-орбитали, за которыми следует σ-связывающая орбиталь. Следующими по величине являются δ-связывающие орбитали, которые представляют собой HOMO. Поскольку 10 валентных электронов металлов используются для заполнения этих первых 5 орбиталей, следующая по высоте орбиталь становится следующей. LUMO что является δ * разрушение орбитальный. Хотя орбитали π и δ представлены как выродиться на самом деле это не так. Это связано с тем, что модель, показанная здесь, является упрощением, и предполагается, что происходит гибридизация s, p и d орбиталей, вызывающая изменение уровней орбитальной энергии.[ цитирование ]
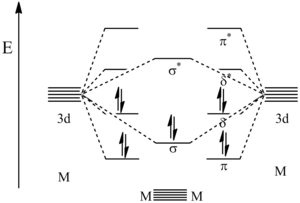 Диаграмма МО пятерочной связи металл – металл
Диаграмма МО пятерочной связи металл – металл
Роль лиганда в пятикратной длине связи металл – металл
Пятикратная длина связи сильно зависит от лигандов, связанных с металлическими центрами. Практически все комплексы, содержащие пятерную связь металл – металл, имеют двузубый мостиковые лиганды, и даже те, которые этого не делают, такие как терфенильный комплекс, упомянутый ранее, имеют некоторые мостиковые характеристики через металл–ipso -углеродные взаимодействия.
Бидентатный лиганд может действовать как пинцет для того, чтобы хелатирование для этого атомы металлов должны сблизиться друг с другом, тем самым укорачивая пятикратную длину связи. Двумя способами получения более коротких расстояний металл-металл являются либо уменьшение расстояния между хелатирующими атомами в лиганде, изменяя структуру, либо используя стерические эффекты чтобы вызвать конформационное изменение в лиганде, которое изгибает молекулу таким образом, чтобы сближать хелатирующие атомы. Пример последнего показан ниже:
 Стерические эффекты на бидентатный лиганд
Стерические эффекты на бидентатный лиганд
В приведенном выше примере показан лиганд, используемый в димолибденовом комплексе, показанном ранее. Когда атом углерода между двумя атомами азота в лиганде имеет связанный с ним водород, стерическое отталкивание невелико. Однако, когда водород заменяется гораздо более объемным фенильным кольцом, стерическое отталкивание резко возрастает, и лиганд «выгибается», что вызывает изменение ориентации неподеленных пар электронов на атомах азота. Эти неподеленные пары являются тем, что отвечает за образование связей с металлическими центрами, поэтому принуждение их к сближению также заставляет металлические центры располагаться ближе друг к другу. Таким образом, уменьшается длина пятикратной связи. В случае, когда этот лиганд связан с пятисвязанным димолибденом, длина пятеркой связи изменяется от 201,87 мкм до 201,57 мкм, когда водород заменяется фенильной группой. Аналогичные результаты были также продемонстрированы в комплексах с пятью связями дихрома.[12]
Направления исследований
Продолжаются попытки подготовить более короткие пятикратные облигации.[13][14]
использованная литература
- ^ Риттер, Стив (26 сентября 2005 г.). «Дебют пятикратной связи: синтезирована первая стабильная молекула с пятикратной связью металл-металл». Новости химии и машиностроения. 83 (39).
- ^ Нгуен, Тайлуань; Саттон, Эндрю Д.; Брында, Марчин; Феттингер, Джеймс С.; Лонг, Гэри Дж .; Власть, Филип П. (2005). «Синтез стабильного соединения с пятикратной связью между двумя центрами хрома (I)». Наука. 310 (5749): 844–847. Bibcode:2005Наука ... 310..844N. Дои:10.1126 / science.1116789. PMID 16179432.
- ^ Брында, Марчин; Гальярди, Лаура; Видмарк, Пер-Олоф; Power, Philip P .; Роос, Бьорн О. (2006). "Квантово-химическое исследование пятимерной связи между двумя центрами хрома в [PhCrCrPh]: транс-Изгиб против линейной геометрии ». Энгью. Chem. Int. Эд. 45 (23): 3804–3807. Дои:10.1002 / anie.200600110. PMID 16671122.

- ^ Ла Маккиа, Джованни; Гальярди, Лаура; Power, Philip P .; Брында, Марцин (2008). «Большие различия во вторичных взаимодействиях металл-арен в димерах переходных металлов ArMMAr (Ar = терфенил; M = Cr, Fe или Co): последствия для пятикратной связи Cr-Cr». Варенье. Chem. Soc. 130 (15): 5104–5114. Дои:10.1021 / ja0771890. PMID 18335988.
- ^ Мерино, Габриэль; Дональд, Келлинг Дж .; D'Acchioli, Jason S .; Хоффманн, Роальд (2007). "Много способов получить пятерку". Варенье. Chem. Soc. 129 (49): 15295–15302. Дои:10.1021 / ja075454b. PMID 18004851.
- ^ Гальярди, Лаура; Роос, Бьорн О. (24 февраля 2005 г.). «Квантово-химические расчеты показывают, что молекула урана U2 имеет пятикратную облигацию ". Природа. 433 (7028): 848–851. Bibcode:2005Натура.433..848Г. Дои:10.1038 / природа03249. PMID 15729337.
- ^ Дюме, Бель (23 февраля 2005 г.). «Новый взгляд на химические связи». PhysicsWeb.
- ^ Kreisel, Kevin A .; Яп, Гленн П. А .; Дмитренко, Ольга; Лэндис, Кларк Р .; Теопольд, Клаус Х. (2007). "Самая короткая связь металл – металл: молекулярная и электронная структура двухъядерного комплекса диазадиена хрома". Варенье. Chem. Soc. (Связь). 129 (46): 14162–14163. Дои:10.1021 / ja076356t. PMID 17967028.
- ^ Нур, Аваль; Вагнер, Франк Р .; Кемпе, Ретт (2008). «Предельные расстояния металл – металл: координационное соединение с ультракороткой связью хром – хром». Энгью. Chem. Int. Эд. 47 (38): 7246–7249. Дои:10.1002 / anie.200801160. PMID 18698657.
- ^ Цай, И-Чжоу; Сюй, Чиа-Вэй; Yu, Jen-Shiang K .; Ли, Джин-Сян; Ван, Ю; Куо, Тинг-Шен (2008). "Замечательно короткие связи металл-металл: пятикратно связанный дихромиевый (I) комплекс фонарного типа". Энгью. Chem. Int. Эд. 47 (38): 7250–7253. Дои:10.1002 / anie.200801286. PMID 18683844.
- ^ Цай, И-Чжоу; Чен, Хун-Чжан; Чанг, Чи-Чи; Yu, Jen-Shiang K .; Ли, Джин-Сян; Ван, Ю; Куо, Тинг-Шен (2009). «Путь от четырехместных облигаций Мо – Мо к пятикратным облигациям». Варенье. Chem. Soc. 131 (35): 12534–12535. Дои:10.1021 / ja905035f. PMID 19685872.
- ^ Сюй, Чай-Вэй; Yu, Jen-Shiang K .; Йен, Чун-Сюй; Ли, Джин-Сян; Ван, Ю; Ца, И-Чжоу (2008). «Пятисвязные комплексы дихрома (I) с длиной связи металл-металл 1,74 Å». Энгью. Chem. Int. Эд. 47 (51): 9933–9936. Дои:10.1002 / anie.200803859. PMID 19016281.
- ^ Нур, Аваль; Глатц, Гермунд; Мюллер, Роберт; Каупп, Мартин; Демешко, Сергей; Кемпе, Ретт (2009). «Карбоалюминирование пятичастной связи хром – хром». Химия природы. 1 (4): 322–325. Bibcode:2009НатЧ ... 1..322Н. Дои:10.1038 / NCHEM.255. PMID 21500603.
- ^ Ни, Чэнбао; Эллис, Бобби Д .; Лонг, Гэри Дж .; Власть, Филип П. (2009). «Реакции Ar′CrCrAr ′ с N2O или N3(1-Ad): полный разрыв пятичастной связи Cr – Cr ». Химические коммуникации. 2009 (17): 2332–2334. Дои:10.1039 / b901494b. PMID 19377676.




