Четверная связь - Quadruple bond
А четырехкратная связь это тип химическая связь между двумя атомы с участием восьми электроны. Эта связь является продолжением более знакомых типов двойные связи и тройные облигации.[1] Стабильные четверные облигации наиболее распространены среди переходные металлы в середине d-блок, Такие как рений, вольфрам, технеций, молибден и хром. Обычно лиганды которые поддерживают четверные облигации π-доноры, нет π-акцепторы.

История
Хром (II) ацетат, Cr2(μ-O2CCH3)4(ЧАС2O)2, был первым синтезированным химическим соединением, содержащим четверную связь. Он был описан в 1844 г. Э. Пелиго, хотя его отличительная связь не была признана более века.[2]
Первое кристаллографическое исследование соединения с четверной связью было проведено советскими химиками для солей Re
2Cl2−
8.[3] Было отмечено очень короткое расстояние Re – Re. Это короткое расстояние (и диамагнетизм соли) указывает на связывание Re – Re. Однако эти исследователи неверно сформулировали анион как производное Re (II), т.е. Re
2Cl4−
8.
Вскоре после этого Ф. Альберт Коттон и C.B. Harris сообщили о кристаллической структуре октахлородирхенат калия или K2[Re2Cl8] · 2H2О.[4] Этот структурный анализ показал, что предыдущая характеристика была ошибочной. Коттон и Харрис сформулировали молекулярно-орбитальное обоснование связи, которое явно указывает на четверную связь.[2] Рений-рениевый длина облигации в этом соединении всего 224 ч. В теория молекулярных орбиталей связь описывается как σ2π4δ2 с одним сигма-облигация, два пи-облигации и один дельта-облигация.
Структура и склеивание
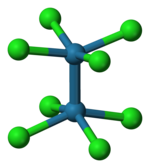

Там2Cl8]2− ion принимает затмение как показано слева. Дельта-связывающая орбиталь затем формируется перекрытием d-орбиталей на каждом атоме рения, которые перпендикулярны оси Re-Re и лежат между связями Re-Cl. D-орбитали, направленные вдоль связей Re – Cl, стабилизируются за счет взаимодействия с орбиталями лиганда хлора и не вносят вклад в связывание Re – Re.[5] Напротив, [Os2Cl8]2− ион с еще двумя электронами (σ2π4δ2δ *2) имеет Os – Os тройная связь и шахматная геометрия.[5]
Многие другие соединения с четверными связями между атомами переходных металлов были описаны, часто Коттоном и его сотрудниками. Изоэлектроника с соединением дирения представляет собой соль K4[Пн2Cl8] (октахлордимолибдат калия ).[6] Примером соединения вольфрама с четверной связью является дитольфрам тетра (hpp).
Четверные связи между атомами элементы основной группы неизвестны. Молекулярная орбитальная теория показывает, что есть два набора парных электронов в сигма-системе (один связывающий, один разрыхляющий) и два набора спаренных электронов в вырожденном π-связывающем наборе орбиталей. В сумме получается порядок связи 2, означающий, что существует двойная связь между двумя атомами углерода в дикарбон (C2) молекула. В диаграмма молекулярных орбиталей двухатомного углерода покажет, что есть две пи-связи и нет сигма-связей. Однако недавняя статья S. Shaik et al. предположил, что в двухатомном углероде существует четверная связь.[7]
Смотрите также
Рекомендации
- ^ Радиус, U .; Брехер, Ф. (2006). "'Смело передавать четверную связь металл – металл ». Энгью. Chem. Int. Эд. 45 (19): 3006–3010. Дои:10.1002 / anie.200504322.
- ^ а б Cotton, F. A .; Уолтон, Р. А. (1993). Множественные связи между атомами металла. Оксфорд: Oxford University Press. ISBN 0-19-855649-7.
- ^ Кузнецов, В.Г .; Козьмин П.А. «Строение (pyH) HReCl4» Журнал Структурной химии 1963, 4, 55-62.
- ^ Коттон, Ф.; Харрис, К. Б. (1965). «Кристаллическая и молекулярная структура дигидрата октахлородирхената (III) калия, K2[Re2Cl8] · 2H2О ". Неорг. Chem. 4 (3): 330–333. Дои:10.1021 / ic50025a015.
- ^ а б Miessler, G.L .; Тарр, Д. А. (1999). Неорганическая химия (2-е изд.). Прентис-Холл. п. 531. ISBN 0-13-841891-8.
- ^ Girolami, G.S .; Rauchfuss, T. B .; Анджеличи, Р. Дж. (1999). Синтез и техника в неорганической химии. Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 0935702482.
- ^ Шайк, Сэсон; Данович, Давид; Ву, Вэй; Су, Пэйфэн; Rzepa, Henry S .; Гиберти, Филипп С. (2012). "Четверное соединение в C2 и аналогичные частицы с восьмью валентными электронами ». Химия природы. 4: 195–200. Bibcode:2012НатЧ ... 4..195С. Дои:10.1038 / nchem.1263.
дальнейшее чтение
- Cotton, F. A .; Харрис, К. Б. (1965). «Кристаллическая и молекулярная структура дигидрата октахлородирхената (III) калия, K2[Re2Cl8] · 2H2О ". Неорг. Chem. 4 (3): 330–333. Дои:10.1021 / ic50025a015.
