Цианистый водород - Hydrogen cyanide
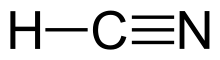 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 3DMet | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.747 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
| MeSH | Водород + Цианид | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1051 | ||
| |||
| |||
| Свойства | |||
| HCN | |||
| Молярная масса | 27,0253 г / моль | ||
| Внешность | Бесцветная жидкость или газ | ||
| Запах | Масло горького миндаля | ||
| Плотность | 0,6876 г / л[3] | ||
| Температура плавления | -13,29 ° С (8,08 ° F, 259,86 К)[3] | ||
| Точка кипения | 26 ° С (79 ° F, 299 К)[3] | ||
| Смешиваемый | |||
| Растворимость в этиловый спирт | Смешиваемый | ||
| Давление газа | 100 кПа (25 ° C)[4] | ||
Закон Генри постоянный (kЧАС) | 75 мкмоль Па−1 кг−1 | ||
| Кислотность (пKа) | 9,21 (в воде), 12,9 (в ДМСО) [5] | ||
| Основность (пKб) | 4,79 (цианид-анион) | ||
| Конъюгированная кислота | Гидроцианоний | ||
| Основание конъюгата | Цианид | ||
| 1.2675 [6] | |||
| Вязкость | 0,183 мПа · с (25 ° C)[7] | ||
| Структура | |||
| C∞v | |||
| Линейный | |||
| 2.98 D | |||
| Термохимия | |||
Теплоемкость (C) | 35,9 Дж · К−1 моль−1 (газ)[8] | ||
Стандартный моляр энтропия (S | 201,8 Дж · К−1 моль−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 135,1 кДж моль−1 | ||
| Опасности | |||
| Пиктограммы GHS |     | ||
| Сигнальное слово GHS | Опасность | ||
| H225, H300, H310, H319, H330, H336, H370, H400, H410 | |||
| P210, P261, P305 + 351 + 338 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -17,8 ° С (0,0 ° F, 255,3 К) | ||
| 538 ° С (1000 ° F, 811 К) | |||
| Пределы взрываемости | 5.6% – 40.0%[9] | ||
| Смертельная доза или концентрация (LD, LC): | |||
LC50 (средняя концентрация ) | 501 частей на миллион (крыса, 5 мин) 323 частей на миллион (мышь, 5 мин) 275 частей на миллион (крыса, 15 мин) 170 частей на миллион (крыса, 30 мин) 160 частей на миллион (крыса, 30 мин) 323 частей на миллион (крыса, 5 мин)[10] | ||
LCLo (самый низкий опубликованный ) | 200 частей на миллион (млекопитающее, 5 мин) 36 частей на миллион (млекопитающее, 2 часа) 107 частей на миллион (человек, 10 мин) 759 частей на миллион (кролик, 1 мин) 759 частей на миллион (кошка, 1 мин) 357 частей на миллион (человек, 2 мин) 179 частей на миллион (человек, 1 час)[10] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 10 частей на миллион (11 мг / м3) [скин][9] | ||
REL (Рекомендуемые) | ST 4,7 частей на миллион (5 мг / м3) [скин][9] | ||
IDLH (Непосредственная опасность) | 50 частей на миллион[9] | ||
| Родственные соединения | |||
Родственные алканнитрилы | |||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Цианистый водородиногда называют синильная кислота, это химическое соединение[11] с химическая формула HCN. Это бесцветный, чрезвычайно ядовитый и легковоспламеняющийся жидкость, которая кипит немного выше комнатная температура при 25,6 ° C (78,1 ° F).[12] HCN производится в промышленных масштабах и является очень ценным прекурсором многих химических соединений, начиная от полимеры к фармацевтическим препаратам.
Структура и общие свойства
Цианистый водород представляет собой линейную молекулу с тройная связь между углеродом и азотом. Несовершеннолетний таутомер HCN - это HNC, изоцианид водорода.
Цианистый водород слабо кислый с пKа из 9.2. Это частично ионизирует в водном растворе, чтобы дать цианид анион, CN−. А решение цианистого водорода в воды, представленный как HCN, называется синильная кислота. В соли цианид-аниона известны как цианиды.
У HCN обморок горький миндаль -любить запах что некоторые люди не могут обнаруживать из-за рецессивного генетический черта характера.[13] В летучий соединение использовалось как ингаляция родентицид и человеческий яд, а также для убийства китов.[14] Ионы цианида мешают железосодержащим респираторным ферментам.
История открытия

Цианистый водород впервые был выделен из синего пигмента (Берлинская лазурь ), который был известен с 1706 года, но структура которого неизвестна. Теперь известно, что это координационный полимер со сложной структурой и эмпирической формулой гидратированного ферроцианида железа. В 1752 г. французский химик Пьер Макер сделал важный шаг, продемонстрировав, что берлинская лазурь может быть превращена в оксид железа плюс летучий компонент, который можно использовать для его восстановления.[15] Новым компонентом стал так называемый цианистый водород. Следуя примеру Макера, шведский химик впервые приготовил его из берлинской лазури. Карл Вильгельм Шееле в 1782 г.,[16] и в итоге получил немецкое имя Blausäure (горит. «Синяя кислота») из-за ее кислой природы в воде и ее производного от берлинской лазури. На английском это стало широко известно как синильная кислота.
В 1787 г. французский химик Клод Луи Бертолле показал, что синильная кислота не содержит кислорода,[17] важный вклад в теорию кислот, которая до сих пор постулировала, что кислоты должны содержать кислород[18] (отсюда и название кислород само по себе, которое происходит от греческих элементов, которые означают «образующий кислоту» и также являются опрошенный на немецкий как Sauerstoff). В 1811 г. Жозеф Луи Гей-Люссак приготовили чистый сжиженный цианистый водород.[19] В 1815 году Гей-Люссак вывел химическую формулу синильной кислоты.[20] Радикальный цианид цианистый водород получил свое название от голубой, не только английское слово, обозначающее оттенок синего, но и греческое слово, обозначающее синий (Древнегреческий: κύανος), опять же из-за его происхождения от берлинской лазурной.
Производство и синтез
Цианистый водород образуется, по крайней мере, в ограниченных количествах из многих комбинаций водорода, углерода и аммиак. Цианистый водород в настоящее время производится в больших количествах с помощью нескольких процессов, а также является регенерированным отходом производства акрилонитрил.[11] В 2006 году в США было произведено от 500 миллионов до 1 миллиарда фунтов.[21]
Самый важный процесс - это Андрусовское окисление изобретен Леонид Андрусов в IG Farben в котором метан и аммиак реагировать в присутствии кислород примерно при 1200 ° C (2190 ° F) в течение платина катализатор:[22]
- 2 канала4 + 2 NH3 + 3 O2 → 2 HCN + 6 H2О
Энергия, необходимая для реакции, обеспечивается частичным окислением метана и аммиака.
Меньшее значение имеет Degussa обработать (BMA процесс ), в котором не добавляется кислород, а энергия должна передаваться косвенно через стенку реактора:[23]
- CH4 + NH3 → HCN + 3H2
Эта реакция сродни паровой риформинг, реакция метан и вода дать монооксид углерода и водород.
В процессе Шавинигана углеводороды, например пропан, вступают в реакцию с аммиаком. в лаборатории небольшие количества HCN образуются путем добавления кислот к цианидным солям щелочных металлов:
- ЧАС+ + NaCN → HCN + Na+
Эта реакция иногда является причиной случайных отравлений, поскольку кислота превращает нелетучую цианидную соль в газообразный HCN.
Исторические методы производства
Большой спрос на цианиды для горных работ в 1890-х годах удовлетворялся за счет Джордж Томас Бейлби, который запатентовал метод получения цианистого водорода путем передачи аммиак сверх светящийся уголь в 1892 г. Этот метод использовался до Гамильтон Кастнер в 1894 г. разработал синтез, исходя из угля, аммиака и натрий уступающий цианид натрия, который реагирует с кислотой с образованием газообразного HCN.
Приложения
HCN является предшественником цианид натрия и цианистый калий, которые используются в основном в золото и Серебряный горнодобывающая промышленность и гальваника этих металлов. Через посредство циангидрины, из HCN получают множество полезных органических соединений, включая мономер метилметакрилат, от ацетон, то аминокислота метионин, через Синтез Стрекера, и хелатирующие агенты EDTA и NTA. Через гидроцианирование процесса, HCN добавляется к бутадиен давать адипонитрил, предшественник Нейлон-6,6.[11]
Вхождение
HCN можно получить из фрукты у которых есть яма, такие как вишня, абрикосы, яблоки, и горький миндаль, из которого изготовлено миндальное масло и ароматизаторы. Многие из этих ям содержат небольшое количество циангидрины такие как манделонитрил и амигдалин, которые медленно выделяют цианистый водород.[24][25] Из ста граммов измельченных семян яблока можно получить около 70 мг HCN.[26] Немного многоножки высвободить цианистый водород в качестве защитного механизма,[27] как и некоторые насекомые, например, некоторые мотылек. Цианистый водород содержится в выхлопных газах автомобилей и в дыме от горящих азотсодержащих веществ. пластмассы. Так называемые «горькие» корни маниока растение может содержать до 1 грамма HCN на килограмм.[28][29]
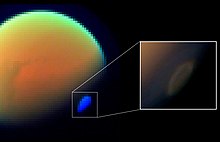
HCN на Титане
HCN был измерен в атмосфере Титана четырьмя приборами на Космический зонд Кассини, один инструмент на Вояджер, и один инструмент на Земле.[30] Одно из этих измерений было на месте, где космический корабль Кассини опустился на расстояние от 1000 до 1100 км (от 620 до 680 миль) над поверхностью Титана, чтобы собрать атмосферный газ для масс-спектрометрии анализ.[31] Первоначально HCN образуется в атмосфере Титана в результате реакции фотохимических образований метана и радикалов азота, которые проходят через H2Промежуточное соединение CN, например, (CH3 + N → H2CN + H → HCN + H2).[32][33] Ультрафиолетовое излучение расщепляет HCN на CN + H; однако CN эффективно рециркулируется обратно в HCN посредством реакции CN + CH4 → HCN + CH3.[32]
HCN на молодой Земле
Было высказано предположение, что углерод из каскада астероидов (известного как Поздняя тяжелая бомбардировка ), возникший в результате взаимодействия Юпитера и Сатурна, взорвал поверхность молодой Земли и вступил в реакцию с азотом в атмосфере Земли с образованием HCN.[34]
HCN у млекопитающих
Некоторые авторы показали, что нейроны могут образовывать цианистый водород при активации их опиоид рецепторы эндогенными или экзогенными опиоидами. Они также показали, что выработка HCN нейронами активирует Рецепторы NMDA и играет роль в преобразование сигнала между нейрональными клетками (нейротрансмиссия ). Более того, повышение эндогенной продукции нейронального HCN под действием опиоидов, по-видимому, было необходимо для адекватного опиоидного обезболивание, поскольку обезболивающее действие опиоидов ослаблялось акцепторами HCN. Они считали эндогенный HCN нейромодулятором.[35]
Также было показано, что при стимуляции мускариновый холинергический рецепторы в культуре феохромоцитома клетки увеличивается Продукция HCN в живом организме (in vivo) мускариновая холинергическая стимуляция уменьшается Производство HCN.[36]
Лейкоциты генерировать HCN во время фагоцитоз, и может убить бактерии, грибы, и другие патогены, генерируя несколько различных токсичных химических веществ, одним из которых является цианистый водород.[35]
В расширение сосудов вызванный нитропруссид натрия было показано, что опосредовано не только образованием NO, но и выработкой эндогенного цианида, что добавляет не только токсичность, но и некоторую дополнительную антигипертензивную эффективность по сравнению с нитроглицерин и другие нецианогенные нитраты, которые не вызывают повышения уровня цианида в крови.[37]
HCN является составной частью табачный дым.[38]
HCN и происхождение жизни
Цианистый водород обсуждался как предшественник аминокислот и нуклеиновых кислот, и предполагается, что он играет роль в происхождение жизни.[39] Хотя связь этих химических реакций с теорией происхождения жизни остается спекулятивной, исследования в этой области привели к открытиям новых путей к органическим соединениям, полученным при конденсации HCN (например, Аденин ).[40]
HCN в космосе
HCN был обнаружен в межзвездная среда[41] и в атмосфере углеродные звезды.[42] С тех пор в ходе обширных исследований были изучены пути образования и разрушения HCN в различных средах и изучено его использование в качестве индикатора для различных астрономических видов и процессов. HCN может быть наблюдаемый из наземных телескопы через ряд атмосферный окна.[43] J = 1 → 0, J = 3 → 2, J = 4 → 3 и J = 10 → 9 чистых вращательные переходы все наблюдались.[41][44][45]
HCN образуется в межзвездный облака проходят по одному из двух основных путей:[46] через нейтрально-нейтральную реакцию (CH2 + N → HCN + H) и через диссоциативная рекомбинация (HCNH+ + е− → HCN + H). Путь диссоциативной рекомбинации доминирует на 30%; Однако HCNH+ должен быть в линейной форме. Диссоциативная рекомбинация со структурным изомером H2NC+, производит исключительно изоцианид водорода (HNC).
HCN разрушается в межзвездных облаках с помощью ряда механизмов, зависящих от местоположения в облаке.[46] В области с преобладанием фотонов (PDR), фотодиссоциация доминирует, производя CN (HCN + ν → CN + H). На более глубоких глубинах преобладает фотодиссоциация космических лучей с образованием CN (HCN + cr → CN + H). В темном ядре его разрушают два конкурирующих механизма, образуя HCN+ и HCNH+ (HCN + H+ → HCN+ + H; HCN + HCO+ → HCNH+ + СО). Реакция с HCO+ доминирует в ~ 3,5 раза. HCN использовался для анализа множества видов и процессов в межзвездной среде. Он был предложен в качестве индикатора для плотного молекулярного газа.[47][48] и как индикатор притока звезд в области звездообразования с большой массой.[49] Кроме того, было показано, что соотношение HNC / HCN является отличным методом для различения PDR и областей с преобладанием рентгеновских лучей (XDR).[50]
11 августа 2014 года астрономы опубликовали исследования с использованием Большой миллиметровый / субмиллиметровый массив Atacama (ALMA) впервые подробно описал распределение HCN, HNC, ЧАС2CO, и пыль внутри кома из кометы C / 2012 F6 (Леммон) и C / 2012 S1 (ISON).[51][52]
В феврале 2016 года было объявлено, что следы цианистого водорода были обнаружены в атмосфере горячего воздуха. Супер-Земля 55 Cancri e с НАСА Космический телескоп Хаббла.[53]
Как яд и химическое оружие
В Первая Мировая Война цианистый водород использовался в качестве химического оружия против Центральных держав французами с 1916 года, Соединенными Штатами и Италия в 1918 году, но из-за погодных условий он оказался недостаточно эффективным.[54][55] Газ легче воздуха и быстро рассеивается в атмосфере; это в отличие от более плотных агентов, таких как фосген или хлор которые, как правило, остаются на уровне земли и погружаются в траншеи полей сражений Западного фронта. По сравнению с такими агентами он также должен присутствовать в более высоких концентрациях, чтобы быть фатальным. Эти свойства в совокупности делают его использование в полевых условиях непрактичным. Концентрация цианистого водорода в диапазоне 100–200 частей на миллион в воздухе убьет человека в течение 10–60 минут.[56] Концентрация цианистого водорода 2000 промилле (около 2380 мг / м3) убьет человека примерно за одну минуту.[56] Токсичность вызвана цианид-ионом, который останавливает клеточное дыхание действуя как неконкурентный ингибитор для фермента в митохондриях, называемого цитохром с оксидаза. Таким образом, цианистый водород обычно входит в список химическое оружие как агент крови.[57] Он указан в График 3 из Конвенция о химическом оружии в качестве потенциального оружия, которое имеет крупномасштабное промышленное использование, заводы в подписавших странах, которые производят более 30 метрических тонн в год, должны быть заявлены и могут быть проверены Организация по запрещению химического оружия.
Цианистый водород был поглощен носителем для использования в качестве пестицида. Возможно, самым печально известным из них является Циклон Б (Немецкий: Циклон B, с B стоя для Blausäure - синильная кислота; также, чтобы отличить его от более раннего продукта, позже известного как Zyklon A),[58] он использовался в Нацистский немецкий лагеря смерти в течение Вторая Мировая Война убить в массовом порядке как часть их Окончательное решение программа геноцида. Цианистый водород также использовался в лагерях для дезинфекции одежды в попытках искоренить болезни, переносимые вшами и другими паразитами. Один из первых чешских производителей продолжил выпуск Циклон Б под торговой маркой «Ураган Д2».[59] до не давнего времени.[когда? ] Цианистый водород также использовался в судебных органах. казнь в некоторых Штаты США, где он был произведен во время казни действием серная кислота на натрий или цианистый калий.
Под именем синильная кислота, HCN использовался в качестве смертельного агента в китобойный промысел гарпуны, хотя это оказалось довольно опасным для экипажа, использовавшего его, и поэтому от него быстро отказались.[14] С середины 18 века его использовали при отравлении, убийствах и самоубийствах.[60]
Цианистый водород в воздухе взрывоопасен при концентрациях более 5,6%.[61] Это намного выше его уровня токсичности.
использованная литература
- ^ «Цианистый водород - Резюме соединения». PubChem Compound. США: Национальный центр биотехнологической информации. 16 сентября 2004 г. Опознание.. Получено 2012-06-04.
- ^ «цианистый водород (CHEBI: 18407)». Химические объекты, представляющие биологический интерес. Великобритания: Европейский институт биоинформатики. 18 октября 2009 г. Главная. Получено 2012-06-04.
- ^ а б c Хейнс, 4,67
- ^ Хейнс, 6,94
- ^ Эванс, Д.А. «pKa неорганических и оксокислот» (PDF). Получено 19 июня, 2020.
- ^ Патнаик, П. (2002). Справочник неорганических химикатов. Макгроу-Хилл. ISBN 978-0-07-049439-8.
- ^ Хейнс, 6.231
- ^ Хейнс, 5,19
- ^ а б c d Карманный справочник NIOSH по химической опасности. "#0333". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б "Цианистый водород". Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c Gail, E .; Гос, С .; Kulzer, R .; Lorösch, J .; Rubo, A .; Зауэр, М. "Циано-соединения, неорганические". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a08_159.pub2.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ "Wolfram-Alpha: вычислительная машина знаний".
- ^ «Цианид, отсутствие запаха». Онлайн-менделевское наследование в человеке. Получено 2010-03-31.
- ^ а б Литл, Томас. "Ядовитые гарпуны". Получено 28 октября 2013. (мертвая ссылка 7 июня 2020 г.)
- ^ Маккер, Пьер-Жозеф (представлен: 1752; опубликован: 1756) "Éxamen chymique de bleu de Prusse" (Химическая экспертиза берлинской лазури), Mémoires de l'Académie Royale des Sciences С. 60–77.
- ^ Шееле, Карл В. (1782) "Försök, beträffande det färgande ämnet uti Berlinerblå" (Эксперимент с красящим веществом берлинского синего), Kungliga Svenska Vetenskapsakademiens Handlingar (Труды Шведской королевской академии наук), 3: 264–275 (на шведском языке).
Перепечатано на латыни как: "De materia tingente caerulei berolinensis" в: Карл Вильгельм Шееле с Эрнстом Бенджамином Готлибом Хебенштрайтом (ред.) и Готфридом Генрихом Шефер (пер.), Opuscula Chemica et Physica (Лейпциг («Липсии»), (Германия): Иоганн Годфрид Мюллер, 1789), т. 2, страницы 148–174. - ^ Бертолле, К. Л. (представлено: 1787 г .; опубликовано: 1789 г.)"Mémoire sur l'acide prussique" (Воспоминания о синильной кислоте), Mémoires de l'Académie Royale des Sciences, страницы 148–161.
Печатается на: Бертолле, К. Л. (1789). "Extrait d'un mémoire sur l'acide prussique" [Отрывок из воспоминаний о синильной кислоте]. Annales de Chimie. 1: 30–39. - ^ Ньюболд, Б. Т. (1999-11-01). "Клод Луи Бертолле: великий химик французской традиции". Канадские химические новости. Получено 2010-03-31.
- ^ Гей-Люссак, Ж. Л. (1811). "Note sur l'acide prussique" [Примечание о синильной кислоте]. Annales de Chimie. 44: 128–133.
- ^ Гей-Люссак, Ж. Л. (1815). "Recherche sur l'acide prussique" [Исследования синильной кислоты]. Annales de Chimie. 95: 136–231.
- ^ Неконфиденциальные записи о внутреннем праве на платеж за 2006 г. по химическим веществам, включая информацию о производстве, обработке и использовании. EPA. Проверено 31 января 2013.
- ^ Андрусов, Л. (1935). «Каталитическое окисление смесей аммиака и метана до цианистого водорода». Angewandte Chemie. 48 (37): 593–595. Дои:10.1002 / ange.19350483702.
- ^ Эндтер, Ф. (1958). "Die Technische Synthese von Cyanwasserstoff aus Methan und Ammoniak ohne Zusatz von Sauerstoff". Chemie Ingenieur Technik. 30 (5): 305–310. Дои:10.1002 / cite.330300506.
- ^ Веттер, Дж. (2000). «Цианогенные гликозиды растений». Токсикон. 38 (1): 11–36. Дои:10.1016 / S0041-0101 (99) 00128-2. PMID 10669009.
- ^ Джонс, Д. А. (1998). «Почему так много цианогенных пищевых растений?». Фитохимия. 47 (2): 155–162. Дои:10.1016 / S0031-9422 (97) 00425-1. PMID 9431670.
- ^ «Ядовиты ли ядра Apple?». Голые ученые. 26 сентября 2010. Архивировано с оригинал 6 марта 2014 г.. Получено 6 марта 2014.
- ^ Blum, M. S .; Вудринг, Дж. П. (1962). "Секреция бензальдегида и цианида водорода многоножками Pachydesmus crassicutis (Дерево)". Наука. 138 (3539): 512–513. Bibcode:1962 г. наук ... 138..512Б. Дои:10.1126 / science.138.3539.512. PMID 17753947.
- ^ Aregheore, E.M .; Агунбиад, О. О. (1991). «Токсическое действие маниоки (Manihot esculenta Кранц) диеты на человеке: обзор ». Ветеринария и токсикология человека. 33 (3): 274–275. PMID 1650055.
- ^ Уайт, W. L. B .; Ариас-Гарсон, Д. И .; McMahon, J.M .; Сейр, Р. Т. (1998). «Цианогенез в маниоке, роль гидроксинитриллиазы в производстве корня цианида». Физиология растений. 116 (4): 1219–1225. Дои:10.1104 / стр.116.4.1219. ЧВК 35028. PMID 9536038.
- ^ Loison, J.C .; Hébrard, E .; Dobrijevic, M .; Hickson, K.M .; Каральп, F .; Hue, V .; Gronoff, G .; Venot, O .; Бенилан Ю. (февраль 2015 г.). «Нейтральная фотохимия нитрилов, аминов и иминов в атмосфере Титана». Икар. 247: 218–247. Bibcode:2015Icar..247..218L. Дои:10.1016 / j.icarus.2014.09.039.
- ^ Magee, Brian A .; Уэйт, Дж. Хантер; Mandt, Kathleen E .; Вестлейк, Джозеф; Белл, Джаред; Гелл, Дэвид А. (декабрь 2009 г.). «Состав верхних слоев атмосферы Титана по данным INMS: методы анализа и сравнение моделей». Планетарная и космическая наука. 57 (14–15): 1895–1916. Bibcode:2009П & СС ... 57.1895M. Дои:10.1016 / j.pss.2009.06.016.
- ^ а б Пирс, Бен К. Д .; Молавердихани, Каран; Пудриц, Ральф; Хеннинг, Томас; Эбрар, Эрид. «Производство HCN в атмосфере Титана: взаимодействие квантовой химии и моделирования неравновесной атмосферы». Астрофизический журнал. 901 (2): 110. Дои:10.3847 / 1538-4357 / abae5c.
- ^ Пирс, Бен К. Д .; Эйерс, Пол У .; Пудриц, Ральф Э. (20 февраля 2019 г.). «Согласованная сокращенная сеть для химии HCN в атмосферах ранней Земли и Титана: квантовые расчеты коэффициентов скорости реакции». Журнал физической химии A. 123 (9): 1861–1873. arXiv:1902.05574. Bibcode:2019JPCA..123.1861P. Дои:10.1021 / acs.jpca.8b11323. ISSN 1089-5639. PMID 30721064.
- ^ Уэйд, Николас (04.05.2015). «Осмысление химии, которая привела к жизни на Земле». Нью-Йорк Таймс. Получено 5 мая 2015.
- ^ а б Боровиц Дж. Л., Гунасекар П. Г., Изом Г. Е. (12 сентября 1997 г.). «Генерация цианида водорода путем активации мю-опиатных рецепторов: возможная нейромодулирующая роль эндогенного цианида». Brain Res. 768 (1–2): 294–300. Дои:10.1016 / S0006-8993 (97) 00659-8. PMID 9369328.
- ^ Gunasekar PG, Prabhakaran K, Li L, Zhang L, Isom GE, Borowitz JL (май 2004 г.). «Рецепторные механизмы, обеспечивающие генерацию цианида в клетках PC12 и головном мозге крысы». Neurosci Res. 49 (1): 13–18. Дои:10.1016 / j.neures.2004.01.006. PMID 15099699.
- ^ Смит Р.П., Крушина Х. (январь 1976 г.). «Токсикология некоторых неорганических антигипертензивных анионов». Fed Proc. 35 (1): 69–72. PMID 1245233.
- ^ Талхаут, Рейнскье; Шульц, Томас; Флорек, Ева; Ван Бентем, Ян; Вестер, Пит; Опперхёйзен, Антун (2011). «Опасные соединения в табачном дыме». Международный журнал экологических исследований и общественного здравоохранения. 8 (12): 613–628. Дои:10.3390 / ijerph8020613. ISSN 1660-4601. ЧВК 3084482. PMID 21556207.
- ^ Мэтьюз, К. Н. (2004). «Мир HCN: Установление жизни белков и нуклеиновых кислот с помощью полимеров цианида водорода». Происхождение: генезис, эволюция и разнообразие жизни. Клеточное происхождение и жизнь в экстремальных средах обитания и астробиологии. 6. С. 121–135. Дои:10.1007 / 1-4020-2522-X_8. ISBN 978-1-4020-2522-8.
- ^ Аль-Азми, А .; Элассар, А.-З. А .; Бут, Б. Л. (2003). «Химия диаминомалеонитрила и его применение в гетероциклическом синтезе». Тетраэдр. 59 (16): 2749–2763. Дои:10.1016 / S0040-4020 (03) 00153-4.
- ^ а б Снайдер, Л. Э .; Буль, Д. (1971).«Наблюдения за радиоизлучением межзвездного цианида водорода». Астрофизический журнал. 163: L47 – L52. Bibcode:1971ApJ ... 163L..47S. Дои:10.1086/180664.
- ^ Йоргенсен, Уффе Г. (1997), "Крутые звездные модели", Ван Дишек, Эвин Ф. (ред.), Молекулы в астрофизике: зонды и процессы, Симпозиумы Международного астрономического союза. Молекулы в астрофизике: зонды и процессы, 178, Springer Science & Business Media, стр. 446, г. ISBN 978-0792345381.
- ^ Treffers, R .; Larson, H.P .; Финк, У .; Готье, Т. Н. (1978). «Верхние пределы для отслеживания составляющих в атмосфере Юпитера из анализа его 5-мкм спектра». Икар. 34 (2): 331–343. Bibcode:1978Icar ... 34..331T. Дои:10.1016/0019-1035(78)90171-9.
- ^ Bieging, J. H .; Шакед, С .; Геншаймер, П. Д. (2000). «Наблюдения в субмиллиметровом и миллиметровом диапазонах волн SiO и HCN в околозвездных оболочках звезд AGB». Астрофизический журнал. 543 (2): 897–921. Bibcode:2000ApJ ... 543..897B. Дои:10.1086/317129.
- ^ Schilke, P .; Ментен, К. М. (2003). «Обнаружение второй, сильной субмиллиметровой лазерной линии HCN в направлении углеродных звезд». Астрофизический журнал. 583 (1): 446–450. Bibcode:2003ApJ ... 583..446S. Дои:10.1086/345099.
- ^ а б Boger, G.I .; Штернберг, А. (2005). «CN и HCN в плотных межзвездных облаках». Астрофизический журнал. 632 (1): 302–315. arXiv:Astro-ph / 0506535. Bibcode:2005ApJ ... 632..302B. Дои:10.1086/432864.
- ^ Gao, Y .; Соломон, П. М. (2004). «Скорость звездообразования и плотный молекулярный газ в галактиках». Астрофизический журнал. 606 (1): 271–290. arXiv:Astro-ph / 0310339. Bibcode:2004ApJ ... 606..271G. Дои:10.1086/382999.
- ^ Gao, Y .; Соломон, П. М. (2004). «Обзор HCN нормальных спиральных, инфракрасных и сверхъестественных галактик». Серия дополнений к астрофизическому журналу. 152 (1): 63–80. arXiv:Astro-ph / 0310341. Bibcode:2004ApJS..152 ... 63G. Дои:10.1086/383003.
- ^ Wu, J .; Эванс, Н. Дж. (2003). «Признаки притока в областях, образующих массивные звезды». Астрофизический журнал. 592 (2): L79 – L82. arXiv:Astro-ph / 0306543. Bibcode:2003ApJ ... 592L..79W. Дои:10.1086/377679.
- ^ Лоенен, А. Ф. (2007). «Молекулярные свойства (U) LIRG: CO, HCN, HNC и HCO.+". Труды симпозиума МАС. 242: 462–466. arXiv:0709.3423. Bibcode:2007IAUS..242..462L. Дои:10.1017 / S1743921307013609.
- ^ Зубрицкий, Елизавета; Нил-Джонс, Нэнси (11 августа 2014 г.). "РЕЛИЗ 14-038 - Трехмерное исследование комет НАСА показывает, что химический завод работает". НАСА. Получено 12 августа 2014.
- ^ Кординер, M.A .; и другие. (11 августа 2014 г.). «Составление карты высвобождения летучих веществ во внутренних кометах комет C / 2012 F6 (Lemmon) и C / 2012 S1 (ISON) с использованием большого миллиметрового / субмиллиметрового массива Atacama». Астрофизический журнал. 792 (1): L2. arXiv:1408.2458. Bibcode:2014ApJ ... 792L ... 2C. Дои:10.1088 / 2041-8205 / 792/1 / L2.
- ^ «Первое обнаружение атмосферы над Землей». Информационный центр ЕКА / Хаббла. 16 февраля 2016 г.
- ^ Шнедлиц, Маркус (2008) Chemische Kampfstoffe: Geschichte, Eigenschaften, Wirkung. ГРИН Верлаг. п. 13. ISBN 364023360-3.
- ^ Оружие войны - ядовитый газ. firstworldwar.com
- ^ а б Воздействие на окружающую среду и здоровье. Cyanidecode.org. Проверено 2 июня 2012.
- ^ "Цианистый водород". Организация по запрещению химического оружия. Получено 2009-01-14.
- ^ Дворк, Д .; ван Пелт, Р. Дж. (1996). Освенцим, 1270 г. по настоящее время. Нортон. п.443. ISBN 978-0-393-03933-7.
- ^ «СИНИЙ ДЫМ». Химический Завод Draslovka a.s. Получено 2020-07-06.
- ^ "Сайт Poison Garden". Получено 18 октября 2014.
- ^ «Документация по концентрациям, непосредственно опасным для жизни или здоровья (IDLH) - 74908». NIOSH.
Цитированные источники
- Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). CRC Press. ISBN 978-1439855119.
внешние ссылки
- Национальный институт исследований и безопасности (1997 год). "Cyanure d'hydrogène et al., Водные растворы ". Токсикологический журнал № 4, Париж: INRS, 5 стр. (PDF-файл, На французском)
- Международная карта химической безопасности 0492
- Цианистый водород и цианиды (CICAD 61)
- Национальный реестр загрязнителей: информационный бюллетень по цианидным соединениям
- Карманный справочник NIOSH по химической опасности
- Управление здравоохранения
- Плотность газообразного цианистого водорода



