Электронная транспортная цепь - Electron transport chain

В электронная транспортная цепь (ТАК ДАЛЕЕ) представляет собой серию комплексы который передача электроны из доноры электронов к акцепторы электронов через редокс (и восстановление, и окисление происходят одновременно), и связывает этот перенос электрона с переносом протоны (ЧАС+ ионов) через мембрана. Цепь переноса электронов состоит из пептиды, ферменты, и другие молекулы.
Поток электронов через цепь переноса электронов - это экзэргонический процесс. Энергия окислительно-восстановительных реакций создает электрохимический протонный градиент что стимулирует синтез аденозинтрифосфат (АТФ). В аэробного дыхания, поток электронов заканчивается молекулярным кислород являясь конечным акцептором электронов. В анаэробное дыхание используются другие акцепторы электронов, такие как сульфат.
В цепи переноса электронов окислительно-восстановительные реакции запускаются Свободная энергия Гиббса состояние компонентов. Свободная энергия Гиббса связана с величиной, называемой окислительно-восстановительным потенциалом. Комплексы в цепи переноса электронов собирают энергию окислительно-восстановительных реакций, которые происходят при переносе электронов от низкого окислительно-восстановительного потенциала к более высокому окислительно-восстановительному потенциалу, создавая электрохимический градиент. Создаваемый электрохимический градиент стимулирует синтез АТФ через связывание с окислительного фосфорилирования с АТФ-синтаза.[1]
Цепь переноса электронов и сайт окислительного фосфорилирования находятся на внутренняя митохондриальная мембрана. Энергия, запасенная в процессе дыхания в восстановленных соединениях (таких как НАДН и ФАДН), используется цепью переноса электронов для перекачки протонов в межмембранное пространство, создавая электрохимический градиент над внутренней митохрондриальной мембраной. У фотосинтезирующих эукариот цепь переноса электронов находится на тилакоидной мембране. Здесь световая энергия приводит к сокращению компонентов цепи переноса электронов и, следовательно, вызывает последующий синтез АТФ. В бактерии Цепь переноса электронов может варьироваться в зависимости от вида, но всегда представляет собой набор окислительно-восстановительных реакций, которые связаны с синтезом АТФ за счет создания электрохимического градиента и окислительного фосфорилирования через АТФ-синтазу.[2]
Цепи митохронного переноса электронов
Наиболее эукариотический клетки имеют митохондрии, которые производят АТФ из продуктов цикл лимонной кислоты, окисление жирных кислот, и окисление аминокислот. На внутренняя митохондриальная мембрана, электроны из НАДН и FADH2 проходят через цепь переноса электронов к кислороду, который восстанавливается до воды.[3] Цепь переноса электронов включает ферментативный серия доноров и акцепторов электронов. Каждый донор электронов передаст электроны более электроотрицательный акцептор, который, в свою очередь, отдает эти электроны другому акцептору, и этот процесс продолжается до тех пор, пока электроны не перейдут к кислороду, наиболее электроотрицательному и конечному акцептору электронов в цепи. Прохождение электронов между донором и акцептором высвобождает энергию, которая используется для генерации протонный градиент через митохондриальную мембрану «накачка» протонов в межмембранное пространство, создавая термодинамическое состояние, которое может работать. Весь этот процесс называется окислительного фосфорилирования поскольку АДФ фосфорилируется до АТФ с использованием электрохимического градиента, установленного окислительно-восстановительными реакциями цепи переноса электронов.
Митохондриальные окислительно-восстановительные носители
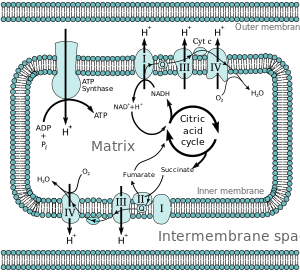
Энергия, полученная за счет передачи электронов вниз по цепи переноса электронов, используется для перекачки протонов из митохондриальный матрикс в межмембранное пространство, создавая электрохимический протонный градиент (ΔpH ) через внутреннюю митохондриальную мембрану. Этот протонный градиент в значительной степени, но не исключительно, отвечает за митохондриальную мембранный потенциал (ΔΨM).[4] Это позволяет АТФ-синтазе использовать поток H+ через фермент обратно в матрицу для выработки АТФ из аденозиндифосфат (ADP) и неорганический фосфат. Комплекс I (НАДН-кофермент Q редуктаза; обозначен I) принимает электроны от Цикл Кребса электронный носитель никотинамидадениндинуклеотид (НАДН), и передает их коферменту Q (убихинон; обозначенный Q), который также получает электроны от комплекса II (сукцинатдегидрогеназа; помечены как II). Q передает электроны в комплекс III (цитохром bc1 сложный; помечены III), который передает их цитохром c (cyt c). Cyt c передает электроны Комплексу IV (цитохром c оксидаза; обозначенный IV), который использует электроны и ионы водорода для восстановления молекулярного кислорода до воды.
В митохондриях идентифицировано четыре мембраносвязанных комплекса. Каждая из них представляет собой чрезвычайно сложную трансмембранную структуру, встроенную во внутреннюю мембрану. Три из них - протонные насосы. Структуры электрически связаны липидорастворимыми переносчиками электронов и водорастворимыми переносчиками электронов. Общая электронная транспортная цепочка:
НАДН + Н+ → Комплекс I→ Q ↑ Комплекс II ↑ Сукцинат → Комплекс III→ цитохром c→ Комплекс IV → ЧАС2О ↑ Комплекс II ↑ Сукцинат
Комплекс I
В комплекс I (НАДН-убихиноноксиредуктаза, НАДН-дегидрогеназа I типа или митохондриальный комплекс I; EC 1.6.5.3 ), два электрона удаляются из НАДН и переносятся на жирорастворимый носитель, убихинон (Q). Восстановленный продукт, убихинол (QH2), свободно диффундирует внутри мембраны, а Комплекс I перемещает четыре протона (H+) через мембрану, создавая протонный градиент. Комплекс I является одним из основных центров преждевременной утечки электронов в кислород, таким образом, он является одним из основных центров образования супероксида.[5]
Путь электронов следующий:
НАДН окисляется до НАД+, уменьшив Флавин мононуклеотид в ФМНХ2 за один двухэлектронный шаг. FMNH2 затем окисляется в две одноэлектронные стадии через семихинон средний. Таким образом, каждый электрон переходит из FMNH2 для Fe-S кластер, от кластера Fe-S до убихинона (Q). Перенос первого электрона приводит к появлению свободного радикала (семихинон ) форма Q, а перенос второго электрона восстанавливает форму семихинона до формы убихинола, QH2. Во время этого процесса четыре протона перемещаются из митохондриального матрикса в межмембранное пространство.[6] Поскольку электроны постоянно окисляются и восстанавливаются по всему комплексу, электронный ток создается вдоль ширины 180 Ангстрем комплекса внутри мембраны. Этот ток обеспечивает активный перенос четырех протонов в межмембранное пространство на два электрона от НАДН.[7]
Комплекс II
В комплекс II (сукцинатдегидрогеназа или сукцинат-CoQ редуктаза; EC 1.3.5.1 ) дополнительные электроны доставляются в хинон пул (Q), происходящий из сукцината и перенесенный (через флавинадениндинуклеотид (FAD) ) к Q. Комплекс II состоит из четырех белковых субъединиц: сукцинатдегидрогеназы (SDHA); субъединица железо-сера сукцинатдегидрогеназа [убихинон], митохондриальная (SDHB); субъединица С сукцинатдегидрогеназы (SDHC) и комплекс сукцинатдегидрогеназы, субъединица D (SDHD). Другие доноры электронов (например, жирные кислоты и глицерин-3-фосфат) также направляют электроны в Q (через FAD). Комплекс II представляет собой параллельный путь переноса электронов к комплексу 1, но в отличие от комплекса 1, по этому пути протоны не транспортируются в межмембранное пространство. Следовательно, путь через комплекс II вносит меньше энергии в общий процесс цепи переноса электронов.
Комплекс III
В Комплекс III (цитохром до н.э1 сложный или CoQH2-цитохром c редуктаза; EC 1.10.2.2 ), Q-цикл способствует протонному градиенту за счет асимметричного поглощения / высвобождения протонов. Два электрона удаляются из QH2 на QО сайта и последовательно переносится на две молекулы цитохром c, водорастворимый переносчик электронов, расположенный в межмембранном пространстве. Два других электрона последовательно проходят через белок к Qя участок, где хиноновая часть убихинона восстанавливается до хинола. Протонный градиент образован одним хинолом () окисления на Qо сайт для образования одного хинона () в точке Qя сайт. (Всего перемещается четыре протона: два протона восстанавливают хинон до хинола, а два протона высвобождаются из двух молекул убихинола.)
Когда перенос электронов снижается (из-за высокого мембранного потенциала или респираторных ингибиторов, таких как антимицин А), Комплекс III может пропускать электроны к молекулярному кислороду, что приводит к образованию супероксида.
Этот комплекс подавляется димеркапрол (British Antilewisite, BAL), нафтохинон и антимицин.
Комплекс IV
В Комплекс IV (цитохром c оксидаза; EC 1.9.3.1 ), иногда называемый цитохромом AA3, четыре электрона удаляются из четырех молекул цитохром c и переходит в молекулярный кислород (O2), производя две молекулы воды. Комплекс содержит координированные ионы меди и несколько гемовых групп. В то же время восемь протонов удаляются из митохондриального матрикса (хотя только четыре перемещаются через мембрану), что способствует протонному градиенту. Точные детали протонной накачки в Комплексе IV все еще изучаются.[8]
Сочетание с окислительным фосфорилированием
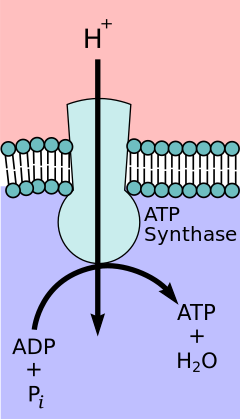
В гипотеза хемиосмотической связи, предложено Нобелевская премия по химии победитель Питер Д. Митчелл, цепь переноса электронов и окислительного фосфорилирования связаны протонным градиентом через внутреннюю митохондриальную мембрану. Отток протонов из митохондриального матрикса создает электрохимический градиент (протонный градиент). Этот градиент используется FОF1 АТФ-синтаза комплекс для производства АТФ путем окислительного фосфорилирования. АТФ-синтазу иногда описывают как Комплекс V цепи переноса электронов.[9] FО компонент АТФ-синтаза действует как ионный канал что обеспечивает обратный поток протонов в матрикс митохондрий. Он состоит из субъединиц a, b и c. Протоны в межмембранном пространстве митохондрий сначала попадают в комплекс АТФ-синтазы через а субъединичный канал. Затем протоны переходят к субъединицам c.[10] Количество c-субъединиц в нем определяет, сколько протонов потребуется для образования FО поворот на один полный оборот. Например, у человека имеется 8 субъединиц с, поэтому требуется 8 протонов.[11] После c субъединиц, протоны окончательно попадают в матрицу, используя а субъединичный канал, который открывается в митохондриальный матрикс.[10] Этот рефлюкс высвобождает свободная энергия образуются при образовании окисленных форм электронных носителей (НАД+ и Q). Свободная энергия используется для запуска синтеза АТФ, катализируемого F1 составляющая комплекса.[12]
Сочетание с окислительным фосфорилированием является ключевым этапом производства АТФ. Однако в определенных случаях разделение двух процессов может быть биологически полезным. Разобщающий белок, термогенин - присутствует во внутренней митохондриальной мембране коричневая жировая ткань - обеспечивает альтернативный поток протонов обратно во внутренний матрикс митохондрий. Тироксин также является естественным разобщителем. Этот альтернативный поток приводит к термогенез а не производство АТФ.[13]
Обратный поток электронов
Обратный поток электронов, - перенос электронов по цепи переноса электронов через обратные окислительно-восстановительные реакции. Обычно требуется значительное количество энергии, что может привести к снижению окисленной формы доноров электронов. Например, NAD + может быть восстановлен до NADH комплексом I.[14] Было показано, что существует несколько факторов, вызывающих обратный поток электронов. Однако для подтверждения этого требуется дополнительная работа. Одним из таких примеров является блокировка производства АТФ с помощью АТФ-синтазы, что приводит к накоплению протонов и, следовательно, к более высокому протонодвижущая сила, вызывая обратный поток электронов.[15]
Бактериальные цепи транспорта электронов
У эукариот НАДН является наиболее важным донором электронов. Связанная электронная транспортная цепь
НАДН → Комплекс I→ Q → Комплекс III→ цитохром c→ Комплекс IV→ О2куда Комплексы I, III и IV протонные насосы, а Q и цитохром c являются переносчиками мобильных электронов. Акцептором электронов является молекулярный кислород.
В прокариоты (бактерии и археи ) ситуация более сложная, поскольку существует несколько разных доноров электронов и несколько разных акцепторов электронов. Общая цепь переноса электронов у бактерий:
Донор Донор Донор ↓ ↓ ↓ дегидрогеназа → хинон → до н.э1 → цитохром ↓ ↓ оксидаза (редуктаза) оксидаза (редуктаза) ↓ ↓ Акцептор Акцептор
Электроны могут попасть в цепочку на трех уровнях: на уровне дегидрогеназа, на уровне пула хинонов или на уровне мобильного цитохром электронный носитель. Эти уровни соответствуют последовательно более положительным окислительно-восстановительным потенциалам или последовательно уменьшающимся разностям потенциалов относительно конечного акцептора электронов. Другими словами, они соответствуют последовательно меньшим изменениям свободной энергии Гиббса для общей окислительно-восстановительной реакции. Донор → Акцептор.
Отдельные бактерии используют несколько цепей переноса электронов, часто одновременно. Бактерии могут использовать ряд различных доноров электронов, ряд различных дегидрогеназ, ряд различных оксидаз и редуктаз, а также ряд различных акцепторов электронов. Например, Кишечная палочка (при аэробном росте с использованием глюкозы в качестве источника энергии) использует две разные НАДН-дегидрогеназы и две разные хинолоксидазы, в общей сложности четыре различных цепи переноса электронов, работающих одновременно.
Общей чертой всех цепей переноса электронов является наличие протонного насоса для создания электрохимического градиента над мембраной. Бактериальные цепи переноса электронов могут содержать до трех протонных насосов, таких как митохондрии, или они могут содержать только один или два. В них всегда есть хотя бы один протонный насос.
Доноры электронов
В современной биосфере наиболее распространенными донорами электронов являются органические молекулы. Организмы, которые используют органические молекулы в качестве источника электронов, называются органотрофы. Органотрофы (животные, грибы, простейшие) и фототрофы (растения и водоросли) составляют подавляющее большинство всех известных форм жизни.
Некоторые прокариоты могут использовать неорганические вещества в качестве источника энергии. Такой организм называется литотроф («рок-людоед»). Неорганические доноры электронов включают водород, оксид углерода, аммиак, нитрит, серу, сульфид, оксид марганца и двухвалентное железо. Литотрофы были обнаружены растущими в скальных образованиях на тысячи метров ниже поверхности Земли. Из-за своего объема распространения литотрофы могут фактически превосходить по численности органотрофы и фототрофы в нашей биосфере.
Использование неорганических доноров электронов в качестве источника энергии представляет особый интерес для изучения эволюции. Этот тип метаболизма должен логически предшествовать использованию органических молекул в качестве источника энергии.
Комплекс I и II
Бактерии могут использовать ряд различных доноров электронов. Когда органическое вещество является источником энергии, донором может быть НАДН или сукцинат, и в этом случае электроны входят в цепь переноса электронов через НАДН-дегидрогеназу (аналогично Комплекс I в митохондриях) или сукцинатдегидрогеназой (аналогично Комплекс II). Другие дегидрогеназы могут использоваться для обработки различных источников энергии: формиатдегидрогеназа, лактатдегидрогеназа, глицеральдегид-3-фосфатдегидрогеназа, H2 дегидрогеназа (гидрогеназа ), электронная транспортная цепь. Некоторые дегидрогеназы также являются протонными насосами; другие направляют электроны в хиноновый пул. Большинство дегидрогеназ демонстрируют индуцированную экспрессию в бактериальной клетке в ответ на метаболические потребности, вызванные средой, в которой клетки растут. В случае лактатдегидрогеназы в кишечной палочке фермент используется аэробно и в сочетании с другими дегидрогеназами. Он индуцируется и экспрессируется, когда в клетке присутствует высокая концентрация DL-лактата.[нужна цитата ]
Носители хинона
Хиноны являются мобильными жирорастворимыми носителями, которые перемещают электроны (и протоны) между большими, относительно неподвижными макромолекулярными комплексами, встроенными в мембрану. Использование бактерий убихинон (Коэнзим Q, тот же хинон, который используют митохондрии) и родственные хиноны, такие как менахинон (Витамин К2). Археи в роду Сульфолобус используйте кальдариеллахинон.[16] Использование различных хинонов связано с незначительным изменением окислительно-восстановительных потенциалов. Эти изменения окислительно-восстановительного потенциала вызваны изменениями в структуре хинона. Изменение окислительно-восстановительных потенциалов этих хинонов может соответствовать изменениям в акцепторах электронов или вариациям окислительно-восстановительных потенциалов в бактериальных комплексах.[17]
Протонные насосы
А протонный насос любой процесс, создающий протонный градиент через мембрану. Протоны можно физически перемещать через мембрану; это видно в митохондриальной Комплексы I и IV. Тот же эффект может быть получен при движении электронов в противоположном направлении. Результатом является исчезновение протона из цитоплазмы и появление протона в периплазме. Митохондриальный Комплекс III использует второй тип протонного насоса, который опосредуется хиноном ( Q цикл ).
Некоторые дегидрогеназы являются протонными насосами; другие нет. Большинство оксидаз и редуктаз являются протонными насосами, но некоторые - нет. Цитохром до н.э1 протонная помпа, обнаруженная во многих, но не во всех, бактериях (не Кишечная палочка). Как следует из названия, бактериальный до н.э1 похож на митохондриальную до н.э1 (Комплекс III).
Цитохромные переносчики электронов
Цитохромы пигменты, содержащие железо. Они находятся в двух очень разных средах.
Некоторые цитохромы представляют собой водорастворимые носители, которые переносят электроны к крупным неподвижным макромолекулярным структурам, встроенным в мембрану, и от них. Мобильным переносчиком электронов цитохрома в митохондриях является цитохром. c. Бактерии используют ряд различных мобильных переносчиков электронов цитохрома.
Другие цитохромы находятся внутри макромолекул, таких как Комплекс III и Комплекс IV. Они также действуют как переносчики электронов, но в совершенно ином, внутримолекулярном, твердотельном окружении.
Электроны могут входить в цепь переноса электронов на уровне мобильного цитохрома или хинонового носителя. Например, электроны от неорганических доноров электронов (нитрита, двухвалентного железа, цепи переноса электронов) входят в цепь переноса электронов на уровне цитохрома. Когда электроны входят с окислительно-восстановительным уровнем выше, чем НАДН, цепь переноса электронов должна работать в обратном направлении, чтобы произвести эту необходимую молекулу с более высокой энергией.
Терминальные оксидазы и редуктазы
Когда бактерии растут аэробный среды, терминальный акцептор электронов (O2) превращается в воду ферментом, называемым оксидаза. Когда бактерии растут анаэробный В окружающей среде концевой акцептор электронов восстанавливается ферментом, называемым редуктазой. В митохондриях терминальный мембранный комплекс (Комплекс IV) - цитохромоксидаза. Аэробика бактерии используют ряд различных терминальных оксидаз. Например, Кишечная палочка (факультативный анаэроб) не имеет цитохромоксидазы или до н.э1 сложный. В аэробных условиях он использует две разные терминальные хинолоксидазы (оба протонных насоса) для восстановления кислорода до воды.
Бактериальный комплекс IV можно разделить на классы в зависимости от того, какие молекулы действуют как концевые акцепторы электронов. Оксидазы класса I являются цитохромоксидазами и используют кислород в качестве концевого акцептора электронов. Оксидазы класса II являются хинолоксидазами и могут использовать различные концевые акцепторы электронов. Оба эти класса можно разделить на категории в зависимости от того, какие окислительно-восстановительные активные компоненты они содержат. Например. Концевые оксидазы гема aa3 класса 1 намного более эффективны, чем концевые оксидазы класса 2[1]
Анаэробные бактерии, которые не используют кислород в качестве концевого акцептора электронов, имеют концевые редуктазы, индивидуализированные для их концевого акцептора. Например, Кишечная палочка можно использовать фумаратредуктазу, нитратредуктазу, нитритредуктазу, ДМСО редуктазу или триметиламин-N-оксидредуктазу, в зависимости от доступности этих акцепторов в окружающей среде.
Большинство терминальных оксидаз и редуктаз индуцируемый. Они синтезируются организмом по мере необходимости в ответ на определенные условия окружающей среды.
Акцепторы электронов
Так же, как существует ряд различных доноров электронов (органическое вещество у органотрофов, неорганическое вещество у литотрофов), существует ряд различных акцепторов электронов, как органических, так и неорганических. У аэробных бактерий и факультативных анаэробов, если кислород доступен, он неизменно используется в качестве конечного акцептора электронов, потому что он генерирует наибольшее изменение свободной энергии Гиббса и производит наибольшее количество энергии.[18]
В анаэробной среде используются различные акцепторы электронов, включая нитраты, нитриты, трехвалентное железо, сульфат, диоксид углерода и небольшие органические молекулы, такие как фумарат.
Фотосинтетический
В окислительного фосфорилирования, электроны передаются от донора низкоэнергетических электронов, такого как НАДН, к акцептору, например O2) через цепь переноса электронов. В фотофосфорилирование, энергия солнечного света используется для Создайте донор электронов высокой энергии, который впоследствии может восстанавливать окислительно-восстановительные активные компоненты. Затем эти компоненты связываются с синтезом АТФ посредством транслокации протонов по цепи переноса электронов.[8]
Фотосинтетические цепи переноса электронов, подобно митохондриальной цепи, можно рассматривать как частный случай бактериальных систем. Они используют подвижные липидорастворимые хиноновые носители (филлохинон и пластохинон ) и подвижные водорастворимые носители (цитохромы, электронная транспортная цепь.). Они также содержат протонный насос. Протонная помпа в все фотосинтетические цепи напоминают митохондриальные Комплекс III. Распространенная теория симбиогенез считает, что обе органеллы произошли от бактерий.
Смотрите также
Рекомендации
- ^ а б Анраку Й (июнь 1988 г.). «Бактериальные электронно-транспортные цепи». Ежегодный обзор биохимии. 57 (1): 101–32. Дои:10.1146 / annurev.bi.57.070188.000533. PMID 3052268.
- ^ Kracke F, Василев I, Krömer JO (2015). «Микробный перенос электронов и сохранение энергии - основа для оптимизации биоэлектрохимических систем». Границы микробиологии. 6: 575. Дои:10.3389 / fmicb.2015.00575. ЧВК 4463002. PMID 26124754.
- ^ Вальденстрём Дж. Г. (24 апреля 2009 г.). "Биохимия. Люберт Страйер". Acta Medica Scandinavica. 198 (1–6): 436. Дои:10.1111 / j.0954-6820.1975.tb19571.x. ISSN 0001-6101.
- ^ Зорова Л.Д., Попков В.А., Плотников Е.Ю., Силачев Д.Н., Певзнер И.Б., Янкаускас С.С. и др. (Июль 2018). «Митохондриальный мембранный потенциал». Аналитическая биохимия. 552: 50–59. Дои:10.1016 / j.ab.2017.07.009. ЧВК 5792320. PMID 28711444.
- ^ Лорен, Биохимия, Джонсон / Коул, 2010 г., стр. 598-611.
- ^ Гарретт и Гришем, Биохимия, Брукс / Коул, 2010, стр 598-611
- ^ Гарретт Р., Гришэм С.М. (2016). биохимия. Бостон: Cengage. п. 687. ISBN 978-1-305-57720-6.
- ^ а б Страйер. Биохимия. топпан. OCLC 785100491.
- ^ Йонкхере А.И., Смейтинк Дж. А., Роденбург Р. Дж. (Март 2012 г.). «Митохондриальная АТФ-синтаза: архитектура, функции и патология». Журнал наследственных метаболических заболеваний. 35 (2): 211–25. Дои:10.1007 / s10545-011-9382-9. ЧВК 3278611. PMID 21874297.
- ^ а б Гарретт Р.Х., Гришем К.М. (2012). Биохимия (5-е изд.). Cengage обучение. п. 664. ISBN 978-1-133-10629-6.
- ^ Fillingame RH, Angevine CM, Дмитриев OY (ноябрь 2003 г.). «Механика взаимодействия протонных движений с вращением c-кольца в АТФ-синтазе». Письма FEBS. 555 (1): 29–34. Дои:10.1016 / S0014-5793 (03) 01101-3. PMID 14630314.
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (01.01.2002). «Протонный градиент стимулирует синтез АТФ». Цитировать журнал требует
| журнал =(помощь) - ^ Cannon B, Nedergaard J (январь 2004 г.). «Коричневая жировая ткань: функция и физиологическое значение». Физиологические обзоры. 84 (1): 277–359. Дои:10.1152 / физрев.00015.2003. PMID 14715917.
- ^ Ким Б. Х., Гадд GM (2008). «Введение в бактериологию и метаболизм». Бактериальная физиология и метаболизм. Издательство Кембриджского университета. С. 1–6. Дои:10.1017 / cbo9780511790461.002. ISBN 978-0-511-79046-1.
- ^ Миллс Э.Л., Келли Б., Логан А., Коста А.С., Варма М., Брайант С.Э. и др. (Октябрь 2016 г.). «Сукцинатдегидрогеназа поддерживает метаболическое преобразование митохондрий для управления воспалительными макрофагами». Клетка. 167 (2): 457–470.e13. Дои:10.1016 / j.cell.2016.08.064. ЧВК 5863951. PMID 27667687.
- ^ EC 1.3.5.1
- ^ Ingledew WJ, Poole RK (сентябрь 1984 г.). «Дыхательные цепи кишечной палочки». Микробиологические обзоры. 48 (3): 222–71. Дои:10.1128 / mmbr.48.3.222-271.1984. ЧВК 373010. PMID 6387427.
- ^ Шмидт-Рор К. (февраль 2020 г.). «Кислород - высокоэнергетическая молекула, питающая сложную многоклеточную жизнь: фундаментальные поправки к традиционной биоэнергетике». СКУД Омега. 5 (5): 2221–2233. Дои:10.1021 / acsomega.9b03352. ЧВК 7016920. PMID 32064383.
дальнейшее чтение
- Фенчел Т., King GM, Blackburn TH (сентябрь 2006 г.). Бактериальная биогеохимия: экофизиология круговорота минералов (2-е изд.). Эльзевир. ISBN 978-0-12-103455-9.
- Ленгелер JW (январь 1999 г.). Дрюс Джи; Schlegel HG (ред.). Биология прокариот. Blackwell Science. ISBN 978-0-632-05357-5.
- Нельсон Д.Л., Кокс М.М. (апрель 2005 г.). Принципы биохимии Ленингера (4-е изд.). В. Х. Фриман. ISBN 978-0-7167-4339-2.
- Николлс Д.Г., Фергюсон С.Дж. (июль 2002 г.). Биоэнергетика 3. Академическая пресса. ISBN 978-0-12-518121-1.
- Штумм W; Морган Дж. Дж. (1996). Водная химия (3-е изд.). Джон Уайли и сыновья. ISBN 978-0-471-51185-4.
- Тауер Р.К., Юнгерманн К., Деккер К. (март 1977 г.). «Энергосбережение у хемотрофных анаэробных бактерий». Бактериологические обзоры. 41 (1): 100–80. Дои:10.1128 / MMBR.41.1.100-180.1977. ЧВК 413997. PMID 860983.
- Белый D (сентябрь 1999 г.). Физиология и биохимия прокариот (2-е изд.). Oxford University Press. ISBN 978-0-19-512579-5.
- Voet D, Voet JG (март 2004 г.). Биохимия. Биохимическое образование. 28 (3-е изд.). Джон Уайли и сыновья. стр.124. Дои:10.1016 / s0307-4412 (00) 00032-7. ISBN 978-0-471-58651-7. PMID 10878303.
- Ким Х.С., Патель К., Малдун-Джейкобс К., Бишт К.С., Эйкин-Бернс Н., Пеннингтон Дж. Д. и др. (Январь 2010 г.). «SIRT3 - это локализованный в митохондриях опухолевый супрессор, необходимый для поддержания целостности митохондрий и метаболизма во время стресса». Раковая клетка. 17 (1): 41–52. Дои:10.1016 / j.ccr.2009.11.023. ЧВК 3711519. PMID 20129246.
внешняя ссылка
- Электрон + Транспорт + Цепь + Комплекс + Белки в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Ханская академия, видеолекция








