Дисульфит - Disulfite
 | |
| Имена | |
|---|---|
| Название ИЮПАК дисульфит[1] | |
| Систематическое название ИЮПАК пентаоксидо-1κ3О,2κ2О-дисульфат (S — S) (2-)[1] | |
| Другие имена метабисульфит-ион пиросульфит | |
| Идентификаторы | |
3D модель (JSmol ) | |
PubChem CID | |
| |
| Характеристики | |
| S 2О2− 5 | |
| Конъюгированная кислота | Сернистая кислота |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
А дисульфит, широко известный как метабисульфит или же пиросульфит, это химическое соединение содержащий ион S
2О2−
5. Это бесцветный дианион, который продается в основном в форме метабисульфит натрия или же метабисульфит калия. При растворении в воде эти соли выделяют бисульфит. HSO−
3 ион. Эти соли действуют аналогично бисульфит натрия или же бисульфит калия.[2]
Структура
В отличие от дисульфат (S
2О2−
7), дисульфит-ион (S
2О2−
5) имеет несимметричную структуру со связью S-S. Степень окисления атома серы, связанного с 3 атомами кислорода, составляет +5, в то время как степень окисления другого атома серы составляет +3.[3]
Анион состоит из SO2 группа связана с SO3 группа с отрицательным зарядом, более локализованным на SO3 конец. Длина связи S – S составляет 2,22 Å, а расстояния S – O «тионата» и «тионита» составляют 1,46 и 1,50 Å соответственно.[4]
Производство
Соли дисульфит-иона получают дегидратацией солей бисульфит ион (HSO−
3). Когда решения бисульфит натрия или же бисульфит калия испаряются, метабисульфит натрия и метабисульфит калия результат.[5]
- 2 HSO−
3 S
S
2О2−
5 + H2О
Хотя равновесие находится далеко влево, при испарении бисульфитной соли образуется значительное количество дисульфита.[6]
Дисульфит - сопряженное основание сернистая кислота (пиросернистая кислота), которая происходит из сернистая кислота в соответствии с приведенной выше реакцией дегидратации:
- 2 ч2ТАК3 → 2 HSO−
3 + 2 часа+ → H2S2О5 + H2О
Дисульфит-ион также возникает из-за добавления диоксид серы к сульфит ион:
| HSO− 3 3 + H+ ТАК32− + ТАК2 2О2− 5 | 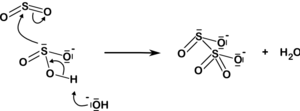 |
Использовать
Соли дисульфитов используются для консервирование еды и напитков.
Примеры дисульфитов
- Метабисульфит натрия (E223 ) и метабисульфит калия (E224) используются как консервант и антиоксидант в еде.
Рекомендации
- ^ а б Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005 г.). Кембридж (Великобритания): RSC –ИЮПАК. ISBN 0-85404-438-8. п. 130. Электронная версия.
- ^ Джонстон, Х. Ф. (1946). «Сульфиты и пиросульфиты щелочных металлов». Неорганические синтезы. 2: 162–167. Дои:10.1002 / 9780470132333.ch49. ISBN 9780470132333.
- ^ Lindqvist, I .; Мёрцель, М. «Структура пиросульфита калия и природа иона пиросульфита». Acta Crystallogr. (1957". 10: 406–409. Дои:10.1107 / S0365110X57001322. Цитировать журнал требует
| журнал =(помощь) - ^ К. Л. Картер, Т. А. Сиддик, К. Л. Мерфи, Д. В. Беннетт «Удивительно неуловимая кристаллическая структура метабисульфита натрия» Acta Crystallogr. (2004). B60, 155–162. Дои:10.1107 / S0108768104003325
- ^ Барбера, Хосе Хименес; Мецгер, Адольф; Вольф, Манфред (2000). "Сульфиты, тиосульфаты и химия дитионитов". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a25_477.
- ^ Бассам З. Шахашири: Химические демонстрации: пособие для учителей химии University of Wisconsin Press, 1992, стр.9.
