Реакция Норриша - Norrish reaction
В Реакция Норриша в органическая химия описывает фотохимические реакции происходит с кетоны и альдегиды. Этот тип реакции подразделяется на Реакции Норриша I типа и Реакции Норриша типа II.[1] Реакция названа в честь Рональд Джордж Рэйфорд Норриш. Хотя эти реакции имеют ограниченную синтетическую ценность, они важны для фотоокисление полимеров Такие как полиолефины,[2] определенный поликарбонаты и поликетоны.
Тип I
Реакция Норриша типа I представляет собой фотохимическое расщепление или гомолиз альдегидов и кетонов на два свободный радикал промежуточные продукты (α-разрыв). Карбонильная группа принимает фотон и является в восторге к фотохимическому синглетное состояние. Через межсистемный переход то триплетное состояние может быть получен. На расщеплении α-углерод связи из любого состояния, получаются два радикальных фрагмента.[3] Размер и природа этих фрагментов зависит от стабильности образующихся радикалов; например, расщепление 2-бутанон в основном дает этильные радикалы в пользу менее стабильных метильных радикалов.[4]
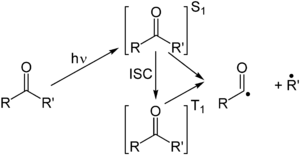
Для этих фрагментов открыты несколько режимов вторичной реакции в зависимости от точной молекулярной структуры.
- Фрагменты могут просто рекомбинировать с исходным карбонильным соединением с рацемизация у α-углерода.
- Ацильный радикал может потерять молекулу монооксид углерода, образуя новый углеродный радикал на другом α-углероде, с последующим образованием новой углерод-углеродной связи между радикалами.[3] Конечным результатом является простое извлечение карбонильного звена из углеродной цепи. Скорость и выход этого продукта зависит от энергия диссоциации связи кетонов α заместители. Обычно чем больше α-замещенных кетонов, тем больше вероятность, что реакция будет давать продукты таким образом.[5][6]
- Абстракция α-протон из карбонильного фрагмента может образовывать кетен и алкан.
- Отрыв β-протона от алкильного фрагмента может образовывать альдегид и алкен.

Синтетическая полезность этого типа реакции ограничена, например, она часто побочная реакция в Реакция Патерно – Бючи. Один органический синтез в основе этой реакции лежит реакция бициклогексилидена.[7]
Тип II
Реакция Норриша типа II - фотохимическая внутримолекулярный абстракция γ-водород (атом водорода в трех положениях углерода, удаленных от карбонильной группы) возбужденным карбонильным соединением с образованием 1,4-бирадикал как основной фотопродукт.[8] Норриш впервые сообщил о реакции в 1937 году.[9]

Происходящие вторичные реакции - это фрагментация (β-разрыв) с образованием алкен и энол (что быстро таутомериза к карбонилу), или внутримолекулярная рекомбинация двух радикалов с замещенным циклобутан (в Реакция Норриша-Янга).[10]
Объем
Реакция Норриша была изучена в отношении химия окружающей среды относительно фотолиза альдегид гептанальный, заметное соединение в атмосфере Земли.[11] Фотолиз гептаналя в условиях, напоминающих атмосферные, приводит к образованию 1-пентен и ацетальдегид в 62% химический выход вместе с циклическими спиртами (циклобутанолы и циклопентанолы ) как из канала Норриша типа II, так и около 10% выхода гексаналь из канала Норриша типа I (первоначально образовавшийся н-гексильный радикал, атакованный кислородом).
В одном исследовании [12] фотолиз Ацилоин производное в воде в присутствии тетрахлораурат водорода (HAuCl4) сгенерировано нанозолото частицы с 10 нанометр диаметр. Виды, которые считаются ответственными за восстановление Au3+ в Au0 [13] порожден Норриш кетил радикальный.

Paquette синтез 1982 года додекаэдран включает три отдельные реакции типа Норриша в своей приблизительно 29-ступенчатой последовательности.
Пример синтетически полезной реакции Норриша типа II можно найти на ранних этапах полного синтеза биологически активных карденолид уабагенин Баран и коллеги.[14] Оптимизированные условия минимизируют побочные реакции, такие как конкурирующий путь Норриша типа I, и обеспечивают получение желаемого промежуточного продукта с хорошим выходом в масштабе нескольких граммов.

Смотрите также
- Перестановка фото-фри - родственная реакция ароматических карбонилов
- Перестановка Маклафферти
- Молекулы, выделяющие окись углерода
Рекомендации
- ^ Именованные органические реакции, 2-е издание, Томас Лауэ и Андреас Плагенс, John Wiley & Sons: Чичестер, Англия, Нью-Йорк, 2005. 320 стр. ISBN 0-470-01041-X
- ^ Граузе, Гвидо; Цзянь, Мэй-Фанг; Иноуэ, Тихиро (ноябрь 2020 г.). «Изменения при выветривании полиолефинов». Разложение и стабильность полимера. 181: 109364. Дои:10.1016 / j.polymdegradstab.2020.109364.
- ^ а б "Золотая книга ИЮПАК - фотореакция Норриша Типа I.". ИЮПАК. 24 февраля 2014 г. Дои:10.1351 / goldbook.N04219. Получено 31 марта 2014. Цитировать журнал требует
| журнал =(помощь) - ^ Blacet, F.E .; Н. Питтс-младший, Джеймс (1950). "Фотохимические процессы метилэтилкетона". Журнал Американского химического общества. 72 (6): 2810–2811. Дои:10.1021 / ja01162a544.
- ^ Ян, Ниен-Чу; Д. Фейт, Юджин; Хуэй, человек его; Турро, Николас Дж .; Далтон, Кристофер (1970). «Фотохимия ди-трет-бутилкетона и структурные эффекты на скорость и эффективность межсистемного пересечения алифатических кетонов». Журнал Американского химического общества. 92 (23): 6974–6976. Дои:10.1021 / ja00726a046.
- ^ Abuin, E.B .; Encina, M.V .; Лисси, Э.А. (1972). «Фотолиз 3-пентанона». Журнал фотохимии. 1 (5): 387–396. Дои:10.1016/0047-2670(72)80036-4.
- ^ Бициклогексилиден Николас Дж. Турро, Питер А. Лермакерс и Джордж Ф. Веслей Органический синтез, Сб. Vol. 5, стр.297 (1973); Vol. 47, стр.34 (1967) Интернет-статья.
- ^ "Золотая книга ИЮПАК - фотореакция Норриша Тип II". ИЮПАК. 24 февраля 2014 г. Дои:10.1351 / goldbook.N04218. Получено 31 марта 2014. Цитировать журнал требует
| журнал =(помощь) - ^ Norrish, R.G.W .; Бэмфорд, К. Х. (31 июля 1937 г.). «Фоторазложение альдегидов и кетонов». Природа. 140 (3535): 195–6. Bibcode:1937Натура.140..195Н. Дои:10.1038 / 140195b0. S2CID 4104669.
- ^ "Золотая книга ИЮПАК - реакция Норриша-Янга". ИЮПАК. 24 февраля 2014 г. Дои:10.1351 / goldbook.NT07427. Получено 31 марта 2014. Цитировать журнал требует
| журнал =(помощь) - ^ Фотолиз гептанала Сюзанна Э. Полсон, Де-Линг Лю, Гражина Э. Ожеховска, Луис М. Кампос и К. Н. Хук J. Org. Chem.; 2006; 71 (17) pp 6403–6408; (Статья) Дои:10.1021 / jo060596u
- ^ Легкий фотохимический синтез незащищенных водных наночастиц золота Кэтрин Л. Макгилврей, Мэтью Р. Декан, Дашан Ван и Хуан С. Скайано Варенье. Chem. Soc.; 2006; 128 (50) стр. 15980–15981; (Коммуникация) Дои:10.1021 / ja066522h
- ^ Технически Au3+ сводится к Au2+ который затем образует Au+ и Au3+ к непропорциональность с последующим окончательным восстановлением Au1+ в Auо
- ^ Renata, H .; Чжоу, Q .; Баран П.С. (3 января 2013 г.). «Стратегическое реле окислительно-восстановительного потенциала обеспечивает масштабируемый синтез уабагенина, биоактивного карденолида». Наука. 339 (6115): 59–63. Bibcode:2013Наука ... 339 ... 59R. Дои:10.1126 / наука.1230631. ЧВК 4365795. PMID 23288535.
