Молекулы, выделяющие окись углерода - Carbon monoxide-releasing molecules - Wikipedia
Молекулы, выделяющие окись углерода (CORM) представляют собой химические соединения, предназначенные для высвобождения контролируемых количеств монооксид углерода (CO). CORM разрабатываются как потенциальные терапевтические агенты для локальной доставки CO к клеткам и тканям, таким образом преодолевая ограничения протоколов ингаляции CO.[1]
CO наиболее известен своей токсичностью в отравление угарным газом в высоких дозах. Однако CO входит в число эндогенных газообразные сигнальные молекулы а низкая доза CO связана с терапевтическими преимуществами. Доклинические исследования были сосредоточены на CO противовоспалительное средство деятельность со значительными приложениями в сердечно-сосудистых заболеваниях, онкологии, хирургии трансплантата и нейропротекции.[2]
Большая часть CO, продуцируемого млекопитающими, возникает в результате разложения гем тремя изоформами гемоксигеназа, при этом HO-1 индуцируется окислительный стресс, CO и массив ксенобиотики.[3] HO-2 и HO-3 являются конститутивными. Другие эндогенные источники могут включать перекисное окисление липидов,[4]
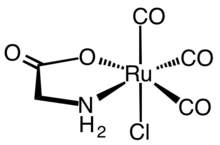
Ферментативная реакция гемоксигеназы вдохновила на разработку синтетических CORM. Первые синтетические CORM обычно карбонильные комплексы металлов. Репрезентативным CORM, широко охарактеризованным как с биохимической, так и с фармакологической точки зрения, является комплекс рутения (II) Ru (глицинат ) Cl (CO)3, широко известный как CORM-3.
Классификации CORM
Самый простой источник CO - из реакция горения через источники записи, такие как ископаемое топливо или же дрова. Источники, выделяющие CO при термическое разложение или сгорание обычно не считаются CORM.
Переходные металлические CORM
Большинство терапевтически значимых CORM представляют собой комплексы переходных металлов, главным образом на основе утюг, молибден, рутений, марганец, кобальт, и рений
PhotoCORMs
Высвобождение CO из агентов-носителей можно вызвать фотохимически. Эти носители называются фотоКОРМами и включают как комплексы металлов, так и не содержащие металлов (органический ) соединения различных структурных мотивов, которые можно рассматривать как особый тип фотолабильная защитная группа.
ET-CORM
CORM, запускаемые ферментами (ET-CORM), были разработаны для улучшения селективной локальной доставки CO. Некоторые ET-CORM пролекарства активируются эстераза ферменты для сайт-специфического высвобождения CO.[5]
Органические CORM
Органические небольшие молекулы разрабатываются для преодоления ограничений токсичности неорганических CORM. Метиленхлорид был первым органическим CORM, вводимым перорально на основании предыдущих отчетов о карбоксигемоглобин образование через метаболизм. Второй органический CORM, CORM-A1 (боранокарбонат натрия), был разработан на основе отчета 1960-х годов о выделении CO из боранокарбоната калия.
В 2003 году циклические оксоуглероды были предложены в качестве источника терапевтического CO, включая дельтовая кислота, квадратная кислота, кроконовая кислота, и родизоновая кислота и их соли.
Органические пролекарства CO
В последние годы наблюдается рост интереса к органическим пролекарствам CO из-за необходимости учитывать вопросы разработки лекарственных средств при разработке терапевтических средств на основе CO (Ji, X; Damera, K .; Zheng, Y .; Yu, B .; Otterbein, LE; и Ван Б. «К терапевтическим средствам на основе окиси углерода: важнейшие вопросы доставки лекарств и разработки» J. Pharm. Sci. 2016, 105, 406-416. PMID: 26869408). Эти пролекарства CO имеют регулируемую скорость высвобождения, триггерное высвобождение и способность высвобождать более одной полезной нагрузки из одного пролекарства (Ji. X .; Wang, B. «Стратегии в отношении пролекарств органического монооксида углерода» Acc. Chem. Res. 2018, 51, 1377-85. PMID: 29762011).
Ферментные гибриды
На основе синергизма гемоксигеназа системы и доставки CO, появился новый класс молекулярных гибридов-CORM (HYCO), состоящий из соединенных HO-1 индуктор и виды CORM. Один такой HYCO включает диметилфумарат фрагмент, который активирует NRF2 чтобы тем самым индуцировать HO-1, в то время как часть CORM также высвобождает CO.
Материалы, выделяющие окись углерода
Материалы, высвобождающие монооксид углерода (CORMA), по сути, представляют собой новые лекарственные формы и платформы для доставки лекарств, которые появились для преодоления фармацевтических ограничений большинства видов CORM.[6] Образцовая CORMA, разработанная Хаббеллом, состоит из формулировки мицеллы приготовлено из триблока сополимеры с объектом CORM, который запускается для выпуска путем добавления цистеин. Другие высвобождающие CO каркасы включают: полимеры, пептиды, кремнезем наночастицы, наноалмаз, магнитные наночастицы, нановолокно гель, металлодендримеры, и конъюгаты CORM-белок (макромолекула).[7][8]
Инфузия карбоксигемоглобина
Карбоксигемоглобин могут быть введены для доставки CO. Наиболее распространенные подходы основаны на полиэтиленгликоль (ПЭГ) -глированный бык карбоксигемоглобин и малеимид Карбоксигемоглобин человека, конъюгированный с ПЭГ.
Порфирины
Порфирин структуры, такие как гем, гемин, и металлический протопорфирин IX (PPIX) аналоги (такие как PPIX кобальта) были развернуты, чтобы вызвать гемоксигеназа и впоследствии подвергаются биотрансформации с высвобождением CO, неорганического иона и биливердин /билирубин.[9] Некоторые аналоги PPIX, такие как банка PPIX, мезопорфирин олова и цинк PPIX, являются гемоксигеназа ингибиторы.
Эндогенный CO
В конце 1960-х Тенхунен продемонстрировал ферментативную реакцию катаболизма гема.[10] тем самым определяя гемоксигеназа (HO) фермент. HO является основным источником эндогенного образования CO, хотя в последние годы были выявлены и другие второстепенные участники. CO образуется в организме человека со скоростью 16,4 мкмоль / час, ~ 86% происходит из гема через гемоксигеназу и ~ 14% из негемовых источников, включая фотоокисление, перекисное окисление липидов и ксенобиотики.[11] Среднее карбоксигемоглобин Уровень (CO-Hb) у некурящих составляет от 0,2% до 0,85% CO-Hb (тогда как у курильщика может быть от 4% до 10% CO-Hb),[12] хотя географическое положение, род занятий, здоровье и поведение вносят вклад в переменные.
Ферменты
Гемоксигеназа
Гемоксигеназа (HO) - гемсодержащий член белок теплового шока (HSP) семейство, идентифицированное как HSP32. На сегодняшний день идентифицированы три изоформы HO, включая индуцированный стрессом HO-1 и конститутивные HO-2 и HO-3. HO-1 считается белком спасения клетки, который индуцируется в ответ на окислительный стресс и многочисленные болезненные состояния. Кроме того, HO-1 индуцируется бесчисленным количеством молекул, включая статины, гемин, и натуральные продукты.[13]
HO катализирует разложение гема до биливердин /билирубин, иона двухвалентного железа и CO. Хотя H2O присутствует во всем организме, он обладает значительной активностью в селезенка в деградации гемоглобин в течение эритроцит рециклинг (0,8% пула эритроцитов в день), на который приходится ~ 80% эндогенного производства CO, происходящего из гема. Большая часть оставшихся 20% продуцирования CO, получаемого из гема, связана с печеночным катаболизмом гемопротеины (миоглобин, цитохромы, каталаза, пероксидазы, растворимая гуанилатциклаза, синтаза оксида азота ) и неэффективные эритропоэз в Костный мозг.[14][15]
Перекисное окисление липидов
Образование СО из липид перекисное окисление впервые был зарегистрирован в конце 1960-х годов и считается второстепенным источником эндогенного образования CO.[16][17]
Фармакология СО
Монооксид углерода один из трех газообразные сигнальные молекулы рядом оксид азота и сероводород. Эти газы вместе называются газопередатчики.
Сигнализация
Первое свидетельство того, что CO является сигнальной молекулой, было обнаружено при наблюдении за CO, стимулирующим растворимая гуанилатциклаза и последующие циклический гуанозинмонофосфат (cGMP), чтобы служить сосудорасширяющее средство в сосудистый гладкомышечные клетки.[18] В противовоспалительное средство эффекты CO приписываются активации p38 митоген-активированная протеинкиназа (MAPK) путь. Хотя CO обычно взаимодействует с атомом железа гема в гемопротеин, было продемонстрировано, что CO активирует кальций-зависимые калиевые каналы, вступая в водородные связи с поверхностными остатками гистидина.
CO оказывает ингибирующее действие на многие белки, включая цитохром P450[19] и цитохром с оксидаза
CO является модулятором ионных каналов, оказывая как возбуждающее, так и ингибирующее действие на многочисленные классы ионных каналов, такие как потенциалзависимые кальциевые каналы.
Распределение
CO имеет примерно в 210 раз большее сродство к гемоглобин чем кислород.[20] Равновесие константа диссоциации для реакции Hb-CO ⇌ Hb + CO сильно способствует комплексу CO, поэтому высвобождение CO для легочной экскреции занимает некоторое время.
Основываясь на этой аффинности связывания, кровь по существу является необратимым стоком для CO и представляет собой терапевтическую проблему для доставки CO к клеткам и тканям.
Метаболизм
CO считается инертным в организме и в первую очередь подвергается легочный экскреция и окисляется менее 10%.[21]
Рекомендации
- ^ Motterlini R, Otterbein LE (сентябрь 2010 г.). «Лечебный потенциал окиси углерода». обзорная статья. Обзоры природы. Открытие наркотиков. 9 (9): 728–43. Дои:10.1038 / nrd3228. PMID 20811383.
- ^ Махан В.Л. (декабрь 2012 г.). «Нейропротекторное, нейротерапевтическое и нейрометаболическое действие окиси углерода». обзорная статья. Медицинские газовые исследования. 2 (1): 32. Дои:10.1186/2045-9912-2-32. ЧВК 3599315. PMID 23270619.
- ^ Феррандис ML, Девеса I (2008). «Индукторы гемоксигеназы-1». обзорная статья. Текущий фармацевтический дизайн. 14 (5): 473–86. Дои:10.2174/138161208783597399. PMID 18289074.
- ^ Уилкинсон WJ, Кемп PJ (июль 2011 г.). «Окись углерода: новый регулятор ионных каналов». обзорная статья. Журнал физиологии. 589 (Пт 13): 3055–62. Дои:10.1113 / jphysiol.2011.206706. ЧВК 3145923. PMID 21521759.
- ^ Различный дизайн молекул, выделяющих CO (ET-CORM), запускаемых ферментами, выявляет количественные различия в биологической активности с точки зрения токсичности и воспаления. Stamellou E, Storz D, Botov S, Ntasis E, Wedel J, Sollazzo S, Krämer BK, van Son W., Seelen M, Schmalz HG, Schmidt A, Hafner M, Yard BA, Redox Biol. 2014 5 июня; 2: 739-48. DOI: 10.1016 / j.redox.2014.06.002. Электронная коллекция 2014 г.
- ^ Хайнеманн С.Х., Хоши Т., Вестерхаузен М., Шиллер А. (апрель 2014 г.). «Окись углерода - физиология, обнаружение и контролируемое высвобождение». обзорная статья. Chemical Communications (Кембридж, Англия). 50 (28): 3644–60. Дои:10.1039 / c3cc49196j. ЧВК 4072318. PMID 24556640.
- ^ Нгуен Д., Бойер С. (сентябрь 2015 г.). «Каркасы из макромолекулярных и неорганических наноматериалов для доставки монооксида углерода: последние разработки и будущие тенденции». обзорная статья. ACS Biomaterials Science & Engineering. 1 (10): 895–913. Дои:10.1021 / acsbiomaterials.5b00230.
- ^ Kautz AC, Kunz PC, Janiak C (ноябрь 2016 г.). «Системы конъюгатов CO-высвобождающей молекулы (CORM)». обзорная статья. Dalton Transactions. 45 (45): 18045–18063. Дои:10.1039 / c6dt03515a. PMID 27808304.
- ^ Мэнс, Мэриленд (июль 1988 г.). «Гемоксигеназа: функция, множественность, регуляторные механизмы и клиническое применение». обзорная статья. Журнал FASEB. 2 (10): 2557–68. Дои:10.1096 / fasebj.2.10.3290025. PMID 3290025. S2CID 22652094.
- ^ Тенхунен Р., Марвер Х.С., Шмид Р. (декабрь 1969 г.). «Микросомальная гемоксигеназа. Характеристика фермента». основная статья. Журнал биологической химии. 244 (23): 6388–94. PMID 4390967.
- ^ Ван Р, изд. (2001). Окись углерода и сердечно-сосудистые функции. обзорная статья (первое изд.). CRC Press. п. 5. ISBN 978-1-4200-4101-9.
- ^ Том SR (2008). «Глава 15: Патофизиология и лечение угарного газа». В Neuman TS, Thom SR (ред.). Физиология и медицина гипербарической оксигенотерапии. обзорная статья. С. 321–347. Дои:10.1016 / B978-1-4160-3406-3.50020-2. ISBN 978-1-4160-3406-3.
- ^ Correa-Costa M, Otterbein LE (2014). «Ешьте, чтобы лечить: природные индукторы системы гемоксигеназы-1». В Folkerts G, Garssen J (ред.). Фарма-Питание. обзорная статья. Успехи AAPS в серии фармацевтических наук. 12. Спрингер, Чам. С. 243–256. Дои:10.1007/978-3-319-06151-1_12. ISBN 978-3-319-06150-4.
- ^ Lundh B, Johansson MB, Mercke C, Cavallin-Stahl E (декабрь 1972 г.). «Повышение катаболизма гема путем ограничения калорийности у человека». основная статья. Скандинавский журнал клинических и лабораторных исследований. 30 (4): 421–7. Дои:10.3109/00365517209080280. PMID 4639647.
- ^ Бреман Х. Дж., Вонг Р. Дж., Стивенсон Д. К. (30 октября 2001 г.). «Глава 15: Источники, приемники и измерение окиси углерода». В Ван Р (ред.). Окись углерода и сердечно-сосудистые функции. обзорная статья (2-е изд.). CRC Press. ISBN 978-0-8493-1041-6.
- ^ Вольф Д.Г. (декабрь 1976 г.). «Образование окиси углерода при перекисном окислении микросомальных липидов». основная статья. Сообщения о биохимических и биофизических исследованиях. 73 (4): 850–7. Дои:10.1016 / 0006-291X (76) 90199-6. PMID 15625852.
- ^ Нишибаяси Х., Омма Т., Сато Р., Эстабрук Р. В., Окунуки К., Камен М. Д., Секузу И., ред. (1968). Структура и функция цитохромов. обзорная статья. University Park Press. С. 658–665.
- ^ Ким HP, Ryter SW, Choi AM (2006). «СО как клеточная сигнальная молекула». обзорная статья. Ежегодный обзор фармакологии и токсикологии. 46: 411–49. Дои:10.1146 / annurev.pharmtox.46.120604.141053. PMID 16402911.
- ^ Correia MA, Ортис де Монтельяно PR (2005). «Ингибирование ферментов цитохрома Р450». Цитохром P450. обзорная статья. Бостон, Массачусетс: Спрингер. С. 247–322. Дои:10.1007/0-387-27447-2_7. ISBN 978-0-306-48324-0.
- ^ Блюменталь I (июнь 2001 г.). "Отравление угарным газом". обзорная статья. Журнал Королевского медицинского общества. 94 (6): 270–2. Дои:10.1177/014107680109400604. ЧВК 1281520. PMID 11387414.
- ^ Уилбур С., Уильямс М., Уильямс Р., Сциникариелло Ф, Клоцбах Дж. М., Diamond GL, Citra M (2012). «Воздействие на здоровье». Токсикологический профиль окиси углерода. обзорная статья. Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения, Агентство регистрации токсичных веществ и заболеваний. PMID 23946966.
дальнейшее чтение
- Kim HH, Choi S (август 2018 г.). «Терапевтические аспекты оксида углерода при сердечно-сосудистых заболеваниях». обзорная статья. Международный журнал молекулярных наук. 19 (8): 2381. Дои:10.3390 / ijms19082381. ЧВК 6121498. PMID 30104479.
- Исмаилова А, Кутер Д., Боле Д.С., Батлер И.С. (2018). «Обзор потенциальных терапевтических применений молекул, высвобождающих CO». обзорная статья. Биоинорганическая химия и приложения. 2018: 8547364. Дои:10.1155/2018/8547364. ЧВК 6109489. PMID 30158958.
- Abeyrathna N, Washington K, Bashur C, Liao Y (октябрь 2017 г.). «Неметаллические молекулы, выделяющие монооксид углерода (CORM)». обзорная статья. Органическая и биомолекулярная химия. 15 (41): 8692–8699. Дои:10.1039 / c7ob01674c. PMID 28948260.
- Хоппер К., Уоллборн Дж. (Август 2019 г.). «Доставка окиси углерода через анестетики на основе галогенированного эфира». обзорная статья. Оксид азота. 89: 93–95. Дои:10.1016 / j.niox.2019.05.006. PMID 31125687.
- Уилсон Дж. Л., Джесси Х. Э., Пул Р. К., Дэвидж К. С. (май 2012 г.). «Антибактериальные эффекты окиси углерода». обзорная статья. Текущая фармацевтическая биотехнология. 13 (6): 760–8. Дои:10.2174/138920112800399329. PMID 22201612.
- Сланина Т., Себей П. (май 2018 г.). «PhotoCORMs, активируемые видимым светом: Рациональная конструкция высвобождающих CO органических молекул, поглощаемых в прозрачном для тканей окне». обзорная статья. Фотохимические и фотобиологические науки. 17 (6): 692–710. Дои:10.1039 / C8PP00096D. PMID 29796556.
