Дисплей MRNA - MRNA display
отображение мРНК это метод отображения, используемый для in vitro белок, и / или пептид эволюция для создания молекул, которые могут связываться с желаемой целью. Результатом процесса является переведенный пептиды или белки которые связаны с их мРНК прародитель через пуромицин связь. Затем комплекс связывается с иммобилизованной мишенью на этапе отбора (аффинная хроматография ). Слитые мРНК-белок, которые хорошо связываются, затем обратно транскрибируются в кДНК и их последовательность усилен через полимеразной цепной реакции. В результате нуклеотид последовательность, которая кодирует пептид с высоким сродством к представляющей интерес молекуле.
Пуромицин является аналогом 3 ’конца тирозил-тРНК, часть его структуры имитирует молекулу аденозин, а другая часть имитирует молекулу тирозин. По сравнению с расщепляемой сложноэфирной связью в тирозил-тРНК пуромицин имеет негидролизуемую амидную связь. В результате пуромицин препятствует трансляции и вызывает преждевременное высвобождение продуктов трансляции.

Все шаблоны мРНК, используемые для технологии отображения мРНК, имеют пуромицин на 3’-конце. По мере того как трансляция продолжается, рибосома перемещается по матрице мРНК, и как только она достигает 3 ’конца матрицы, слитый пуромицин входит в сайт А рибосомы и включается в формирующийся пептид. Затем слияние мРНК-полипептида высвобождается из рибосомы (рис. 1).
Для синтеза слияния мРНК-полипептид слитый пуромицин является не единственной модификацией матрицы мРНК.[1] Вместе с пуромицином необходимо задействовать олигонуклеотиды и другие спейсеры, чтобы обеспечить гибкость и правильную длину пуромицина для входа в A-сайт. В идеале линкер между 3’-концом мРНК и пуромицином должен быть гибким и достаточно длинным, чтобы пуромицин мог проникнуть в сайт A после трансляции последнего кодона. Это позволяет эффективно производить высококачественный слитый полноразмерный полипептид мРНК. Рихе Лю и другие. оптимизировали 3’-пуромициновый олигонуклеотидный спейсер. Они сообщили, что dA25 в сочетании со спейсером 9 (Glen Research) и dAdCdCP на 5 ’конце работали лучше всего для реакции слияния. Они обнаружили, что линкеры длиной более 40 нуклеотидов и короче 16 нуклеотидов показали значительно сниженную эффективность образования слияния. Также, когда последовательность rUrUP представлена рядом с пуромицином, слияние не происходит эффективно.[2]
Помимо обеспечения гибкости и длины, поли-dA-часть линкера также позволяет дополнительно очищать слитый мРНК-полипептид из-за его высокого сродства к целлюлозной смоле dT.[3] Слияния мРНК-полипептида могут быть отобраны по иммобилизованным мишеням отбора в течение нескольких циклов с возрастающей строгостью. После каждого раунда отбора те члены библиотеки, которые остаются привязанными к иммобилизованной цели, будут ПЦР усиливается, а не связывающие вещества смываются.
Метод

Синтез библиотеки отображения мРНК начинается с синтеза библиотеки ДНК. Библиотеку ДНК для любого интересующего белка или небольшого пептида можно синтезировать твердофазным синтезом с последующей амплификацией ПЦР. Обычно каждый член этой библиотеки ДНК имеет сайт транскрипции РНК-полимеразы Т7 и сайт связывания рибосомы на 5 ’конце. Область промотора Т7 позволяет крупномасштабно in vitro Транскрипция T7 для транскрипции библиотеки ДНК в библиотеку мРНК, которая обеспечивает шаблоны для in vitro перевод реакция позже. Сайт связывания рибосомы в 5’-нетранслируемой области (5 ’UTR) разработан в соответствии с in vitro система перевода, которая будет использоваться. В продаже есть два популярных in vitro системы перевода. Один E. Coli S30 Extract System (Promega), которая требует последовательности Шайна-Дальгарно в 5 ’UTR в качестве сайта связывания рибосомы;[4] другой - лизат Red Nova (Novagen), которому необходим сайт связывания рибосомы ΔTMV.
Как только библиотека мРНК будет сгенерирована, она будет очищена с помощью PAGE с мочевиной и лигирована с использованием Т4. ДНК-лигаза к линкеру спейсера ДНК, содержащему пуромицин на 3’-конце. На этом этапе лигирования часть мРНК лигируется с одноцепочечной ДНК с помощью ДНК-лигазы Т4. Это не стандартная реакция лигирования ДНК-лигазы Т4, когда две части двухцепочечной ДНК лигируются вместе. Чтобы увеличить выход этого специального лигирования, можно использовать шину одноцепочечной ДНК, чтобы способствовать реакции лигирования. 5'-конец шины конструирован так, чтобы быть комплементарным 3'-концу мРНК, а 3'-конец шины конструирован так, чтобы быть комплементарным 5'-концу спейсерного линкера ДНК, который обычно состоит из поли нуклеотиды dA (рис. 2).
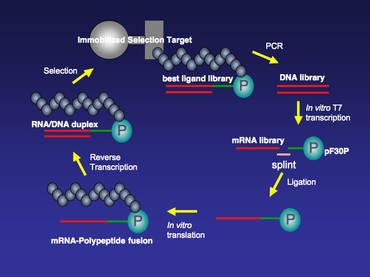
Библиотека лигированных мРНК-ДНК-пуромицин переводится в Red Nova Lysate (Novagen) или E. Coli S30 Extract System (Promega), в результате чего полипептиды ковалентно связаны в снг к кодирующей мРНК. В in vitro трансляция также может выполняться в системе PURE (синтез белка с использованием рекомбинантных элементов). Система PURE - это E. Coli бесклеточная система трансляции, в которой присутствуют только важные компоненты трансляции. Некоторые компоненты, такие как аминокислоты и аминоацил-тРНК-синтазы (AARS), могут быть исключены из системы. Вместо этого в систему PURE можно добавить химически ацилированную тРНК. Было показано, что некоторые неприродные аминокислоты, такие как тРНК, акцилированная N-метиламинокислотой, могут быть включены в пептиды или слияния мРНК-полипептидов в системе PURE.[5]
После трансляции одноцепочечные части мРНК слияния будут преобразованы в гетеродуплекс РНК / ДНК посредством обратная транскриптаза для устранения любых нежелательных вторичных структур РНК и повышения стабильности нуклеиновой кислоты в слиянии. Этот шаг представляет собой стандартную реакцию обратной транскрипции. Например, это можно сделать с помощью надстрочного индекса II (GIBCO-BRL) в соответствии с протоколом производителя.
Слияния мРНК / ДНК-полипептид могут быть отобраны по иммобилизованным мишеням отбора в течение нескольких раундов (рис. 3). Для первых нескольких раундов отбора может быть относительно высокий фон, и его можно свести к минимуму путем увеличения строгости отбора, например, путем регулирования концентрации соли, количества детергента и / или температуры в течение периода связывания мишени / слияния. После отбора связывания те члены библиотеки, которые остаются связанными с иммобилизованной мишенью, амплифицируются с помощью ПЦР. Этап ПЦР-амплификации обогатит популяцию из библиотеки отображения мРНК, которая имеет более высокое сродство к иммобилизованной мишени. ПЦР, подверженная ошибкам, также может быть проведена между каждым раундом отбора, чтобы еще больше увеличить разнообразие библиотеки отображения мРНК и уменьшить фон при выборе.[6]
Недавно был опубликован менее трудоемкий протокол для отображения мРНК.[7]
Преимущества
Хотя существует множество других технологий молекулярного дисплея, например фаговый дисплей, бактериальный дисплей, дрожжевой дисплей, и рибосомный дисплей, технология отображения мРНК имеет много преимуществ перед другими.[8] Первые три перечисленные библиотеки биологических дисплеев содержат полипептиды или белки, экспрессированные на поверхности соответствующего микроорганизма, и сопутствующая кодирующая информация для каждого полипептида или белка может быть получена из генома микроорганизма. Однако размер библиотеки для этих трех in vivo системы отображения ограничены эффективностью преобразования каждого организма. Например, размер библиотеки для фагового и бактериального дисплея ограничен 1-10 × 10 ^ 9 различными членами. Размер библиотеки для дрожжевого дисплея еще меньше. Более того, эта система отображения на основе клеток позволяет проводить скрининг и обогащение только пептидов / белков, содержащих природные аминокислоты. Напротив, отображение мРНК и отображение рибосом in vitro методы отбора. Они допускают размер библиотеки до 10 ^ 15 различных членов. Большой размер библиотеки увеличивает вероятность выбора очень редких последовательностей, а также улучшает разнообразие выбранных последовательностей. К тому же, in vitro Методы отбора устраняют нежелательное давление отбора, такое как плохая экспрессия белка и быстрая деградация белка, что может уменьшить разнообразие выбранных последовательностей. В заключение, in vitro методы отбора позволяют применять in vitro мутагенез[9] и методы рекомбинации на протяжении всего процесса отбора.
Хотя отображение рибосом и отображение мРНК in vitro методы отбора, отображение мРНК имеет некоторое преимущество перед технологией отображения рибосом.[10] Дисплей мРНК использует ковалентные комплексы мРНК-полипептид, связанные через пуромицин; тогда как рибосомный дисплей использует остановленные, нековалентные комплексы рибосома-мРНК-полипептид.[11] Для рибосомного дисплея строгость отбора ограничена для сохранения комплекса рибосома-мРНК-полипептид из-за нековалентных комплексов рибосома-мРНК-полипептид. Это может вызвать трудности с уменьшением фонового связывания во время цикла отбора. Кроме того, полипептиды, подвергаемые селекции в системе отображения рибосом, присоединены к огромному комплексу рРНК-белок, рибосоме, молекулярная масса которой превышает 2 000 000 Да. Между мишенью отбора и рибосомой может быть какое-то непредсказуемое взаимодействие, и это может привести к потере потенциальных связывающих веществ во время цикла отбора. Напротив, спейсерный линкер пуромициновой ДНК, используемый в технологии отображения мРНК, намного меньше по размеру по сравнению с рибосомой. У этого линкера может быть меньше шансов взаимодействовать с иммобилизованной мишенью отбора. Таким образом, технология отображения мРНК с большей вероятностью даст менее предвзятые результаты.
Заявление
В 1997 году Робертс и Шостак показали, что слияние синтетической мРНК и кодируемой ею мой с эпитоп может быть обогащен из пула слияний мРНК-полипептид со случайной последовательностью путем иммунопреципитации.[6]
Девять лет спустя Фукуда и его коллеги выбрали метод отображения мРНК для in vitro эволюция одноцепочечных фрагментов антител к Fv (scFv).[12] Они выбрали шесть различных мутантов scFv с пятью консенсусными мутациями. Однако кинетический анализ этих мутантов показал, что их антиген-специфичность оставалась такой же, как у дикого типа. Однако они продемонстрировали, что две из пяти консенсусных мутаций находились в пределах регионы, определяющие комплементарность (CDR). И они пришли к выводу, что отображение мРНК имеет потенциал для быстрой искусственной эволюции высокоаффинных диагностических и терапевтических антител за счет оптимизации их CDR.
Робертс с соавторами продемонстрировали, что неприродные пептидные олигомеры, состоящие из N-замещенной аминокислоты, могут быть синтезированы как слитые мРНК-полипептиды.[13] Пептиды, содержащие N-замещенные аминокислоты, были связаны с хорошей протеолитической стабильностью и улучшенными фармакокинетическими свойствами. Эта работа показывает, что технология отображения мРНК имеет потенциал для выбора лекарственных пептидов для терапевтического использования, устойчивых к протеолизу.[14]
Смотрите также
Рекомендации
- ^ Амштуц П., Форрер П., Занд С., Плюктхун А. (2001). «Дисплейные технологии in vitro: новые разработки и приложения». Текущее мнение в области биотехнологии. 12 (4): 400–5. Дои:10.1016 / S0958-1669 (00) 00234-2. PMID 11551470.
- ^ Лю Р., Баррик Дж. Э., Шостак Дж. В., Робертс Р. В. (2000). «Оптимизированный синтез слитых белков РНК для отбора белков in vitro». Методы в энзимологии. 318: 268–93. Дои:10.1016 / S0076-6879 (00) 18058-9. ISBN 9780121822194. PMID 10889994.
- ^ Курц М., Гу К., Лозе ПА (2000). «Фотосшитые псораленом конъюгаты мРНК-пуромицин: новая матрица для быстрого и легкого получения гибридных мРНК-белков» (PDF). Исследования нуклеиновых кислот. 28 (18): 83e – 83. Дои:10.1093 / nar / 28.18.e83. ЧВК 110755. PMID 10982894.
- ^ Mattheakis LC, Bhatt RR, Dower WJ (1994). «Система отображения полисом in vitro для идентификации лигандов из очень больших библиотек пептидов». Proc Natl Acad Sci USA. 91 (19): 9022–6. Bibcode:1994ПНАС ... 91.9022М. Дои:10.1073 / пнас.91.19.9022. ЧВК 44739. PMID 7522328.
- ^ Каваками Т., Мураками Х., Суга Х. (январь 2008 г.). «Запрограммированное матричной РНК включение множества N-метиламинокислот в линейные и циклические пептиды». Химия и биология. 15 (1): 32–42. Дои:10.1016 / j.chembiol.2007.12.008. PMID 18215771.
- ^ а б Робертс RW, Шостак JW (1997). «Слитые РНК-пептиды для отбора пептидов и белков in vitro». Proc Natl Acad Sci USA. 94 (23): 12297–302. Bibcode:1997PNAS ... 9412297R. Дои:10.1073 / пнас.94.23.12297. ЧВК 24913. PMID 9356443.
- ^ Барендт PA, Ng DT, McQuade CN, Sarkar CA (2013). «Оптимизированный протокол для отображения мРНК». ACS комбинаторная наука. 15 (2): 77–81. Дои:10.1021 / co300135r. ЧВК 3666848. PMID 23305392.
- ^ Робертс Р.В. (июнь 1999 г.). «Полностью отбор белка in vitro с использованием слияния мРНК-белка и отображения рибосом». Современное мнение в области химической биологии. 3 (3): 268–73. Дои:10.1016 / S1367-5931 (99) 80042-8. PMID 10359713.
- ^ Цзин Д., Ли Ф, Цзян М., Цай Дж, Ву И, Се К., Ву Х, Тан Ц, Лю Дж, Го В., Шен Дж, Ло Э (ноябрь 2013 г.). «Импульсные электромагнитные поля улучшают микроструктуру и прочность костей у крыс с удаленными яичниками». PLoS ONE. 8 (11): e79377. Bibcode:2013PLoSO ... 879377J. Дои:10.1371 / journal.pone.0079377. ЧВК 3828367. PMID 24244491.
- ^ Gold L (апрель 2001 г.). «Отображение мРНК: разнообразие имеет значение во время отбора in vitro». Proc Natl Acad Sci USA. 98 (9): 4825–6. Bibcode:2001PNAS ... 98.4825G. Дои:10.1073 / pnas.091101698. ЧВК 33119. PMID 11320229.
- ^ Эндрю Бьюкенен; Лутц Джермутус. «Метод отображения рибосом или Mrna с выбором для повышения стабильности белка». Патенты Google. Получено 9 июн 2014.
- ^ Фукуда И., Коджох К., Табата Н. и др. (2006). «Эволюция одноцепочечных антител in vitro с использованием дисплея мРНК». Исследования нуклеиновых кислот. 34 (19): e127. Дои:10.1093 / нар / gkl618. ЧВК 1636464. PMID 17012279.
- ^ Франкель А., Миллуорд С.В., Робертс Р.В. (ноябрь 2003 г.). «Кодамеры: неестественные пептидные олигомеры, кодируемые РНК» (PDF). Химия и биология. 10 (11): 1043–50. Дои:10.1016 / j.chembiol.2003.11.004. PMID 14652071.
- ^ Уайт, Э. Рейли; Солнце, Люксин; Ма, Чжун; Бекта, Джейсон М .; Данциг, Бретань А .; Хакер, Дэвид Э .; Хуэ, Мелисса; Уильямс, Дэвид С .; Эдвардс, Росс А. (2015-05-15). "Подход библиотеки пептидов к обнаружению фосфомиметических ингибиторов С-концевого домена BRCA1". ACS Химическая биология. 10 (5): 1198–1208. Дои:10.1021 / cb500757u. ЧВК 4433557. PMID 25654734.
