Изолобальный принцип - Isolobal principle
В изолобальный принцип (более формально известный как изолобальная аналогия) - стратегия, используемая в металлоорганическая химия связать структуру органический и неорганический молекулярные фрагменты, чтобы предсказать связь свойства металлоорганические соединения.[1] Роальд Хоффманн описал молекулярные фрагменты как изолобальные, если число, симметрия свойства, приблизительная энергия и форма пограничные орбитали и количество электроны в них похожи - не идентичны, но похожи ».[2] Можно предсказать связь и реактивность менее известного вида от более известного вида, если два молекулярных фрагмента имеют сходные граничные орбитали, самая высокая занятая молекулярная орбиталь (HOMO) и самая низкая незанятая молекулярная орбиталь (ЛЮМО). Изолобальные соединения являются аналогами изоэлектронный соединения, которые имеют одинаковое количество валентные электроны и структура. Графическое изображение изолобальных структур с изолобальными парами, соединенными двуглавой стрелкой с половиной орбитали внизу, можно найти на рисунке 1.
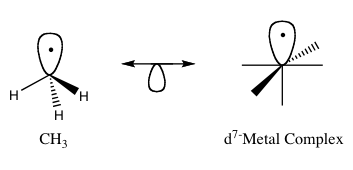
За свою работу по изолобальной аналогии Хоффманн был удостоен награды Нобелевская премия по химии в 1981 году, которую он разделил с Кеничи Фукуи.[3] В своей лекции о присуждении Нобелевской премии Хоффманн подчеркнул, что изолобальная аналогия является полезной, но простой моделью, и поэтому в некоторых случаях обречена на провал.[1]
Построение изолобальных фрагментов
Чтобы начать генерировать изолобальный фрагмент, молекула должна соответствовать определенным критериям.[4] Молекулы на основе элементы основной группы должен удовлетворить Правило октета когда все склеивание и несвязание молекулярные орбитали (МО) заполнены, а все несвязывающие МО пусты. Например, метан - это простая молекула, из которой образуется фрагмент основной группы. Удаление атома водорода из метана приводит к образованию метильного радикала. Молекула сохраняет свое молекулярная геометрия как точки пограничной орбиты в направлении пропавшего атома водорода. Дальнейшее удаление водорода приводит к образованию второй пограничной орбитали. Этот процесс можно повторять до тех пор, пока с центральным атомом молекулы не останется только одна связь. Рисунок 2 демонстрирует этот пример пошаговой генерации изолобальных фрагментов.

Изолобальные фрагменты восьмигранный комплексы, такие как ML6, можно создать аналогичным образом. Комплексы переходных металлов должен изначально удовлетворять правило восемнадцати электронов, не имеют чистой платы, а их лиганды должно быть два донора электронов (Базы Льюиса ). Следовательно, металлический центр ML6 отправная точка должна быть d6. Удаление лиганда аналогично удалению водорода из метана в предыдущем примере, в результате чего образуется граничная орбиталь, которая указывает в сторону удаленного лиганда. Разрыв связи между металлическим центром и одним лигандом приводит к образованию ML−
5 радикальный комплекс. Чтобы удовлетворить критерию нулевого заряда, металлический центр должен быть изменен. Например, MoL6 комплекс d6 и нейтральный. Однако удаление лиганда для образования первой пограничной орбитали привело бы к MoL−
5 комплекс, потому что Мо получил дополнительный электрон, делающий его d7. Чтобы исправить это, Mo можно обменять на Mn, что даст нейтральный d7 комплекс в этом случае, как показано на рисунке 3. Эта тенденция может продолжаться, пока только один лиганд не останется скоординированным с металлическим центром.

Связь тетраэдрических и октаэдрических фрагментов

Изолобальные фрагменты тетраэдрических и октаэдрических молекул могут быть связаны между собой. Структуры с одинаковым числом граничных орбиталей изолобальны друг другу. Например, метан с удаленными двумя атомами водорода, CH2 изолобальна d7 ML4 комплекс образован из октаэдрического исходного комплекса (рис. 4).
Зависимость теории МО
Любая насыщенная молекула может быть отправной точкой для создания изолобальных фрагментов.[5][6] Связывающие и несвязывающие молекулярные орбитали (МО) молекул должны быть заполнены, а антисвязывающие МО должны быть пустыми. С каждым последующим поколением изолобального фрагмента электроны удаляются из связывающих орбиталей и создается граничная орбиталь. Граничные орбитали находятся на более высоком энергетическом уровне, чем связывающие и несвязывающие МО. Каждая граничная орбиталь содержит один электрон. Например, рассмотрим рисунок 5, на котором показано образование граничных орбиталей в тетраэдрических и октаэдрических молекулах.

Как видно выше, когда фрагмент образован из CH4, один из зр3 гибридные орбитали участвующий в связывании становится несвязывающей, отдельно занятой пограничной орбиталью. Повышенный уровень энергии пограничной орбиты также показан на рисунке. Аналогично, начиная с металлического комплекса, такого как d6-ML6, d2зр3 гибридные орбитали затронуты. Кроме того, t2 г несвязывающие металлические орбитали не изменяются.
Расширения аналогии
Изолобальная аналогия имеет приложения не только для простых октаэдрических комплексов. Его можно использовать с различными лигандами, заряженными частицами и неоктаэдрическими комплексами.[7]
Лиганды
Типичные лиганды, используемые в изолобальной аналогии, представляют собой двухэлектронные доноры, такие как фосфины, галогены или же карбонилы. Однако можно использовать другие типы лигандов. Если лиганды отдают несколько пар электронов, они будут занимать несколько координационных центров. Например, циклопентадиенил анион является шестиэлектронным донором, поэтому он занимает три координационных центра. Полидентатный лиганды также могут быть использованы по аналогии, например этилендиамин, бидентатный лиганд, или триэтилентетрамин, тетрадентатный лиганд.

Изоэлектронные фрагменты
Изолобальная аналогия также может быть использована с изоэлектронными фрагментами, имеющими одинаковое координационное число, что позволяет рассматривать заряженные частицы. Например, Re (CO)5 изолобальна с CH3 и, следовательно, [Ru (CO)5]+ и [Mo (CO)5]− также изолобальны с CH3. Любой 17-электронный комплекс металла в этом примере будет изолобальным.
В аналогичном смысле добавление или удаление электронов из двух изолобальных фрагментов приводит к появлению двух новых изолобальных фрагментов. Поскольку Re (CO)5 изолобальна с CH3, [Re (CO)5]+ изолобален с CH+
3.[8]
Неоктаэдрические комплексы
| Восьмигранный MLп | Квадратно-планарный MLп−2 |
|---|---|
| d6: Пн (CO)5 | d8: [PdCl3]− |
| d8: Os (CO)4 | d10: Ni (PR3)2 |

Аналогия применима к другим формам, помимо тетраэдрической и октаэдрической геометрии. Выводы, используемые в октаэдрической геометрии, действительны для большинства других геометрий. Исключение составляет квадратно-плоский, потому что квадратно-плоские комплексы обычно соблюдают правило 16 электронов. Предполагая, что лиганды действуют как доноры двух электронов, металлический центр в плоско-квадратных молекулах равен d8. Чтобы связать октаэдрический фрагмент, MLп, где M имеет dИкс электронная конфигурация на плоский аналогичный фрагмент, формула MLп−2 где M имеет dИкс+2 электронная конфигурация должна соблюдаться.
Дополнительные примеры изолобальной аналогии в различных формах и формах показаны на рисунке 8.
Приложения и примеры

Использование изолобальной аналогии включает в себя быстрый путь к пониманию электронной структуры, предсказание реакционной способности и механизмов реакции, а также метод классификации молекул. Приложения обычно используются для установления соединений между хорошо известными системами и менее знакомыми системами. Например, возможность получения несинтезированных соединений можно представить на основании известных молекулярных конформаций. Изолобальная аналогия не гарантирует, что эти продукты могут быть произведены, а только предлагает возможность. Рассмотрим молекулу Fe (CO)3 в комплексе с циклобутадиен.[1] Fe (CO)3 изолобальна с CH+. Следовательно, можно предсказать, что CH+ будет координироваться с циклобутадиеном аналогично тому, как Fe (CO)3 буду. Таким образом, молекула C
5ЧАС+
5 можно представить себе независимо от его фактического существования.
Прогнозирование реакционной способности комплексов также может быть выполнено с использованием изолобальной аналогии. Из простого ожидания двух CH3 радикалы, реагирующие с образованием этана, можно использовать аналогию для предсказания связывания M – C или M – M, например (CH3) M (CO)5 И м2(CO)10, где M - d7.
Еще одно применение изолобальной аналогии - помощь в прогнозировании механизмы реакции. Как и в других приложениях, механизмы хорошо известных реакций могут использоваться, чтобы помочь предсказать механистические пути менее известных реакций. Нет предела возможному сравнению органических и неорганических комплексов. Аналогия может течь в любом направлении (от органического к неорганическому) или внутри каждого подразделения (от органического к органическому).
Артеага Мюллер и др. используйте изолобальную аналогию, чтобы связать имидо полусэндвич-комплексы с изоэлектронными дициклопентадиенильными комплексами.[9] Изолобальное соотношение имидо и циклопентадиенильных лигандов является ключом к этому сравнению. Исследование показало, что реакционная способность этих двух типов комплексов схожа, хотя их каталитические способности в некоторых отношениях различаются. Это исследование показывает, что изолобальная аналогия не дает точных предсказаний между двумя изолобальными фрагментами, как предупреждал Хоффман в своей Нобелевской лекции.[1]
Wu et al. примените изолобальную аналогию для изучения взаимосвязей, включающих структуры, энергии и магнитные свойства между полиэдрическими карбонилами бора и их углеводородными родственниками.[10] Как было установлено в этом исследовании, хотя эти два набора молекул изолобальны, они имеют значительные различия в их энергия деформации.
Голдман и Тайлер использовали изолобальную аналогию для определения наиболее вероятного механизма реакции делеции.[11] Один из продуктов облучение из Cp Вт (CO)3Я в присутствии PPh3 является CpW (CO)−
3. Механизм указанной реакции был изучен и предположительно изолобален непропорциональность металл-металл на связке димеры с участием 19-валентных электронных интермедиатов. Реакции состоят из изолобальных фрагментов, и ключевые промежуточные продукты обеих реакций изолобальны. Таким образом, пути реакции механически изолобальны.
Рекомендации
- ^ а б c d Хоффманн, Р. (1982). «Наведение мостов между неорганической и органической химией (Нобелевская лекция)» (PDF). Энгью. Chem. Int. Эд. 21 (10): 711–724. Дои:10.1002 / anie.198207113.
- ^ В ссылке 10 своей речи о вручении Нобелевской премии Хоффманн заявляет, что термин «изолобальный» был введен в ссылке 1e:Элиан, М .; Chen, M. M.-L .; Мингос, Д. М. П.; Хоффманн, Р. (1976). «Сравнительное исследование склеивания конических фрагментов». Неорг. Chem. 15 (5): 1148–1155. Дои:10.1021 / ic50159a034.", но это концепция старше.
- ^ "Нобелевская премия по химии 1981: Кеничи Фукуи, Роальд Хоффманн". nobelprize.org. Получено 22 декабря, 2010.
- ^ Кафедра химии. Современные подходы к неорганической связи. Университет Халла.
- ^ Гисперт, Джоан Рибас (2008). Координационная химия. Wiley-VCH. С. 172–176.
- ^ Шрайвер, Д.Ф .; Аткинс, П.; Overton, T .; Rourke, J .; Веллер, М .; Армстронг, Ф. (2006). Неорганическая химия. Фримен.
- ^ Miessler, G.L .; Тарр, Д. А. (2008). Неорганическая химия (3-е изд.). Pearson Education.
- ^ Дуглас, Б.; McDaniel, D .; Александр, Дж. (1994). Концепции и модели неорганической химии (3-е изд.). Wiley & Sons.
- ^ Arteaga Müller, R .; Sánchez Nieves, J .; Ramos, J .; Royo, P .; Москера, М. Э. Г. (2008). "Изолобальные цвиттерионные имидо и танталовые имидо и циркониевые моноциклопентадиенильные комплексы: теоретические исследования и исследования полимеризации метилметакрилата". Металлоорганические соединения. 27 (7): 1417–1426. Дои:10.1021 / om701068h.
- ^ Wu, H .; Win, X .; Сюй, X .; Jiao, H .; Шлейер, П. фон Р. (2005). «Структуры и энергии Isolobal (BCO)п и (CH)п Клетки ». Варенье. Chem. Soc. 127 (7): 2334–2338. Дои:10.1021 / ja046740f. PMID 15713113.
- ^ Goldman, A.D .; Тайлер, Д. Р. (1986). "Изолобальное фотохимическое восстановление CpW (CO)3CH3 (Cp = η5-C5ЧАС5) к CpW (CO)−
3: Изолобальная аналогия с диспропорционированием Cp2Пн2(CO)6". Варенье. Chem. Soc. 108: 89–94. Дои:10.1021 / ja00261a015.
