Асимметричное гидрирование - Asymmetric hydrogenation
Асимметричное гидрирование это химическая реакция что добавляет два атома водород предпочтительно одной из двух сторон ненасыщенный молекула субстрата, такая как алкен или кетон. Селективность зависит от способа связывания субстрата с хиральными катализаторы. На жаргоне эта привязка передает пространственную информацию (то, что химики называют хиральность ) от катализатора к цели, отдавая предпочтение продукту как единственному энантиомер. Этот "фермент -подобная селективность »применяется к синтезу некоторых коммерческихфармацевтические агенты и агрохимикаты.

История
В 1956 г. неоднородный катализатор из палладий нанесенный на шелк, как было показано, вызывает асимметричное гидрирование.[1] Позже, в 1968 г., группы Уильям Ноулз и Леопольд Хорнер независимо опубликовали примеры асимметричного гидрирования с использованием гомогенные катализаторы. Пока выставляю только скромные энантиомерные избытки эти ранние реакции продемонстрировали осуществимость. К 1972 году энантиомерный избыток 90% был достигнут, и первый промышленный синтез Болезнь Паркинсона препарат, средство, медикамент L-ДОПА начали использовать эту технологию.[2][3]

В области асимметричного гидрирования продолжался ряд заметных достижений. Анри Каган развитый ДИОП, легко приготовляемый C2-симметричный дифосфин, который дает высокий ее в некоторых реакциях. Рёдзи Ноёри представил рутений катализаторы на основе асимметричных гидрированных полярных субстратов, таких как кетоны и альдегиды. Вступление к P, N лиганды затем еще больше расширили сферу применения C2-симметричные лиганды, хотя они принципиально не превосходят хиральные лиганды, лишенные вращательная симметрия.[4] Сегодня асимметричное гидрирование является рутинной методологией в лабораторной и промышленной органической химии.
Важность асимметричного гидрирования была признана в 2001 г. Нобелевская премия по химии предназначенный кому-либо Уильям Стэндиш Ноулз и Рёдзи Ноёри.
Механизм
Механизмы внутренней сферы
Два основных механизмы были предложены для каталитического гидрирования с родий комплексы: ненасыщенный механизм и дигидридный механизм. Хотя различить эти два механизма сложно, различие между ними для асимметричного гидрирования относительно неважно, поскольку оба сходятся к общему промежуточному соединению до того, как какая-либо стереохимическая информация передается молекуле продукта.[5]
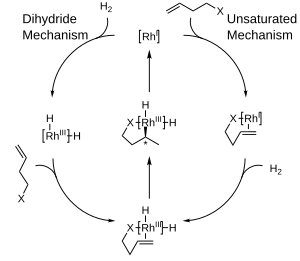
Предпочтение получения одного энантиомера вместо другого в этих реакциях часто объясняется с точки зрения стерический взаимодействие между лиганд и прохиральный субстрат. Учет этих взаимодействий привел к разработке квадрантных диаграмм, где «заблокированные» области обозначены заштрихованной рамкой, а «открытые» области оставлены незаполненными. В смоделированной реакции большие группы на входящий олефин будут иметь тенденцию ориентироваться, чтобы заполнить открытые области диаграммы, в то время как меньшие группы будут направлены в заблокированные области, и тогда доставка водорода будет происходить на заднюю поверхность олефина, фиксируя стереохимия. Обратите внимание, что для ясности показана только часть хирального фосфинового лиганда.

Металлы
Металлы платиновой группы
Родий, первый металл, который будет использоваться в гомогенном асимметричном гидрировании,[6] продолжает широко использоваться. Мишени для асимметричного гидрирования с родием обычно требуют наличия координирующей группы, близкой к олефин.[5] Хотя это требование является ограничением, многие классы субстратов обладают такой функционализацией, например ненасыщенные амиды.[7]
В Асимметричное гидрирование Нойори основан на рутений.[8][9] Последующая работа расширила исходный шаблон катализатора Нойори, что привело к включению традиционно сложных субстратов, таких как т-бутилкетоны[10] и 1-тетралоны[11] как жизнеспособные субстраты для гидрирования рутениевыми катализаторами. Трансферное гидрирование на основе Ru и TsDPEN также пользовалась коммерческим успехом.[12]
Иридий Катализаторы применимы для ряда «нетрадиционных» субстратов, для которых не было найдено хороших катализаторов с Ru и Rh.[13] Нефункциональные олефины[14] архетипический случай, но другие примеры, включая кетоны[15][16] существовать. Общей проблемой катализаторов на основе иридия является их склонность к тримеризировать в растворе.[16] Использование некоординирующий анион БарF
4− оказался наиболее широко применимым решением проблемы агрегирования.[16][17] Другие стратегии повышения стабильности катализатора включают добавление дополнительной координирующей ветви к хиральному лиганду,[15] увеличение стерической массы лиганда,[18] используя дендример лиганд,[19] повышение жесткости лиганда,[20] иммобилизация лиганда,[21] и с использованием гетеробиметаллических систем (с иридием в качестве одного из металлов).[21]
Неблагородные металлы
Утюг является популярной целью исследований для многих каталитических процессов, в основном из-за его низкой стоимости и низкой токсичности по сравнению с другими переходными металлами.[22] Реализованы методы асимметричного гидрирования с использованием железа, хотя по скорости и селективности они уступают катализаторам на основе драгоценных металлов.[23] В некоторых случаях структурно неопределенный наночастицы оказались активными видами на месте и наблюдаемая умеренная избирательность может быть результатом их неконтролируемой геометрии.[24]
Классы лигандов
Фосфиновые лиганды
Хиральный фосфин лиганды, особенно C2-симметричные лиганды, являются источником хиральности в большинстве асимметричных катализаторов гидрирования. Из них БИНАП лиганд хорошо известен благодаря тому, что он получил Нобелевскую премию по применению в Асимметричное гидрирование Нойори.[2]
Хиральные фосфиновые лиганды в целом можно классифицировать как моно- или двузубый. Их можно дополнительно классифицировать по расположению стереогенного центра - фосфор по сравнению с органическими заместителями. Лиганды с C2 Элемент симметрии был особенно популярен, отчасти потому, что присутствие такого элемента резко снижает возможные конформации связывания субстрата с комплексом металл-лиганд (часто приводя к исключительной энантиоселективности).[25]
Монодентатные фосфины
Лиганды монофосфинового типа были одними из первых, кто появился при асимметричном гидрировании, например, лиганд CAMP.[26] Продолжающиеся исследования этих типов лигандов изучали как п-алкил и п-гетероатомные лиганды, с п-гетероатомные лиганды, такие как фосфиты и фосфорамидиты в целом достижение более впечатляющих результатов.[27] Структурные классы лигандов, которые оказались успешными, включают те, которые основаны на бинафтильной структуре MonoPHOS. [28] или спиро-кольцевую систему SiPHOS.[29] Примечательно, что эти монодентатные лиганды можно использовать в комбинации друг с другом для достижения синергетического улучшения энантиоселективности;[30] то, что невозможно с дифосфиновые лиганды.[27]
Хиральные дифосфиновые лиганды
Дифосфиновым лигандам уделялось значительно больше внимания, чем монофосфинам, и, возможно, как следствие, у них гораздо более длинный список достижений. К этому классу относится первый лиганд, обеспечивающий высокую селективность (ДИОП ), первый лиганд, который будет использован в промышленном асимметричном синтезе (ДИПАМП[31][32][3]) и наиболее известный хиральный лиганд (BINAP).[2] Хиральные дифосфиновые лиганды теперь повсеместно используются при асимметричном гидрировании.

P, N и P, O лиганды


Использование лигандов P, N в асимметричном гидрировании можно отнести к C2 симметричный бисоксазолиновый лиганд.[33] Однако вскоре эти симметричные лиганды были вытеснены монооксазолин лиганды, недостаток C2 симметрия никоим образом не ограничивает их эффективность в асимметричном катализе.[34] Такие лиганды обычно состоят из ахирального азотсодержащего гетероцикла, который функционализирован боковым фосфорсодержащим плечом, хотя как точная природа гетероцикла, так и фосфорный центр химического окружения широко варьировались. Ни одна структура не оказалась столь эффективной с широким спектром субстратов, хотя некоторые привилегированный структуры (например, фосфин-оксазолин или PHOX архитектура) были созданы.[14][34][35] Более того, в пределах узко определенного класса субстратов характеристики металлических комплексов с хиральными лигандами P, N могут близко приблизиться к идеальному превращению и селективности в системах, которые иначе очень трудно достичь.[36] Некоторые комплексы, полученные из хелатирующих лигандов P-O, показали многообещающие результаты в гидрировании α, β-ненасыщенных кетонов и сложных эфиров.[37]
Лиганды NHC
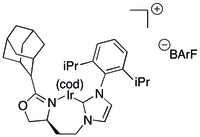
Простой N-гетероциклический карбен Лиганды на основе (NHC) оказались непрактичными для асимметричного гидрирования.
Некоторые лиганды C, N объединяют NHC с хиральным оксазолином с образованием хелатирующего лиганда.[38][39] Лиганды на основе NHC первого типа были созданы в виде больших библиотек в результате реакции меньших библиотек индивидуальных NHC и оксазолинов.[38][39] Катализаторы на основе NHC с объемным семичленным металлоциклом на иридии были применены для каталитического гидрирования нефункционализированных олефинов.[38] и винил эфирные спирты с конверсией и ее содержанием в высоких 80-х или 90-х годах.[40] Та же система была применена для синтеза ряда альдолов,[41] вицинальный диметил[42] и дезоксиполикетид[43] мотивов и самих дезоксиполикетидов.[44]
C2-симметричные NHC оказались очень полезными лигандами для асимметричного гидрирования.[45]
Ациклические субстраты
Ациклические ненасыщенные субстраты (олефины, кетоны, енамины имины ) представляет собой наиболее распространенные прохиральные субстраты. Субстраты, которые особенно поддаются асимметричному гидрированию, часто имеют полярную функциональную группу, смежную с сайтом, который необходимо гидрогенизировать. В отсутствие этой функциональной группы катализ часто приводит к снижению ее. Для нефункционализированных олефинов иридий с п,N-основанные лиганды) оказались успешными катализаторами. Использование катализатора в этой категории необычно узко; следовательно, возникло множество различных категорий решенных и нерешенных каталитических проблем. 1,1-дизамещенные, 1,2-диарилтризамещенные, 1,1,2-триалкил- и тетразамещенные олефины представляют классы, которые исследовались отдельно,[46][47] и даже внутри этих классов могут существовать вариации, которые делают различные решения оптимальными.[48]


В противоположность случаю олефинов, асимметричное гидрирование енаминов способствует лигандам дифосфинового типа; отличные результаты были достигнуты с системами на основе как иридия, так и родия. Однако даже самые лучшие системы часто страдают от низкого ее и отсутствия универсальности. Определенный пирролидин -производные енамины ароматических кетонов поддаются асимметричному гидрированию с катионными системами фосфонита родия (I), а I2 и система уксусной кислоты со значениями ее обычно выше 90% и потенциально достигает 99,9%.[49] Аналогичная система с использованием иридия (I) и очень близкого ему фосфорамидит лиганд эффективен для асимметричного гидрирования енаминов пирролидинового типа, где двойная связь находилась внутри кольца: другими словами, дигидропирролов.[50] В обоих случаях энантиоселективность существенно снижалась при увеличении размера кольца с пяти до шести.
Имины и кетоны

Кетоны и имины являются связанными функциональными группами, и эффективные технологии асимметричного гидрирования каждой из них также тесно связаны. Из них система рутений-хиральный дифосфин-диамин Нойори, пожалуй, одна из самых известных.[51] Его можно использовать в сочетании с широким спектром фосфинов и аминов (где амин может быть, но не обязательно, хиральным), и его можно легко отрегулировать для оптимального соответствия с целевым субстратом, обычно достигая энантиомерные избытки (ee's) выше 90%.[52][53]
Для карбонильных и иминных субстратов на конце η1 координация может конкурировать с η2 режим. Для η1-связанные субстраты, акцептирующий водород углерод удаляется из катализатора и сопротивляется гидрированию.[54]
Системы на основе лиганда иридий / P, N также обычно используются для асимметричного гидрирования кетонов и иминов. Например, последовательная система для бензиловых арилиминов использует P, N-лиганд SIPHOX в сочетании с иридием (I) в катионном комплексе для достижения асимметричного гидрирования с ее> 90%.[20] Один из самых эффективных и действенных катализаторов, когда-либо разработанных для асимметричного гидрирования кетонов, с номер оборота (TON) до 4,550,000 и ее до 99,9%, используется другая система иридия (I) с близкородственной тридентатный лиганд.[15]

Несмотря на их сходство, две функциональные группы не идентичны; есть много областей, где они значительно расходятся. Один из них заключается в асимметричном гидрировании N-нефункциональные имины с образованием первичных аминов. Избирательное восстановление таких частиц может быть затруднено, поскольку они, как правило, существуют в сложных равновесных состояниях имина и енамина. таутомеры, а также (E) и (Z) изомеры.[55] Один из подходов к этой проблеме заключался в использовании кетимины в качестве их гидрохлоридной соли и зависят от стерических свойств соседнего алкила или арил группы, чтобы позволить катализатору различать два энантиотопный лица кетимина.[56][57]
Ароматические субстраты
Асимметричное гидрирование ароматный (особенно гетероароматический ), субстраты - очень активная область текущих исследований. Катализаторы в этой области должны бороться с рядом осложняющих факторов, включая тенденцию высокостабильных ароматических соединений сопротивляться гидрированию, потенциальную координирующую (и, следовательно, отравляющую катализатор) способность как субстрата, так и продукта, а также большое разнообразие моделей замещения, которые может присутствовать в любом ароматическом кольце.[58] Из этих субстратов наиболее устойчивый успех был замечен с азотсодержащими гетероциклами, где ароматическое кольцо часто активируется либо протонированием, либо дальнейшей функционализацией азота (обычно электроноакцепторной защитной группой). Такие стратегии менее применимы к кислород- и серосодержащим гетероциклам, поскольку они и менее основные, и менее нуклеофильные; эта дополнительная трудность может помочь объяснить, почему существует мало эффективных методов их асимметричного гидрирования.
Хинолины, изохинолины и хиноксалины
Существуют две системы асимметричного гидрирования 2-замещенных хинолины с изолированными выходами обычно более 80% и значениями ее обычно более 90%. Первый - это иридий (I) / хиральный фосфин / I2 система, о которой впервые сообщил Чжоу и другие.[59] В то время как первым хиральным фосфином, использованным в этой системе, был MeOBiPhep, более новые итерации были сосредоточены на улучшении характеристик этого лиганда. С этой целью в системах используются фосфины (или родственные лиганды) с повышенной стабильностью на воздухе,[60] возможность вторичной переработки,[60] простота приготовления,[61] меньшая загрузка катализатора[19][62] и потенциальная роль добавок ахирального фосфина.[63] По состоянию на октябрь 2012 года, похоже, не было предложено никакого механизма, хотя необходимость I2 или суррогат галогена и возможная роль гетероароматического азота в содействии реакционной способности.[58]
Второй - органокаталитический перенос гидрирования система на основе Эфиры Ганча и хиральный Кислота Бренстеда. В этом случае авторы представляют механизм, при котором изохинолин попеременно протонируется на стадии активации, а затем восстанавливается путем сопряженного добавления гидрида из сложного эфира Ганча.[64]

Большая часть химии асимметричного гидрирования хиноксалинов тесно связана со структурно подобными хинолины. Эффективные (и действенные) результаты могут быть получены с использованием Ir (I) / фосфинита / I2 система[65] и органокаталитическая система на основе эфира Ганца,[66] обе похожи на системы, обсуждавшиеся ранее в отношении хинолины.
Пиридины
Пиридины являются субстратами с высокой вариабельностью для асимметричного восстановления (даже по сравнению с другими гетероароматическими соединениями), поскольку для дифференциального замещения в начальном кольце доступны пять углеродных центров. По состоянию на октябрь 2012 года, похоже, не существует метода, который мог бы контролировать все пять, хотя существует по крайней мере один разумно общий метод.
Наиболее общий метод асимметричного гидрирования пиридина на самом деле является гетерогенным методом, в котором асимметрия создается за счет хирального оксазолидинона, связанного с положением C2 пиридина. Гидрирование таких функционализированных пиридинов на нескольких различных гетерогенных металлических катализаторах дало соответствующий пиперидин с заместителями в положениях C3, C4 и C5 во всемСНГ геометрия, с высоким выходом и отличной энантиоселективностью. Вспомогательный оксазолидинон также удобно расщеплять в условиях гидрирования.[67]

Способы, разработанные специально для гидрирования 2-замещенного пиридина, могут включать асимметричные системы, разработанные для родственных субстратов, таких как 2-замещенные хинолины и хиноксалины. Например, хиральный фосфин иридия (I)2 система эффективна в асимметричном гидрировании активированных (алкилированных) 2-пиридиний[68] или определенные пиридины, конденсированные с циклогексаноном.[69] Аналогично хиральный Кислота Бренстеда Катализ сложным эфиром Ганца в качестве источника гидрида эффективен для некоторых 2-алкилпиридинов с дополнительным активирующим замещением.[70]
Индолы
Асимметричное гидрирование индолы изначально был сосредоточен на N-защищенные индолы, где защитная группа может служить как для активации гетероцикла для гидрирования, так и в качестве вторичного координационного центра для металла. Более поздняя работа позволила нацелить незащищенные индолы посредством активации индола кислотой Бренстеда.
В первоначальном отчете об асимметричном гидрировании индола, N-ацетил-2-замещенные индолы могут быть защищены с высокими выходами и ее 87-95%. 3-замещенные индолы были менее успешными, с гидролизом защитной группы, превосходящим гидрирование индола.[71] Переход на N-тозильная защитная группа ингибирует реакцию гидролиза и позволяет 2- и 3-замещенным индолам гидрироваться с высоким выходом и ее э.и.[72][73] Однако проблема обоих методов заключается в том, что N-ацетил и N-тозильные группы требуют жестких условий расщепления, которые могут быть несовместимы со сложными субстратами. Используя легко раскалываемый N-Boc группа решит эту проблему, и вскоре были разработаны высокоэффективные методы асимметричного гидрирования таких индолов (как 2-, так и 3-замещенных).[74][75]

Несмотря на эти достижения в области асимметричного гидрирования защищенных индолов, значительная простота работы может быть достигнута путем полного удаления защитной группы. Это было достигнуто с помощью каталитических систем, использующих кислоты Бренстеда для активации индола. В исходной системе использовался Pd (TFA)2/ H8-BINAP для достижения энантиоселективного СНГ-гидрирование 2,3- и 2-замещенных индолов с высоким выходом и отличным э.и. Аналогичный процесс, где последовательный Алкилирование Фриделя-Крафтса а асимметричное гидрирование происходит в одном сосуде, что позволяет селективно получать асимметричные 2,3-замещенные индолины из 2-замещенных индолов с одинаково высокими выходами и ее.[76][77]

Многообещающий органокаталитический Метод асимметричного гидрирования 2,3-замещенных индолов с использованием хирального основания Льюиса также существует, хотя наблюдаемые е.и. не совсем эквивалентны гидрированиям на основе металлов.[76]
Пиррол
Достижение полной конверсии пирролы к пирролидины асимметричное гидрирование до сих пор оказалось трудным, при этом часто наблюдаются продукты частичного гидрирования.[78][79] Возможно полное энантиоселективное восстановление, при этом результат зависит как от исходного субстрата, так и от метода.
Асимметричное гидрирование 2,3,5-замещенных пирролов было достигнуто путем признания того, что такие субстраты имеют тот же паттерн замещения, что и 2-замещенные индолы, и система асимметричного гидрирования, эффективная для одного из этих субстратов, может быть эффективной для обоих. Такой анализ привел к разработке системы оснований рутений (I) / фосфин / амин для 2,3,5-замещенного N-Boc пирролы, которые могут давать дигидро- или тетрагидропирролы (пирролидины), в зависимости от природы пиррольных заместителей. Схема замещения полностью фенилом приводит к дигидропирролам с очень высоким выходом (> 96%) и практически идеальной энантиоселективностью. Доступ к полностью гидрогенизированным, полностьюСНГ дигидропиррол затем может быть доступен посредством диастереоселективного гетерогенного гидрирования. Алкильное замещение может привести либо к дигидро, либо к тетрагидропирролу, хотя выходы (> 70%) и энантиоселективность (часто> 90%) обычно остаются высокими. В региоселективность в обоих случаях, по-видимому, регулируются стерическими факторами, причем менее замещенный двойной предпочтительно гидрируется.[78]

Незащищенные 2,5-пирролы можно также гидрогенизировать асимметрично с помощью метода, катализируемого кислотой Бренстеда / Pd (II) / хиральным фосфином, с получением соответствующих 2,5-дизамещенных 1-пирролины с доходностью примерно 70-80% и 80-90% ее.[79]
Кислородсодержащие гетероциклы
Асимметричное гидрирование фураны и бензофураны до сих пор оказалось сложной задачей.[80] Некоторые комплексы Ru-NHC катализируют асимметричное гидрирование бензофураны[81] и фураны.[82] с высоким уровнем энантиоиндукции.
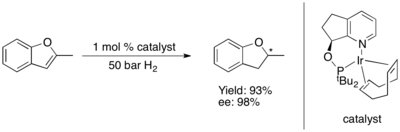
Серосодержащие гетероциклы
Как и в случае с кислородсодержащими гетероциклами, асимметричное гидрирование соединений, в которых сера входит в состав начальной ненасыщенной пи-связь система пока ограничена тиофены и бензотиофены. Ключевой подход к асимметричному гидрированию этих гетероциклов включает катализатор рутений (II) и хиральный C2 симметричный N-гетероциклический карбен (NHC). Эта система, по-видимому, обладает превосходной селективностью (ее> 90%) и прекрасной диастереоселективностью (все СНГ), если субстрат имеет конденсированное (или непосредственно связанное) фенильное кольцо, но дает только рацемический во всех остальных протестированных случаях.[83]

Гетерогенный катализ
Гетерогенный катализатор для асимметричного гидрирования не выпускался.
Первое асимметричное гидрирование было сосредоточено на палладии, нанесенном на шелковую основу. Cinchona алкалоиды были использованы в качестве хиральных модификаторов для гидрирования энантиоселективности.[84]

Альтернативный метод, позволяющий лучше контролировать структурные и электронные свойства активных каталитических центров, - это иммобилизация катализаторов, которые были разработаны для гомогенного катализа на гетерогенном носителе. Ковалентное связывание катализатора с полимером или другим твердым носителем, вероятно, является наиболее распространенным, хотя иммобилизация катализатора также может быть достигнута путем адсорбция на поверхность, ионный обмен, или даже физическая инкапсуляция. Одним из недостатков этого подхода является возможность близости носителя к изменению поведения катализатора, понижая энантиоселективность реакции. Чтобы избежать этого, катализатор часто связывают с носителем с помощью длинного линкера, хотя известны случаи, когда близость носителя может фактически улучшить характеристики катализатора.[84]
Последний подход включает конструирование MOFs, которые включают хиральные реакционные центры из ряда различных компонентов, потенциально включая хиральные и ахиральные органические лиганды, структурные ионы металлов, каталитически активные ионы металлов и / или предварительно собранные каталитически активные металлоорганические ядра.[85] Один из них связан рутений катализаторы на основе. Всего 0,005 мол.% Таких катализаторов оказалось достаточным для достижения асимметричного гидрирования арилкетонов, хотя обычные условия содержали 0,1 мол.% Катализатора и приводили к энантиомерный избыток 90,6–99,2%.[86]

Промышленное применение

Исследования Ноулза по асимметричному гидрированию и его применению для синтеза L-Dopa в промышленных масштабах[3] дал асимметричное гидрирование сильное начало в промышленном мире. Обзор 2001 года показал, что на асимметричное гидрирование приходилось 50% производственных масштабов, 90% пилотных масштабов и 74% лабораторных каталитических энантиоселективных процессов в промышленности, с оговоркой, что асимметричные каталитические методы в целом еще не получили широкого распространения.[87]
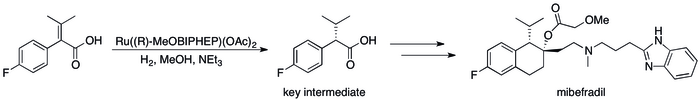
Успех асимметричного гидрирования в промышленности[88] можно увидеть в ряде конкретных случаев, когда замена методов, основанных на кинетическом разрешении, привела к существенному повышению эффективности процесса. Например, Catalysis Group компании Roche удалось добиться синтеза (S,S) -Ro 67-8867 с общим выходом 53%, резкое увеличение по сравнению с 3,5%, которое было достигнуто при синтезе на основе разрешения.[89] Синтез Рош мибефрадил был также улучшен за счет замены разрешения асимметричным гидрированием, уменьшения количества шагов на три и увеличения выхода ключевого промежуточного продукта до 80% от исходных 70%.[90]
Рекомендации
- ^ Акабори, С .; Sakurai, S .; Izumi, Y .; Фуджи, Ю. (1956). «Асимметричный катализатор». Природа. 178 (4528): 323. Bibcode:1956Натура.178..323А. Дои:10.1038 / 178323b0. PMID 13358737. S2CID 4221816.
- ^ а б c Нойори, Р. (2003). «Асимметричный катализ: наука и возможности (Нобелевская лекция 2001 г.)». Расширенный синтез и катализ. 345 (12): 15–41. Дои:10.1002 / adsc.200390002.
- ^ а б c Ноулз, В. С. (2002). «Асимметричное гидрирование (Нобелевская лекция)». Angewandte Chemie International Edition. 41 (12): 1998–2007. Дои:10.1002 / 1521-3773 (20020617) 41:12 <1998 :: AID-ANIE1998> 3.0.CO; 2-8. PMID 19746594.
- ^ Пфальц, А. (2004). «Особая характеристика асимметричного катализа, часть II: Разработка хиральных лигандов для асимметричного катализа: от C2-симметричный п,п- и N,N-лиганды к стерически и электронно несимметричным п,N-лиганды ». Труды Национальной академии наук. 101 (16): 5723–5726. Bibcode:2004ПНАС..101.5723П. Дои:10.1073 / pnas.0307152101. ЧВК 395974. PMID 15069193.
- ^ а б Гриднев И.Д .; Имамото, Т. (2004). «О механизме стереоселекции в Rh-катализируемом асимметричном гидрировании: общий подход к прогнозированию чувства энантиоселективности». Отчеты о химических исследованиях. 37 (9): 633–644. Дои:10.1021 / ar030156e. PMID 15379579.
- ^ Knowles, W. S .; Сабацкий, М. Дж. (1968). «Каталитическое асимметричное гидрирование с использованием растворимого, оптически активного родиевого комплекса». Химические коммуникации (Лондон) (22): 1445. Дои:10.1039 / C19680001445.
- ^ Pilkington, C .; Леннон, И. (2003). «Применение асимметричного гидрирования для производства фармацевтических промежуточных продуктов: необходимость разнообразия катализаторов». Синтез. 2003 (11): 1639. Дои:10.1055 / с-2003-40871.
- ^ Мияшита, А .; Ясуда, А .; Takaya, H .; Toriumi, K .; Ито, Т .; Souchi, T .; Нойори, Р. (1980). «Синтез 2,2'-бис (дифенилфосфино) -1,1'-бинафтила (BINAP), атропоизомерного хирального бис (триарил) фосфина, и его использование в катализируемом родием (I) асимметричном гидрировании α- (ациламино) ) акриловые кислоты ». Журнал Американского химического общества. 102 (27): 7932. Дои:10.1021 / ja00547a020.
- ^ Noyori, R .; Окума, Т .; Китамура, М .; Takaya, H .; Sayo, N .; Kumobayashi, H .; Акутагава, С. (1987). «Асимметричное гидрирование эфиров β-кетокарбоновых кислот. Практический чисто химический доступ к сложным β-гидроксиэфирам с высокой энантиомерной чистотой». Журнал Американского химического общества. 109 (19): 5856. Дои:10.1021 / ja00253a051.
- ^ Окума, Такеши; Сандовал, Кристиан А .; Шринивасан, Раджагопал; Линь, Цинхун; Вэй, Иньмао; Муньис, Килиан; Нойори, Рёдзи (01.06.2005). «Асимметричное гидрирование терт-Алкилкетоны ». Журнал Американского химического общества. 127 (23): 8288–9. Дои:10.1021 / ja052071. ISSN 0002-7863. PMID 15941254.
- ^ Окума, Т .; Hattori, T .; Ooka, H .; Inoue, T .; Нойори, Р. (2004). «Комплексы BINAP / 1,4-диамин-рутений (II) для эффективного асимметричного гидрирования 1-тетралонов и аналогов». Органические буквы. 6 (16): 2681–2683. Дои:10.1021 / ol049157c. PMID 15281743.
- ^ Икария, Т .; Блэкер, А. Дж. (2007). «Асимметричное гидрирование переноса кетонов с бифункциональными молекулярными катализаторами на основе переходных металлов». Отчеты о химических исследованиях. 40 (12): 1300–1308. Дои:10.1021 / ar700134q. PMID 17960897.
- ^ Церковь, Т. Л .; Андерссон, П. Г. (2008). «Иридиевые катализаторы асимметричного гидрирования олефинов с нетрадиционными функциональными заместителями». Обзоры координационной химии. 252 (5–7): 513. Дои:10.1016 / j.ccr.2007.09.015.
- ^ а б Лайтфут, А .; Schnider, P .; Пфальц, А. (1998). «Энантиоселективное гидрирование олефинов с иридий-фосфанодигидрооксазольными катализаторами». Angewandte Chemie International Edition. 37 (20): 2897–2899. Дои:10.1002 / (SICI) 1521-3773 (19981102) 37:20 <2897 :: AID-ANIE2897> 3.0.CO; 2-8. PMID 29711115.
- ^ а б c Xie, J. H .; Лю, X. Y .; Xie, J. B .; Wang, L. X .; Чжоу, К. Л. (2011). «Дополнительная координационная группа ведет к созданию чрезвычайно эффективных хиральных иридиевых катализаторов для асимметричного гидрирования кетонов». Angewandte Chemie International Edition. 50 (32): 7329–32. Дои:10.1002 / anie.201102710. PMID 21751315.
- ^ а б c Pfaltz, A .; Blankenstein, J. R .; Hilgraf, R .; Hörmann, E .; Макинтайр, S .; Menges, F .; Schönleber, M .; Smidt, S.P .; Wüstenberg, B .; Циммерманн, Н. (2003). «Катализируемое иридием энантиоселективное гидрирование олефинов». Расширенный синтез и катализ. 345 (12): 33. Дои:10.1002 / adsc.200390027.
- ^ Cui, X .; Берджесс, К. (2005). «Каталитическое гомогенное асимметричное гидрирование в значительной степени нефункционализированных алкенов». Химические обзоры. 105 (9): 3272–3296. Дои:10.1021 / cr0500131. PMID 16159153.
- ^ Сюй, Ю.; Mingos, D. M. P .; Браун, Дж. М. (2008). "Катализатор Крэбтри еще раз; лиганд влияет на стабильность и долговечность". Химические коммуникации (2): 199–201. Дои:10.1039 / B711979H. PMID 18092086.
- ^ а б Wang, Z. J .; Deng, G.J .; Li, Y .; Он, Ю. М .; Tang, W. J .; Фан, К. Х. (2007). «Энантиоселективное гидрирование хинолинов, катализируемое Ir (BINAP) -селенными дендримерами: резкое усиление каталитической активности». Органические буквы. 9 (7): 1243–1246. Дои:10.1021 / ol0631410. PMID 17328554.
- ^ а б Zhu, S. F .; Xie, J. B .; Zhang, Y. Z .; Li, S .; Чжоу, К. Л. (2006). «Четко определенные хиральные катионные комплексы спиро-иридий / фосфин-оксазолин для высокоэнантиоселективного гидрирования иминов при атмосферном давлении». Журнал Американского химического общества. 128 (39): 12886–12891. Дои:10.1021 / ja063444p. PMID 17002383.
- ^ а б Blaser, H.U .; Пугин, Б. Т .; Spindler, F .; Тонни, А. (2002). «Энантиоселективное гидрирование имина с катализаторами дифосфина Ir: борьба с дезактивацией». Comptes Rendus Chimie. 5 (5): 379. Дои:10.1016 / S1631-0748 (02) 01391-7.
- ^ Enthaler, S .; Junge, K .; Беллер, М. (2008). «Устойчивый металлический катализ с помощью железа: от ржавчины к восходящей звезде?». Angewandte Chemie International Edition. 47 (18): 3317–21. Дои:10.1002 / anie.200800012. PMID 18412184.
- ^ Михайлин, А .; Lough, A.J .; Моррис, Р. Х. (2009). «Эффективное асимметричное гидрирование кетонов, катализируемое комплексом железа, содержащим тетрадентатный лиганд P-N-N-P, образованный синтезом матрицы». Журнал Американского химического общества. 131 (4): 1394–1395. Дои:10.1021 / ja809493h. PMID 19133772.
- ^ Sonnenberg, J. F .; Coombs, N .; Dube, P. A .; Моррис, Р. Х. (2012). «Наночастицы железа, катализирующие асимметричное переносное гидрирование кетонов». Журнал Американского химического общества. 134 (13): 5893–5899. Дои:10.1021 / ja211658t. PMID 22448656.
- ^ Уайтселл, Дж. К. (1989). "C2 симметрия и асимметричная индукция ». Химические обзоры. 89 (7): 1581–1590. Дои:10.1021 / cr00097a012.
- ^ Knowles, W. S .; Sabacky, M. J .; Виноградник, Б. Д. (1972). «Каталитическое асимметричное гидрирование». Журнал химического общества, химические коммуникации (1): 10. Дои:10.1039 / C39720000010. PMID 4270504.
- ^ а б Jerphagnon, T .; Renaud, J. L .; Бруно, К. (2004). «Хиральные монодентатные лиганды фосфора для катализируемого родием асимметричного гидрирования». Тетраэдр: асимметрия. 15 (14): 2101. Дои:10.1016 / j.tetasy.2004.04.037.
- ^ Van Den Berg, M .; Миннаард, А. Дж .; Schudde, E. P .; Ван Эш, Дж .; De Vries, A.H.M .; De Vries, J. G .; Феринга, Б. Л. (2000). «Высокоэнантиоселективное гидрирование, катализируемое родием, с монодентатными лигандами» (PDF). Журнал Американского химического общества. 122 (46): 11539. Дои:10.1021 / ja002507f.
- ^ Fu, Y .; Xie, J. H .; Hu, A. G .; Чжоу, H .; Wang, L. X .; Чжоу, К. Л. (2002). «Новые монодентатные спирофосфорные лиганды для реакций гидрирования, катализируемых родием». Химические коммуникации (5): 480–481. Дои:10.1039 / B109827F. PMID 12120551.
- ^ Reetz, M. T .; Продам, т .; Meiswinkel, A .; Мехлер, Г. (2003). «Новый принцип комбинаторного асимметричного катализа переходных металлов: смеси хиральных монодентатных лигандов P». Angewandte Chemie International Edition. 42 (7): 790–3. Дои:10.1002 / anie.200390209. PMID 12596201.
- ^ Виноградник, Б. Д .; Knowles, W. S .; Sabacky, M. J .; Бахман, Г. Л .; Вейнкауфф, Д. Дж. (1977). «Асимметричное гидрирование. Родиевый хиральный бисфосфиновый катализатор». Журнал Американского химического общества. 99 (18): 5946. Дои:10.1021 / ja00460a018.
- ^ Knowles, W. S .; Sabacky, M. J .; Виноградник, Б. Д .; Вейнкауфф, Д. Дж. (1975). «Асимметричное гидрирование с комплексом родия и хирального бисфосфина». Журнал Американского химического общества. 97 (9): 2567. Дои:10.1021 / ja00842a058.
- ^ Müller, D .; Umbricht, G .; Вебер, Б .; Пфальц, А. (1991). "C2-Симметричные 4,4 ', 5,5'-Тетрагидроби (оксазолы) и 4,4', 5,5'-Тетрагидро-2,2'-метиленбис [оксазолы] как хиральные лиганды для предварительной связи энантиоселективного катализа ». Helvetica Chimica Acta. 74: 232–240. Дои:10.1002 / hlca.19910740123.
- ^ а б Helmchen, G. N .; Пфальц, А. (2000). «Фосфинооксазолины - новый класс универсальных, модульных п,N-Лиганды для асимметричного катализа ». Отчеты о химических исследованиях. 33 (6): 336–345. Дои:10.1021 / ar9900865. PMID 10891051.
- ^ Franzke, A .; Пфальц, А. (2011). «Цвиттерионные иридиевые комплексы с п,N-Лиганды как катализаторы асимметричного гидрирования алкенов ». Химия: европейский журнал. 17 (15): 4131–44. Дои:10.1002 / chem.201003314. PMID 21381140.
- ^ Maurer, F .; Huch, V .; Ullrich, A .; Казмайер, У. (2012). «Разработка катализаторов стереоселективного гидрирования α, β-ненасыщенных кетонов». Журнал органической химии. 77 (11): 5139–5143. Дои:10.1021 / jo300246c. PMID 22571628.
- ^ Rageot, D .; Woodmansee, D. H .; Пугин, Б. Т .; Пфальц, А. (2011). «Комплексы P, O лиганд / иридий на основе пролина в качестве высокоселективных катализаторов: асимметричное гидрирование тризамещенных алкенов». Angewandte Chemie International Edition. 50 (41): 9598–601. Дои:10.1002 / anie.201104105. PMID 21882320.
- ^ а б c Perry, M.C .; Cui, X .; Powell, M. T .; Hou, D. R .; Reibenspies, J. H .; Берджесс, К. (2003). «Оптически активные иридий имидазол-2-илиденоксазолиновые комплексы: получение и использование в асимметричном гидрировании арилалкенов». Журнал Американского химического общества. 125 (1): 113–123. Дои:10.1021 / ja028142b. PMID 12515512.
- ^ а б Nanchen, S .; Пфальц, А. (2006). «Синтез и применение хирального N-Гетероциклические карбен-оксазолиновые лиганды: энантиоселективное гидрирование, катализируемое иридием ». Химия: европейский журнал. 12 (17): 4550–8. Дои:10.1002 / chem.200501500. PMID 16557626.
- ^ Zhu, Y .; Берджесс, К. (2008). «Катализируемое иридием асимметричное гидрирование виниловых эфиров». Расширенный синтез и катализ. 350 (7–8): 979. Дои:10.1002 / adsc.200700546.
- ^ Zhao, J .; Берджесс, К. (2009). «Хироны альдольного типа от асимметричного гидрирования тризамещенных алкенов». Органические буквы. 11 (10): 2053–2056. Дои:10.1021 / ol900308w. PMID 19368378.
- ^ Zhao, J .; Берджесс, К. (2009). «Синтез вицинальных диметилхиронов асимметричным гидрированием тризамещенных алкенов». Журнал Американского химического общества. 131 (37): 13236–13237. Дои:10.1021 / ja905458n. PMID 19719102.
- ^ Чжоу, Дж .; Берджесс, К. (2007). «, Ω-функционализированные диады 2,4-диметилпентана и триады 2,4,6-триметилгептана посредством асимметричного гидрирования». Angewandte Chemie International Edition. 46 (7): 1129–31. Дои:10.1002 / anie.200603635. PMID 17200966.
- ^ Чжоу, Дж .; Zhu, Y .; Берджесс, К. (2007). «Синтез (S,р,р,S,р,S) -4,6,8,10,16,18-гексаметилдокозан из Антитрогус парвулюс через диастереоселективное гидрирование ". Органические буквы. 9 (7): 1391–1393. Дои:10.1021 / ol070298z. PMID 17338543.
- ^ Городской, С .; Ortega, N .; Глориус, Ф. (2011). «Регулируемое лигандом высоко региоселективное и асимметричное гидрирование хиноксалинов, катализируемое рутением» N-Гетероциклические карбеновые комплексы ». Angewandte Chemie International Edition. 50 (16): 3803–6. Дои:10.1002 / anie.201100008. PMID 21442699.
- ^ Pàmies, O .; Andersson, P.G .; Дьегес, М. (2010). «Асимметричное гидрирование минимально функционализированных концевых олефинов: альтернативная устойчивая и прямая стратегия получения энантиообогащенных углеводородов». Химия: европейский журнал. 16 (48): 14232–40. Дои:10.1002 / chem.201001909. PMID 21140401.
- ^ Woodmansee, D. H .; Пфальц, А. (2011). «Асимметричное гидрирование алкенов без координационных групп». Химические коммуникации. 47 (28): 7912–7916. Дои:10.1039 / c1cc11430a. PMID 21556431.
- ^ Mazuela, J .; Verendel, J. J .; Coll, M .; SchäFfner, B.N .; BöRner, A .; Андерссон, П. Г .; PàMies, O .; ДиГез, М. (2009). «Иридийфосфитоксазолиновые катализаторы для высокоэнантиоселективного гидрирования концевых алкенов». Журнал Американского химического общества. 131 (34): 12344–12353. Дои:10.1021 / ja904152r. PMID 19658416.
- ^ Hou, G.H .; Xie, J. H .; Wang, L. X .; Чжоу, К. Л. (2006). «Высокоэффективное Rh (I) -катализируемое асимметричное гидрирование енаминов с использованием монодентных спирофосфонитных лигандов». Журнал Американского химического общества. 128 (36): 11774–11775. Дои:10.1021 / ja0644778. PMID 16953614.
- ^ Hou, G.H .; Xie, J. H .; Ян, П. С .; Чжоу, К. Л. (2009). «Катализируемое иридием асимметричное гидрирование циклических енаминов». Журнал Американского химического общества. 131 (4): 1366–1367. Дои:10.1021 / ja808358r. PMID 19132836.
- ^ Окума, Т .; Ooka, H .; Hashiguchi, S .; Икария, Т .; Нойори, Р. (1995). «Практическое энантиоселективное гидрирование ароматических кетонов». Журнал Американского химического общества. 117 (9): 2675. Дои:10.1021 / ja00114a043.
- ^ Noyori, R .; Окума, Т. (2001). «Асимметричный катализ с помощью архитектурной и функциональной молекулярной инженерии: практическое химио- и стереоселективное гидрирование кетонов». Angewandte Chemie International Edition. 40 (1): 40–73. Дои:10.1002 / 1521-3773 (20010105) 40: 1 <40 :: AID-ANIE40> 3.0.CO; 2-5. PMID 11169691.
- ^ Hems, W. P .; Groarke, M .; Zanotti-Gerosa, A .; Граса, Г. А. (2007). «Комплексы [(Бисфосфин) Ru (II) Диамина] в асимметричном гидрировании: Расширение области применения диаминового лиганда». Отчеты о химических исследованиях. 40 (12): 1340–1347. Дои:10.1021 / ar7000233. PMID 17576143.
- ^ Noyori, R .; Yamakawa, M .; Хасигучи, С. (2001). «Бифункциональный катализ металл-лиганд: неклассический механизм асимметричного переноса водорода между спиртами и карбонильными соединениями». Журнал органической химии. 66 (24): 7931–7944. Дои:10.1021 / jo010721w. PMID 11722188.
- ^ Ю, З .; Jin, W .; Цзян, К. (2012). «Стратегия активации кислоты Бренстеда в асимметричном гидрировании, катализируемом переходными металлами. N-Незащищенные имины, енамины и N-Гетероароматические соединения ». Angewandte Chemie International Edition. 51 (25): 6060–72. Дои:10.1002 / anie.201200963. PMID 22577004.
- ^ Hou, G .; Gosselin, F .; Li, W .; McWilliams, J.C .; Sun, Y .; Weisel, M .; O'Shea, P.D .; Chen, C. Y .; Davies, I.W .; Чжан, X. (2009). «Энантиоселективное гидрирование N-H иминов». Журнал Американского химического общества. 131 (29): 9882–9883. Дои:10.1021 / ja903319r. PMID 19569686.
- ^ Hou, G .; Tao, R .; Sun, Y .; Чжан, X .; Госселин, Ф. (2010). "Иридий-монодентатное фосфорамидит-катализируемое асимметричное гидрирование замещенных N-H иминов бензофенона". Журнал Американского химического общества. 132 (7): 2124–2125. Дои:10.1021 / ja909583s. PMID 20104899.
- ^ а б Чжоу, Ю. Г. (2007). «Асимметричное гидрирование гетероароматических соединений». Отчеты о химических исследованиях. 40 (12): 1357–1366. CiteSeerX 10.1.1.653.5495. Дои:10.1021 / ar700094b. PMID 17896823.
- ^ Wang, W. B .; Лу, С. М .; Yang, P. Y .; Хан, X. W .; Чжоу, Ю. Г. (2003). «Высокоэнантиоселективное гидрирование гетероароматических соединений, хинолинов, катализируемое иридием». Журнал Американского химического общества. 125 (35): 10536–10537. CiteSeerX 10.1.1.651.3119. Дои:10.1021 / ja0353762. PMID 12940733.
- ^ а б Xu, L .; Lam, K. H .; Ji, J .; Wu, J .; Fan, Q.H .; Lo, W. H .; Чан, А.С.С. (2005). «Стабильный на воздухе Ir- (P-Phos) комплекс для высокоэнантиоселективного гидрирования хинолинов и их иммобилизации в поли (этиленгликоль) диметиловом эфире (DMPEG)». Химические коммуникации (11): 1390–2. Дои:10.1039 / B416397D. PMID 15756313.
- ^ Lam, K. H .; Xu, L .; Feng, L .; Fan, Q.H .; Lam, F. L .; Lo, W. H .; Чан, А.С.С. (2005). «Высокоэнантиоселективное катализируемое иридием гидрирование производных хинолина с использованием хирального фосфинита H8-BINAPO». Расширенный синтез и катализ. 347 (14): 1755. Дои:10.1002 / adsc.200505130.
- ^ Qiu, L .; Kwong, F. Y .; Wu, J .; Lam, W. H .; Chan, S .; Yu, W. Y .; Li, Y.M .; Guo, R .; Чжоу, З .; Чан, А.С.С. (2006). «Новый класс универсальных атропоизомерных дифосфиновых лигандов с хиральным мостиком: необычайно эффективные синтезы лигандов и их применение в высокоэнантиоселективных реакциях гидрирования». Журнал Американского химического общества. 128 (17): 5955–5965. Дои:10.1021 / ja0602694. PMID 16637664.
- ^ Reetz, M. T .; Ли, X. (2006). «Асимметричное гидрирование хинолинов, катализируемое иридиевыми комплексами дифосфонитов, полученных из BINOL». Химические коммуникации (20): 2159–60. Дои:10,1039 / b602320g. PMID 16703140.
- ^ Rueping; Антончик, А .; Тайссманн, Т. (2006). «Высокоэнантиоселективная каскадная реакция Бренстеда, катализируемая кислотой: органокаталитическое гидрирование с переносом хинолинов и их применение в синтезе алкалоидов». Angewandte Chemie International Edition на английском языке. 45 (22): 3683–3686. Дои:10.1002 / anie.200600191. PMID 16639754.
- ^ Tang, W .; Xu, L .; Fan, Q.H .; Wang, J .; Вентилятор, Б .; Чжоу, З .; Lam, K. H .; Чан, А.С.С. (2009). «Асимметричное гидрирование хиноксалинов с дифосфинитными лигандами: практический синтез энантиообогащенных, замещенных тетрагидрохиноксалинов». Angewandte Chemie International Edition. 48 (48): 9135–8. Дои:10.1002 / anie.200904518. PMID 19876991.
- ^ Rueping, M .; Тато, Ф .; Шёпке, Ф. Р. (2010). «Первое общее, эффективное и высокоэнантиоселективное восстановление хиноксалинов и хиноксалинонов». Химия: европейский журнал. 16 (9): 2688–91. Дои:10.1002 / chem.200902907. PMID 20140920.
- ^ Glorius, F .; Spielkamp, N .; Holle, S .; Goddard, R .; Леманн, К. В. (2004). «Эффективное асимметричное гидрирование пиридинов». Angewandte Chemie International Edition. 43 (21): 2850–2. Дои:10.1002 / anie.200453942. PMID 15150766.
- ^ Ye, Z. S .; Chen, M. W .; Chen, Q. A .; Shi, L .; Duan, Y .; Чжоу, Ю. Г. (2012). «Катализируемое иридием асимметричное гидрирование солей пиридиния». Angewandte Chemie International Edition. 51 (40): 10181–4. Дои:10.1002 / anie.201205187. PMID 22969060.
- ^ Tang, W. J .; Tan, J .; Xu, L.J .; Lam, K. H .; Fan, Q.H .; Чан, А.С.С. (2010). «Высокоэнантиоселективное гидрирование производных хинолина и пиридина с иридий- (P-Phos) катализатором». Расширенный синтез и катализ. 352 (6): 1055. Дои:10.1002 / adsc.200900870.
- ^ Rueping, M .; Антончик, А. П. (2007). «Органокаталитическое энантиоселективное восстановление пиридинов». Angewandte Chemie International Edition. 46 (24): 4562–5. Дои:10.1002 / anie.200701158. PMID 17492817.
- ^ Kuwano, R .; Sato, K .; Курокава, Т .; Karube, D .; Ито, Ю. (2000). «Каталитическое асимметричное гидрирование гетероароматических соединений, индолов». Журнал Американского химического общества. 122 (31): 7614. Дои:10.1021 / ja001271c.
- ^ Kuwano, R .; Kaneda, K .; Ито, Т .; Sato, K .; Курокава, Т .; Ито, Ю. (2004). «Высокоэнантиоселективный синтез хиральных 3-замещенных индолинов каталитическим асимметричным гидрированием индолов». Органические буквы. 6 (13): 2213–2215. Дои:10.1021 / ol049317k. PMID 15200323.
- ^ Kuwano, R .; Kashiwabara, M .; Sato, K .; Ито, Т .; Kaneda, K .; Ито, Ю. (2006). «Каталитическое асимметричное гидрирование индолов с использованием родиевого комплекса с хиральным бисфосфиновым лигандом PhTRAP». Тетраэдр: асимметрия. 17 (4): 521. Дои:10.1016 / j.tetasy.2006.01.016.
- ^ Kuwano, R .; Кашивабара, М. (2006). "Катализируемое рутением асимметричное гидрирование N-Бок-Индол ». Органические буквы. 8 (12): 2653–2655. Дои:10.1021 / ol061039x. PMID 16737337.
- ^ Baeza, A .; Пфальц, А. (2010). «Катализируемое иридием асимметричное гидрирование N-Защищенные индолы ». Химия: европейский журнал. 16 (7): 2036–9. Дои:10.1002 / chem.200903105. PMID 20104554.
- ^ а б Xiao, Y.C .; Wang, C .; Yao, Y .; Sun, J .; Чен, Ю.С. (2011). «Прямое асимметричное гидросилилирование индолов: комбинированное основание Льюиса и активация кислоты Бренстеда». Angewandte Chemie International Edition. 50 (45): 10661–4. Дои:10.1002 / anie.201105341. PMID 21932274.
- ^ Duan, Y .; Chen, M. W .; Ye, Z. S .; Wang, D. S .; Chen, Q. A .; Чжоу, Ю. Г. (2011). «Энантиоселективный подход к 2,3-дизамещенным индолинам посредством последовательных тандемных реакций кислоты Бренстеда / Pd-комплекса». Химия: европейский журнал. 17 (26): 7193–7. Дои:10.1002 / chem.201100576. PMID 21567504.
- ^ а б Kuwano, R .; Kashiwabara, M .; Ohsumi, M .; Кусано, Х. (2008). «Каталитическое асимметричное гидрирование 2,3,5-тризамещенных пирролов». Журнал Американского химического общества. 130 (3): 808–809. Дои:10.1021 / ja7102422. PMID 18154340.
- ^ а б Wang, D. S .; Ye, Z. S .; Chen, Q. A .; Чжоу, Ю. Г .; Yu, C.B .; Fan, H.J .; Дуань, Ю. (2011). «Высокоэнантиоселективное частичное гидрирование простых пирролов: легкий доступ к хиральным 1-пирролинам». Журнал Американского химического общества. 133 (23): 8866–8869. Дои:10.1021 / ja203190t. PMID 21591641.
- ^ Wang, D. S .; Chen, Q. A .; Лу, С. М .; Чжоу, Ю. Г. (2012). «Асимметричное гидрирование гетероаренов и аренов». Химические обзоры. 112 (4): 2557–2590. Дои:10.1021 / cr200328h. PMID 22098109.
- ^ Ортега, Нурия; Городской, Славомир; Бейринг, Бернхард; Глориус, Франк (2012). "Высокоасимметричное гидрирование бензофуранов, катализируемое каталитическим NHC рутением". Angewandte Chemie International Edition. 51 (7): 1710–3. Дои:10.1002 / anie.201107811. PMID 22311814.
- ^ Высоцкий, Енджей; Ортега, Нурия; Глориус, Франк (2014). «Асимметричное гидрирование дизамещенных фуранов». Angewandte Chemie International Edition. 53 (33): 8751–5. Дои:10.1002 / anie.201310985. PMID 24554623.
- ^ Городской, С .; Бейринг, Б .; Ortega, N .; Paul, D .; Глориус, Ф. (2012). «Асимметричное гидрирование тиофенов и бензотиофенов». Журнал Американского химического общества. 134 (37): 15241–15244. Дои:10.1021 / ja306622y. PMID 22934527.
- ^ а б Heitbaum, M .; Glorius, F .; Эшер, И. (2006). «Асимметричный гетерогенный катализ». Angewandte Chemie International Edition. 45 (29): 4732–62. Дои:10.1002 / anie.200504212. PMID 16802397.
- ^ Юн, М .; Srirambalaji, R .; Ким, К. (2012). «Гомохиральные металлоорганические каркасы для асимметричного гетерогенного катализа». Химические обзоры. 112 (2): 1196–1231. Дои:10.1021 / cr2003147. PMID 22084838.
- ^ Ху, А .; Ngo, H.L .; Лин, В. (2003). «Хиральные пористые гибридные твердые вещества для практического гетерогенного асимметричного гидрирования ароматических кетонов». Журнал Американского химического общества. 125 (38): 11490–11491. Дои:10.1021 / ja0348344. PMID 13129339.
- ^ Blaser, H.U .; Spindler, F .; Студер, М. (2001). «Энантиоселективный катализ в производстве тонкой химии». Прикладной катализ A: Общие. 221 (1–2): 119–143. Дои:10.1016 / S0926-860X (01) 00801-8. PMID 12613584.
- ^ Дуб, Павел А .; Гордон, Джон С. (2018). «Роль связанной с металлом функциональности N – H в молекулярных катализаторах типа Нойори». Обзоры природы Химия. 2 (12): 396–408. Дои:10.1038 / s41570-018-0049-z. S2CID 106394152.
- ^ Блазер, Ганс-Ульрих; Федерсель, Ханс-Юрген, ред. (2010). Асимметричный катализ в промышленных масштабах. Вайнхайм: Wiley-VCH. С. 13–16. Дои:10.1002/9783527630639. ISBN 978-3-527-63063-9.
- ^ Jacobsen, E.N .; Пфальц, Андреас; Ямамато, Х., ред. (1999). Комплексный асимметричный катализ. Берлин; Нью-Йорк: Спрингер. С. 1443–1445. ISBN 978-3-540-64336-4.



