Медроксипрогестерона ацетат - Medroxyprogesterone acetate
 |
|
 |
|
| Клинические данные | |
|---|---|
| Произношение | /мɛˌdрɒksяпрoʊˈdʒɛsтəroʊпˈæsɪтeɪт/ мне-ДРОКС-ее-про-JES-tər-ohn ЖОПА-и-тайт[1] |
| Торговые наименования | Provera, Depo-Provera, Depo-SubQ Provera 104, Curretab, Cycrin, Farlutal, Gestapuran, Perlutex, Veramix, другие[2] |
| Другие имена | МПА; ДМПА; Метилгидрокси |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a604039 |
|
Беременность категория |
|
|
Маршруты администрация |
Устно, сублингвальный, внутримышечная инъекция, подкожная инъекция |
| Класс препарата | Прогестаген; Прогестин; Эфир прогестагена; Антигонадотропин; Стероидные антиандрогены |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | Внутрь: ~ 100%[3][4] |
| Связывание с белками | 88% (до альбумин )[4] |
| Метаболизм | Печень (гидроксилирование (CYP3A4 ), снижение, спряжение )[5][3][8] |
| Устранение период полураспада |
Внутрь: 12–33 часа[5][3] Я (водн. Susp. ): ~ 50 дней[6] SC (водн. Susp.): ~ 40 дней[7] |
| Экскреция | Моча (в качестве конъюгирует )[5] |
| Идентификаторы | |
|
|
| Количество CAS |
|
| PubChem CID |
|
| IUPHAR / BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| КЕГГ |
|
| ЧЭБИ |
|
| ЧЭМБЛ |
|
| Панель управления CompTox (EPA) |
|
| ECHA InfoCard | 100.000.689 |
| Химические и физические данные | |
| Формула | C24ЧАС34О4 |
| Молярная масса | 386.532 г · моль−1 |
| 3D модель (JSmol ) |
|
| Температура плавления | От 207 до 209 ° C (от 405 до 408 ° F) |
|
|
|
|
| (проверять) | |
Медроксипрогестерона ацетат (MPA), также известный как депо ацетат медроксипрогестерона (DMPA) в инъекционный форме и продается под торговой маркой Депо-Провера среди прочего, это гормональные препараты из прогестин тип.[9][3] Он используется как метод контроль рождаемости и в составе менопаузальная гормональная терапия.[9][3] Он также используется для лечения эндометриоз, аномальное маточное кровотечение, ненормальная сексуальность у мужчин, и некоторые типы рак.[9] Препарат доступен как отдельно, так и в сочетании с эстроген.[10][11] Принято устно, использовал под языком, или инъекция в мышцу или же толстый.[9]
Общий побочные эффекты включают нарушения менструального цикла Такие как отсутствие месячных, боль в животе, и головные боли.[9] Более серьезные побочные эффекты включают: потеря костной массы, сгустки крови, аллергические реакции, и проблемы с печенью.[9] Не рекомендуется использовать во время беременность как бы то ни было навредить ребенку.[9] MPA - это искусственный прогестаген, и как таковой активирует в рецептор прогестерона, то биологическая мишень из прогестерон.[3] Он также имеет слабые глюкокортикоид активность и очень слабая андрогенный деятельность, но не другое важное гормональный Мероприятия.[3][12] Благодаря своей прогестагенной активности, MPA снижает высвобождение организмом гонадотропины и может подавить половой гормон уровни.[13] Он работает как форма контроля над рождаемостью, предотвращая овуляция.[9]
MPA был открыт в 1956 году и был внедрен для медицинского использования в Соединенные Штаты в 1959 г.[14][15][9] Это на Список основных лекарственных средств Всемирной организации здравоохранения.[16] МПА - наиболее широко используемый прогестин в гормональной терапии менопаузы и только прогестагеновые противозачаточные средства.[17][18] DMPA одобрен для использования в качестве средства контроля над рождаемостью длительного действия более чем в 100 странах.[19][20] В 2017 году это было 222-е место среди наиболее часто назначаемых лекарств в Соединенных Штатах: было выписано более двух миллионов рецептов.[21][22]
Медицинское использование
Чаще всего MPA используется в форме DMPA как средство длительного действия. инъекционные контрацептивы, содержащие только прогестагены для предотвращения беременности у женщин. Это чрезвычайно эффективный контрацептив при использовании с относительно высокими дозами для предотвращения овуляция. МПА также используется в сочетании с эстрогеном при менопаузальная гормональная терапия в постменопаузальный женщин лечить и предотвращать симптомы менопаузы Такие как приливы, вагинальная атрофия, и остеопороз.[3] Он используется в гормональной терапии менопаузы специально для предотвращения гиперплазия эндометрия и рак которые в противном случае были бы вызваны продолжительной безальтернативной терапией эстрогенами у женщин с интактным матки.[3][23] Помимо контрацепции и гормональной терапии менопаузы, МПА используется для лечения гинекологический и нарушения менструального цикла Такие как дисменорея, аменорея, и эндометриоз.[24] Наряду с другими прогестинами, MPA был разработан для пероральной прогестагенной терапии, так как прогестерон (гормон прогестагена, вырабатываемый человеческим организмом) нельзя было принимать перорально в течение многих десятилетий до процесса микронизация была разработана и стала возможной с точки зрения фармацевтическое производство.[25]
ДМПА снижает половое влечение у мужчин и используется как форма химическая кастрация контролировать неуместное или нежелательное сексуальное поведение в тех, у кого парафилии или же гиперсексуальность, в том числе осужденных сексуальные преступники.[26][27] DMPA также использовался для лечения доброкачественная гиперплазия предстательной железы, как паллиативный стимулятор аппетита за рак пациентов, и в высоких дозах (800 мг в день) для лечения некоторых гормонозависимый рак включая рак эндометрия, рак почек, и рак молочной железы.[28][29][30][31][32] MPA также был прописан в феминизирующая гормональная терапия за трансгендерные женщины из-за его прогестагенный и функциональный антиандрогенный последствия.[33] Он использовался для задержки полового созревания у детей с преждевременное половое созревание но не подходит для этой цели, поскольку не может полностью подавить половое созревание.[34] Сообщалось, что ДМПА в высоких дозах окончательно эффективен при лечении гирсутизм также.[35]
Хотя не используется для лечения эпилепсия, MPA снижает частоту припадки и не взаимодействует с противоэпилептический лекарства. MPA не мешает свертывание крови и, по-видимому, улучшает параметры крови у женщин с серповидноклеточная анемия. Точно так же MPA не влияет на печень метаболизм, и может улучшить первичный билиарный цирроз и хронический активный гепатит. Женщины, принимающие МПА, могут испытывать пятнистость вскоре после начала приема лекарств, но обычно не настолько серьезны, чтобы требовать медицинского вмешательства. При более длительном использовании аменорея (отсутствие менструация ) может произойти как может нерегулярные менструации что является основным источником неудовлетворенности, хотя оба могут привести к улучшению недостаток железа и риск воспалительное заболевание органов малого таза и часто не приводят к прекращению приема лекарства.[29]
Контроль рождаемости
| Депо медроксипрогестерона ацетат (ДМПА) | |
|---|---|
 |
|
| Фон | |
| Тип | Гормональный |
| Первое использование | 1969[36] |
| Торговые наименования | Depo-Provera, Depo-SubQ Provera 104, другие |
| AHFS /Drugs.com | депо-провера |
| Показатели отказов (первый год) | |
| Идеальное использование | 0.2%[37] |
| Типичное использование | 6%[37] |
| использование | |
| Эффект длительности | 3 месяца (12–14 недель) |
| Обратимость | 3–18 месяцев |
| Напоминания пользователя | Максимальный интервал - чуть менее 3 месяцев |
| Обзор клиники | 12 недель |
| Преимущества и недостатки | |
| ИППП защита | Нет |
| Недостатки периода | Особенно при первой инъекции могут быть частые кровянистые выделения. |
| Преимущества периода | Обычно менструации после 2-й инъекции нет. |
| Преимущества | Особенно хорошо при плохом соблюдении режима приема таблеток. Снижает риск рака эндометрия. |
| Риски | Снижение плотности костей, которая может исчезнуть после отмены |
| Медицинские заметки | |
| Тем, кто намеревается создать семью, рекомендуется перейти за 6 месяцев до альтернативного метода (например, Поп ), что обеспечивает более надежный возврат фертильности. | |
DMPA под торговыми марками, такими как Depo-Provera и Depo-SubQ Provera 104, используется в гормональные противозачаточные в качестве инъекционного контрацептива длительного действия, содержащего только гестагены, для предотвращения беременности у женщин.[38][39] Это дается внутримышечный или же подкожная инъекция и образует длительный депо, из которого он медленно высвобождается в течение нескольких месяцев. Для вступления в силу требуется одна неделя, если вводится после первых пяти дней цикла менструации, и действует немедленно, если вводится в течение первых пяти дней цикла менструации. По оценкам, процент отказов в первый год составляет около 0,3%.[40] MPA эффективно предотвращает беременность, но не защищает от инфекции, передающиеся половым путем (ИППП).
Эффективность
По оценкам Трассела идеальное использование частота неудач в первый год для DMPA как средняя частота неудач в семи клинических испытаниях составляет 0,3%.[40][41] Считалось идеальное использование потому что в клинических испытаниях измерялась эффективность во время фактического использования ДМПА, определяемого как не более 14 или 15 недель после инъекции (т.е. не более чем на 1 или 2 недели с опозданием для следующей инъекции).
До 2004 года компания Трассела типичное использование частота отказов для DMPA была такой же, как у его идеальное использование процент отказов: 0,3%.[42]
- DMPA оценивается типичное использование интенсивность отказов в первый год = 0,3% в:
В 2004 г., используя показатель отказов NSFG 1995 г., Трассел увеличил (в 10 раз) типичное использование процент отказов для ДМПА от 0,3% до 3%.[40][41]
- DMPA оценивается типичное использование интенсивность отказов в первый год = 3% в:
Трасселл не использовал показатели отказов NSFG за 1995 год в качестве типичное использование частота неудач для двух других, тогда еще недавно доступных противозачаточных средств длительного действия, Норплант имплантат (2,3%) и медь ParaGard T 380A ВМС (3,7%), что (как и в случае ДМПА) на порядок выше, чем в клинических исследованиях. Поскольку Norplant и ParaGard не допускают возможности для ошибки пользователя, их гораздо более высокие показатели отказов NSFG в 1995 году были отнесены Трасселом к завышению сведений о контрацептивах во время зачатия, которое привело к живорождению.[40][47][41]
Преимущества
DMPA имеет ряд преимуществ и преимуществ:[48][49][39][50]
- Высокоэффективен для предотвращения беременности.
- Вводится каждые 12 недель. Единственное продолжающееся действие - назначать последующие инъекции каждые двенадцать недель и отслеживать побочные эффекты, чтобы гарантировать, что они не потребуют медицинской помощи.
- Нет эстроген. Нет повышенного риска глубокие венозные тромбы, легочная эмболия, Инсульт, или же инфаркт миокарда.
- Минимальный лекарственные взаимодействия (по сравнению с другими гормональные контрацептивы ).
- Сниженный риск рак эндометрия. ДМПА снижает риск рака эндометрия на 80%.[51][52][53] Считается, что снижение риска рака эндометрия у пользователей DMPA связано как с прямым антипролиферативным действием прогестогена на эндометрий, так и с косвенным снижением уровня эстрогена за счет подавления развития фолликулов яичников.[54]
- Сниженный риск железодефицитная анемия, воспалительные заболевания органов малого таза (ВЗОМТ), внематочная беременность,[55][56] и миома матки.
- Снижение симптомов эндометриоз.
- Снижение заболеваемости первичная дисменорея, овуляционная боль, и функциональные кисты яичников.
- Снижение заболеваемости припадки у женщин с эпилепсия. Кроме того, в отличие от большинства других гормональных контрацептивов, противозачаточная эффективность DMPA не зависит от фермент-индуцирующий противоэпилептические препараты.[57]
- Снижение заболеваемости и тяжести серповидноклеточные кризисы у женщин с серповидно-клеточной анемией.[39]
Министерство здравоохранения Соединенного Королевства активно продвигало Обратимый контрацептив длительного действия пользуюсь с 2008 года, особенно для молодежи;[58] после октября 2005 г. Национальный институт здравоохранения и клинического совершенства руководящие указания.[59] Консультации по этим методам контрацепции были включены в 2009 г. Структура качества и результатов «хорошая практика» для первичной медико-санитарной помощи.[60]
Сравнение
Сторонники биоидентичная гормональная терапия считают, что прогестерон имеет меньше побочных эффектов и улучшает качество жизни по сравнению с MPA.[61] Доказательства этой точки зрения были подвергнуты сомнению; МПА лучше всасывается при приеме внутрь и имеет гораздо более длительный срок действия. период полувыведения приводит к более стабильному уровню в крови[62] хотя это может привести к большей нежности груди и большему спорадическое вагинальное кровотечение.[61] Эти два соединения не различаются по своей способности подавлять гиперплазия эндометрия,[61] и не увеличивает риск легочная эмболия.[63] Эти два препарата не были адекватно сопоставлены в прямых тестах, чтобы сделать четкие выводы о безопасности и превосходстве.[25]
Доступные формы
МПА доступен отдельно в форме 2,5, 5 и 10 мг. устный таблетки, в виде 150 мг / мл (1 мл) или 400 мг / мл (2,5 мл) микрокристаллический водная суспензия за внутримышечная инъекция, и в виде 104 мг (0,65 мл 160 мг / мл) микрокристаллической водной суспензии для подкожная инъекция.[64][65] Он также продается в форме пероральных таблеток по 100, 200, 250, 400 и 500 мг; Пероральные суспензии 500 и 1000 мг; и в виде микрокристаллической водной суспензии 50 мг / мл для внутримышечной инъекции.[66][67] Ранее также была доступна микрокристаллическая водная суспензия для внутримышечной инъекции 100 мг / мл.[64] В дополнение к составам с одним лекарственным средством МПА доступен в форме таблеток для перорального применения в сочетании с конъюгированные эстрогены (ЦВЕ), эстрадиол, и эстрадиола валерат для использования в гормональной терапии менопаузы и доступен в сочетании с эстрадиола ципионат в микрокристаллической водной суспензии в виде комбинированный инъекционный контрацептив.[10][11][64][19]
Depo-Provera - это торговая марка микрокристаллической водной суспензии DMPA 150 мг, которую вводят внутримышечная инъекция. Укол необходимо вводить в бедро, ягодицу или дельтовидную мышцу четыре раза в год (каждые 11–13 недель) и обеспечивает защиту от беременности сразу после первой инъекции.[68] Depo-subQ Provera 104 - это разновидность оригинального DMPA для внутримышечного введения, который представляет собой микрокристаллическую дозу 104 мг в водной суспензии, вводимую подкожно. Он содержит 69% MPA, обнаруженного в исходной композиции DMPA для внутримышечного введения. Его можно вводить с помощью инъекционной иглы меньшего размера, вводя лекарство чуть ниже кожи, а не в мышцу в животе или бедре. Эта подкожная инъекция утверждает, что уменьшает побочные эффекты DMPA, сохраняя при этом все те же преимущества исходного внутримышечного DMPA.
Противопоказания
MPA обычно не рекомендуется из-за неприемлемого риска для здоровья или потому, что он не показан в следующих случаях:[69][70]
Условия, при которых теоретические или доказанные риски обычно перевешивают преимущества использования DMPA:
- Множественные факторы риска артериальный сердечно-сосудистые заболевания
- Текущий глубокие венозные тромбы или же легочная эмболия
- Мигрень с аура при использовании DMPA
- До оценки необъяснимого вагинальное кровотечение подозревается в серьезном заболевании
- История рак молочной железы и никаких доказательств текущего заболевания в течение пяти лет
- Активный болезнь печени: (острый вирусный гепатит, тяжелая декомпенсированная цирроз, доброкачественный или же злокачественный опухоли печени )
- Условия, вызывающие озабоченность дефицит эстрогена и уменьшил HDL уровни, теоретически повышающие сердечно-сосудистый риск:
- Гипертония с сосудистое заболевание
- Текущее и история ишемическая болезнь сердца
- История Инсульт
- Сахарный диабет более 20 лет или с нефропатия /ретинопатия /невропатия или же сосудистое заболевание
Состояния, представляющие неприемлемый риск для здоровья при использовании DMPA:
- Текущий или недавний рак молочной железы (гормонально-чувствительная опухоль)
Условия, при которых использование не указано и не должно начинаться:
MPA не рекомендуется использовать до менархе или до или во время выздоровления от хирургия.[71]
Побочные эффекты
У женщин наиболее часто встречается побочные эффекты МПА - угри, изменения менструального цикла, сонливость и могут вызывать врожденные дефекты при приеме беременными женщинами. Другие общие побочные эффекты включают: болезненность молочных желез, увеличение количества волос на лице, уменьшение количества волос на коже головы, трудности с засыпанием или сном, боли в животе и потеря или увеличение веса.[24] Понижен либидо сообщалось как побочный эффект MPA у женщин.[72] DMPA может повлиять на менструальное кровотечение. После года использования 55% женщин испытывают аменорея (пропущенные месячные); через 2 года ставка повышается до 68%. В первые месяцы использования сообщалось о «нерегулярных или непредсказуемых кровотечениях или кровянистых выделениях, или, в редких случаях, об сильном или непрерывном кровотечении».[73] MPA, похоже, не связан с дефицит витамина B12.[74] Данные о наборе веса с DMPA также противоречивы.[75][76]
В высоких дозах для лечения рака груди MPA может вызвать увеличение веса и ухудшение состояния. сахарный диабет и отек (особенно лица). Пик нежелательных эффектов наступает через пять недель, и они уменьшаются при более низких дозах. Менее частые эффекты могут включать: тромбоз (хотя неясно, действительно ли это риск, его нельзя исключать), болезненное мочеиспускание, Головная боль, тошнота, и рвота. При использовании в качестве формы андрогенная депривационная терапия у мужчин более частые жалобы включают снижение либидо, бессилие, уменьшенный эякулят объем, а в течение трех дней, химическая кастрация. В чрезвычайно высоких дозах (используемых для лечения рака, а не для контрацепции) МПА может вызывать подавление надпочечников и может влиять на метаболизм углеводов, но не вызывает сахарный диабет.[29]
При использовании в качестве инъекционного противозачаточного средства происходит отсроченное возвращение плодородие. В среднем восстановление фертильности происходит через 9-10 месяцев после последней инъекции, а у женщин с избыточным весом или ожирением требуется больше времени. К 18 месяцам после последней инъекции фертильность такая же, как и у бывших пользователей других методов контрацепции.[48][49] Плоды подверженные воздействию прогестагенов продемонстрировали более высокий уровень генитальных аномалий, низкой массы тела при рождении и увеличения внематочная беременность особенно, когда MPA используется в качестве инъекционной формы длительного контроля рождаемости. Исследование случайных беременностей среди бедных женщин в Таиланде показало, что младенцы, которые подверглись воздействию ДМПА во время беременности, имели более высокий риск низкой массы тела при рождении и на 80% больше, чем обычно, шанс умереть в первый год жизни.[77]
Изменения настроения
Были опасения по поводу возможного риска депрессия и настроение изменения с прогестинами, такими как MPA, и это привело к нежеланию некоторых клиницистов и женщин их использовать.[78][79] Однако, вопреки широко распространенному мнению, большинство исследований показывают, что прогестины не вызывают неблагоприятных психологических эффектов, таких как депрессия или беспокойство.[78] Систематический обзор взаимосвязи между прогестиновой контрацепцией и депрессией 2018 года включал три крупных исследования DMPA и не сообщил об отсутствии связи между DMPA и депрессией.[80] Согласно обзору DMPA за 2003 год, большинство опубликованных клинических исследований показывают, что DMPA не связан с депрессией, и общие данные подтверждают мнение о том, что лекарство не оказывает значительного влияния на настроение.[81]
В крупнейшем на сегодняшний день исследовании по оценке взаимосвязи между MPA и депрессией, в котором более 3900 женщин лечились DMPA в течение до 7 лет, частота депрессии была нечастой и составляла 1,5%, а частота прекращения лечения из-за депрессии составляла 0,5%. .[80][38][82] Это исследование не включало исходные данные о депрессии,[82] и из-за случаев депрессии в исследовании FDA требовало маркировки упаковки для DMPA, в которой говорилось, что за женщинами с депрессией следует внимательно наблюдать и что DMPA следует прекратить, если депрессия рецидивирует.[80] Последующее исследование 495 женщин, получавших ДМПА в течение 1 года, показало, что средний балл депрессии немного снизился во всей группе продолжающих употребление наркотиков с 7,4 до 6,7 (на 9,5%) и снизился в квинтиле группы с самым высоким показателем. исходная оценка депрессии от 15,4 до 9,5 (на 38%).[82] Основываясь на результатах этого и других исследований, начал формироваться консенсус, что DMPA на самом деле не увеличивает риск депрессии и не ухудшает тяжесть ранее существовавшей депрессии.[76][82][38]
Аналогично случаю DMPA для гормональной контрацепции, исследование Heart and Estrogen / Progestin Replacement Study (HERS), исследование 2763 женщин в постменопаузе, получавших 0,625 мг / день пероральных КЭЭ плюс 2,5 мг / день перорального MPA или плацебо в течение 36 месяцев в качестве метод менопаузальная гормональная терапия, не обнаружил изменений депрессивных симптомов.[83][84][85] Однако в некоторых небольших исследованиях сообщается, что прогестины, такие как MPA, могут противодействовать положительному воздействию эстрогенов против депрессии.[78][3][86]
Долгосрочные эффекты
В Инициатива женского здоровья исследовали использование комбинации пероральных КЭЭ и МПА по сравнению с плацебо. Исследование было преждевременно прекращено, когда были обнаружены ранее неожиданные риски, в частности, было обнаружено, что, хотя гормональная терапия не повлияла на смертность от всех причин, преимущества менопаузальной гормональной терапии (снижение риска перелом бедра, колоректальный и рак эндометрия и все другие причины смерти) были компенсированы повышенным риском ишемическая болезнь сердца, рак молочной железы, удары и легочная эмболия.[87] Тем не менее, исследование было сосредоточено только на MPA и экстраполировало преимущества по сравнению с рисками на все прогестагены - вывод, который был оспорен несколькими исследователями как необоснованный и приводящий к ненужному отказу от ЗГТ для многих женщин, поскольку прогестагены не похожи.[88]
В сочетании с CEEs MPA был связан с повышенным риском рак молочной железы, слабоумие, и тромб в глаза. В сочетании с эстрогенами в целом МПА может увеличить риск сердечно-сосудистые заболевания, с более сильной ассоциацией при использовании постменопаузальный женщины также принимают CEEs. Именно из-за этих неожиданных взаимодействий Инициатива женского здоровья исследование было закончено досрочно из-за дополнительных рисков менопаузальная гормональная терапия,[89] что привело к резкому сокращению как новых, так и возобновляемых рецептов гормональной терапии.[90]
Долгосрочные исследования пользователей ДМПА выявили незначительное или нулевое повышение общего риска рака груди. Тем не менее, исследуемая популяция действительно показала немного повышенный риск рака груди у недавних пользователей (использование DMPA в последние четыре года) в возрасте до 35 лет, аналогично тому, что наблюдалось при использовании комбинированные оральные противозачаточные таблетки.[73]
| Клинический результат | Гипотетически влияние на риск |
Эстроген и прогестаген (CE 0,625 мг / день перорально + MPA 2,5 мг / день перорально) (n = 16 608, с маткой, период наблюдения 5,2–5,6 лет) |
Эстроген один (CE 0,625 мг / день перорально) (n = 10739, матки нет, наблюдение через 6,8–7,1 лет) |
||||
|---|---|---|---|---|---|---|---|
| HR | 95% CI | AR | HR | 95% CI | AR | ||
| Ишемическая болезнь сердца | Уменьшено | 1.24 | 1.00–1.54 | +6 / 10 000 лет назад | 0.95 | 0.79–1.15 | −3 / 10,000 ПГ |
| Гладить | Уменьшено | 1.31 | 1.02–1.68 | +8 / 10 000 лет назад | 1.37 | 1.09–1.73 | +12 / 10 000 лет назад |
| Легочная эмболия | Повысился | 2.13 | 1.45–3.11 | +10 / 10 000 лет назад | 1.37 | 0.90–2.07 | +4 / 10 000 лет назад |
| Венозная тромбоэмболия | Повысился | 2.06 | 1.57–2.70 | +18 / 10 000 лет назад | 1.32 | 0.99–1.75 | +8 / 10 000 лет назад |
| Рак молочной железы | Повысился | 1.24 | 1.02–1.50 | +8 / 10 000 лет назад | 0.80 | 0.62–1.04 | −6 / 10 000 лет назад |
| Колоректальный рак | Уменьшено | 0.56 | 0.38–0.81 | −7 / 10 000 лет назад | 1.08 | 0.75–1.55 | +1 / 10,000 ПГ |
| Рак эндометрия | – | 0.81 | 0.48–1.36 | -1 / 10,000 лет назад | – | – | – |
| Переломы бедра | Уменьшено | 0.67 | 0.47–0.96 | −5 / 10 000 лет назад | 0.65 | 0.45–0.94 | −7 / 10 000 лет назад |
| Общий переломы | Уменьшено | 0.76 | 0.69–0.83 | −47 / 10 000 лет назад | 0.71 | 0.64–0.80 | −53 / 10,000 лет назад |
| Общий смертность | Уменьшено | 0.98 | 0.82–1.18 | -1 / 10,000 лет назад | 1.04 | 0.91–1.12 | +3 / 10,000 ПГ |
| Глобальный индекс | – | 1.15 | 1.03–1.28 | +19 / 10 000 лет назад | 1.01 | 1.09–1.12 | +2 / 10 000 лет назад |
| Сахарный диабет | – | 0.79 | 0.67–0.93 | 0.88 | 0.77–1.01 | ||
| Заболевание желчного пузыря | Повысился | 1.59 | 1.28–1.97 | 1.67 | 1.35–2.06 | ||
| Стрессовое недержание мочи | – | 1.87 | 1.61–2.18 | 2.15 | 1.77–2.82 | ||
| Настойчивое недержание мочи | – | 1.15 | 0.99–1.34 | 1.32 | 1.10–1.58 | ||
| Заболевание периферических артерий | – | 0.89 | 0.63–1.25 | 1.32 | 0.99–1.77 | ||
| Вероятно слабоумие | Уменьшено | 2.05 | 1.21–3.48 | 1.49 | 0.83–2.66 | ||
| Сокращения: CEs = конъюгированные эстрогены. MPA = медроксипрогестерона ацетат. п.о. знак равно за устный. HR = коэффициент опасности. AR = связанный риск. PYs = человеко-годы. CI = доверительный интервал. Примечания: Размеры выборки (n) включать плацебо реципиенты, которых было около половины больных. «Глобальный индекс» определяется для каждой женщины как время до самой ранней диагностики ишемическая болезнь сердца, Инсульт, легочная эмболия, рак молочной железы, колоректальный рак, рак эндометрия (только группа эстроген плюс прогестаген), переломы бедра, и смерть по другим причинам. Источники: См. Шаблон. | |||||||
Сгустки крови
DMPA был связан в нескольких исследованиях с более высоким риском Венозная тромбоэмболия (ВТЭ) при использовании в качестве средства контроля рождаемости, содержащего только прогестагены, у женщин в пременопаузе.[91][92][93][94] Увеличение частоты ВТЭ составляет от 2,2 до 3,6 раза.[91][92][93][94] Повышенный риск ВТЭ при ДМПА является неожиданным, поскольку ДМПА практически не влияет на коагуляция и фибринолитические факторы,[95][96] и прогестагены сами по себе обычно не увеличивают риск тромбоза.[92][93] Утверждалось, что более высокая заболеваемость ДМПА отражает предпочтительное назначение ДМПА женщинам, которые, как считается, имеют повышенный риск ВТЭ.[92] Альтернативно, возможно, что MPA может быть исключением среди прогестинов с точки зрения риска ВТЭ.[97][98][99] 2018 г. метаанализ сообщили, что MPA был связан с в 2,8 раза более высоким риском ВТЭ, чем другие прогестины.[98] Возможно, что глюкокортикоид активность MPA может увеличить риск ВТЭ.[3][100][99]
Плотность костной ткани
DMPA может вызвать снижение плотность костной ткани у женщин в пременопаузе и у мужчин при применении без эстрогена, особенно в высоких дозах, хотя это, по-видимому, обратимо до нормального уровня даже после многих лет использования.
17 ноября 2004 г. США Управление по контролю за продуктами и лекарствами положить предупреждение о черном ящике на этикетке, что указывает на потенциальные побочные эффекты потери минеральной плотности костей.[101][102] Хотя это вызывает временное потеря костной массы, большинство женщин полностью восстанавливают плотность костей после прекращения приема.[75] В Всемирная организация здоровья (ВОЗ) рекомендует не ограничивать использование.[103][104] Американский колледж акушеров и гинекологов отмечает, что потенциальные неблагоприятные воздействия на МПК должны быть сбалансированы с известными негативными последствиями нежелательной беременности с использованием других методов контроля рождаемости или без них, особенно среди подростков.
Три исследования показали, что потеря костной массы обратима после отмены ДМПА.[105][106][107] Другие исследования показали, что влияние DMPA на плотность костей в постменопаузе минимально.[108] возможно, потому, что пользователи DMPA испытывают меньшую потерю костной массы во время менопаузы.[109] Использование после пика костной массы связано с увеличением метаболизма костной ткани, но без снижения минеральной плотности костной ткани.[110]
FDA рекомендует не использовать DMPA дольше 2 лет, если не существует альтернативного метода контрацепции, из-за опасений по поводу потери костной массы.[102] Тем не менее, Заключение Комитета от 2008 г. Американский конгресс акушеров и гинекологов (ACOG) сообщает медицинским работникам, что опасения по поводу потери минеральной плотности костей не должны препятствовать назначению или продолжению применения DMPA после 2 лет использования.[111]
Риск заражения ВИЧ
Существует неопределенность в отношении риска заражения ВИЧ среди пользователей ПОУД; одни обсервационные исследования предполагают повышенный риск заражения ВИЧ среди женщин, принимающих ДМПА, а другие - нет.[112] В феврале 2012 года и июле 2014 года Всемирная организация здравоохранения опубликовала заявления, в которых говорилось, что данные не оправдывают изменения их рекомендации об отсутствии ограничений - категория 1 медицинского права на противозачаточные средства (MEC) - в отношении использования DMPA у женщин с высоким риском заражения ВИЧ.[113][114] В январе 2015 года были опубликованы два метаанализа наблюдательных исследований в странах Африки к югу от Сахары.[115] Они обнаружили, что риск заражения ВИЧ для пользователей DMPA возрастает в 1,4–1,5 раза по сравнению с отсутствием использования гормональных контрацептивов.[116][117] В январе 2015 года факультет сексуального и репродуктивного здоровья Королевского колледжа акушеров и гинекологов опубликовал заявление, подтверждающее, что нет никаких оснований рекомендовать не использовать DMPA в Соединенном Королевстве даже для женщин из группы «высокого риска» заражения ВИЧ.[118] В систематическом обзоре и метаанализе риска ВИЧ-инфекции у пользователей ПОУД, опубликованном осенью 2015 года, говорится, что «эпидемиологические и биологические данные теперь убедительно свидетельствуют о том, что ПОУД значительно увеличивает риск передачи ВИЧ от мужчины к женщине».[119] В 2019 году рандомизированное контролируемое исследование не выявило значительной связи между использованием DMPA и ВИЧ.[120]
Грудное вскармливание
MPA может использоваться кормление грудью матери. При немедленном применении возможно сильное кровотечение. послеродовой время и лучше всего отложить до шести недель после рождения. Его можно использовать в течение пяти дней, если не кормить грудью. В то время как исследование показало «отсутствие существенной разницы в весе при рождении или частоте врожденных дефектов» и «отсутствие значительного изменения иммунитета к инфекционным заболеваниям, вызванным грудным молоком, содержащим ДМПА», в подгруппе младенцев, матери которых начали применять ДМПА через 2 дня после родов, было 75 на% выше частота обращений к врачу по поводу инфекционных заболеваний в течение первого года жизни.[121]
Более крупное исследование с более длительным периодом наблюдения пришло к выводу, что «использование DMPA во время беременности или грудного вскармливания не оказывает отрицательного воздействия на долгосрочный рост и развитие детей». В этом исследовании также отмечалось, что «дети с воздействием DMPA во время беременности и кормления грудью имели повышенный риск неоптимального роста в росте», но что «после корректировки на социально-экономические факторы с помощью множественной логистической регрессии не было повышенного риска нарушения роста среди DMPA- подвергшихся воздействию детей ". В исследовании также отмечалось, что влияние ДМПА на половое созревание требует дальнейшего изучения, так как наблюдалось очень мало детей старше 10 лет.[122]
Передозировка
MPA изучалась при "массовых" дозировках до 5000 мг в день перорально и 2000 мг в день через внутримышечную инъекцию без серьезных осложнений. переносимость или же безопасность описанные проблемы.[123][124][125] Передозировка не описана в Управление по контролю за продуктами и лекарствами (FDA) этикетки для инъекций MPA (Depo-Provera или Depo-SubQ Provera 104).[6][7] На этикетке продукта FDA для перорального MPA (Provera) указано, что передозировка эстрогена и прогестина может вызвать тошнота и рвота, болезненность молочных желез, головокружение, боль в животе, сонливость, усталость, и кровотечение отмены.[5] Согласно этикетке, лечение передозировки должно состоять из прекращения терапии МПА и оказания симптоматической помощи.[5]
Взаимодействия
MPA увеличивает риск рак молочной железы, слабоумие, и тромб при использовании в сочетании с КВЭ для лечения симптомы менопаузы.[71] При использовании в качестве противозачаточного средства MPA обычно не взаимодействовать с другими лекарствами. Комбинация MPA с аминоглутетимид лечить метастазы от рака груди связано с увеличением депрессия.[29] Зверобой может снизить эффективность МПА как противозачаточного средства из-за ускорения его метаболизм.[71]
Фармакология
Фармакодинамика
MPA действует как агонист из прогестерон, андроген, и рецепторы глюкокортикоидов (PR, AR и GR соответственно),[4] активация этих рецепторов с помощью EC50 значения приблизительно 0,01 нМ, 1 нМ и 10 нМ соответственно.[126] Это незначительно близость для рецептор эстрогена.[4] Лекарство имеет относительно высокое сродство к минералокортикоидный рецептор, но, несмотря на это, у него нет минералокортикоид или же антиминералокортикоид Мероприятия.[3] В внутренняя деятельность MPA в активации PR и AR, по крайней мере, эквивалентны таковым прогестерона и дигидротестостерон (DHT) соответственно, указывая на то, что это полный агонист этих рецепторов.[12][127]
|
|
PR | AR | ER | GR | МИСТЕР |
|---|---|---|---|---|---|
| Прогестерон | 50 | 0 | 0 | 10 | 100 |
| Хлормадинона ацетат | 67 | 5 | 0 | 8 | 0 |
| Ципротерона ацетат | 90 | 6 | 0 | 6 | 8 |
| Медроксипрогестерона ацетат | 115 | 5 | 0 | 29 | 160 |
| Мегестрола ацетат | 65 | 5 | 0 | 30 | 0 |
| Примечания: Значения указаны в процентах (%). Ссылка лиганды (100%) были промегестон для PR, метриболон для AR, эстрадиол для ER, дексаметазон для GR, и альдостерон для МИСТЕР. Источники: [3] | |||||
Прогестагенная активность
MPA - мощный агонист из рецептор прогестерона с похожими близость и эффективность относительно прогестерон.[128] Хотя и МПА, и его деацетилированный аналог медроксипрогестерон связываются с PR и агонируют, MPA примерно в 100 раз выше связывающая аффинность и трансактивация эффективность в сравнении.[128] Таким образом, в отличие от MPA, медроксипрогестерон не используется в клинических условиях, хотя он и используется в некоторых случаях. Ветеринария.[2] Пероральная доза МПА, необходимая для подавления овуляция (т.е. эффективная доза контрацептива) составляет 10 мг / день, тогда как 5 мг / день было недостаточно для подавления овуляции у всех женщин.[129] Соответственно, дозировка MPA, используемая в пероральных контрацептивах в прошлом, составляла 10 мг на таблетку.[130] Для сравнения с MPA дозировка прогестерон для подавления овуляции требуется 300 мг / день, тогда как 19-нортестостерон производные норэтистерон и норэтистерона ацетат составляет всего от 0,4 до 0,5 мг / день.[131]
Механизм действия контрацептивов, содержащих только прогестагены, таких как DMPA, зависит от активности и дозы прогестагена. Высокодозированные контрацептивы, содержащие только прогестагены, такие как ДМПА, подавляют фолликулярное развитие и предотвратить овуляция как их основной механизм действия.[132][133] Прогестаген снижает частоту пульса гонадотропин-рилизинг гормон (GnRH) выпуск от гипоталамус, что снижает выделение фолликулостимулирующего гормона (ФСГ) и лютеинизирующий гормон (LH) передний гипофиз. Снижение уровня ФСГ тормозит развитие фолликулов, предотвращая увеличение эстрадиол уровни. Прогестаген негативный отзыв и отсутствие эстроген положительный отзыв при выпуске ЛГ предотвращает выброс ЛГ. Подавление развития фолликулов и отсутствие выброса ЛГ препятствуют овуляции.[48][49] Вторичным механизмом действия всех прогестагенсодержащих контрацептивов является подавление сперма проникновение изменениями в цервикальная слизь.[134] Подавление функции яичников во время использования ДМПА вызывает эндометрий похудеть и атрофироваться. Теоретически эти изменения в эндометрии могут предотвратить имплантацию. Однако, поскольку ДМПА очень эффективен в подавлении овуляции и проникновения сперматозоидов, возможность оплодотворение незначительно. Нет доступных данных в поддержку предотвращения имплантации как механизма действия ДМПА.[134]
| Сложный | Kя (нМ) | EC50 (нМ)а | EC50 (нМ)б |
|---|---|---|---|
| Прогестерон | 4.3 | 0.9 | 25 |
| Медроксипрогестерон | 241 | 47 | 32 |
| Медроксипрогестерона ацетат | 1.2 | 0.6 | 0.15 |
| Сноски: а = Набор коактиватора. б = Репортерная клеточная линия. Источники: [128] | |||
| Прогестаген | OID (мг / день) |
TFD (мг / цикл) |
TFD (мг / день) |
ODP (мг / день) |
ECD (мг / день) |
|---|---|---|---|---|---|
| Прогестерон | 300 | 4200 | 200–300 | – | 200 |
| Хлормадинона ацетат | 1.7 | 20–30 | 10 | 2.0 | 5–10 |
| Ципротерона ацетат | 1.0 | 20 | 1.0 | 2.0 | 1.0 |
| Медроксипрогестерона ацетат | 10 | 50 | 5–10 | ? | 5.0 |
| Мегестрола ацетат | ? | 50 | ? | ? | 5.0 |
| Сокращения: OID = овуляция - запрещающая дозировка (без дополнительного эстрогена). TFD = трансформация эндометрия дозировка. ODP = пероральная доза в коммерческих противозачаточных препаратах. ECD = расчетная сопоставимая дозировка. Источники: [131][100][135] | |||||
| Сложный | Форма | Доза для конкретного использования (мг)[c] | DOA[d] | |||
|---|---|---|---|---|---|---|
| TFD[e] | POICD[f] | CICD[грамм] | ||||
| Алгестон ацетофенид | Масло солн. | - | – | 75–150 | 14–32 дней | |
| Гестонорон капроат | Масло солн. | 25–50 | – | – | 8–13 дней | |
| Гидроксипрогест. ацетат[час] | Aq. Susp. | 350 | – | – | 9–16 дней | |
| Гидроксипрогест. капроат | Масло солн. | 250–500[я] | – | 250–500 | 5–21 дн. | |
| Medroxyprog. ацетат | Aq. Susp. | 50–100 | 150 | 25 | 14–50 + д | |
| Мегестрола ацетат | Aq. Susp. | - | – | 25 | > 14 дней | |
| Норэтистерона энантат | Масло солн. | 100–200 | 200 | 50 | 11–52 дня | |
| Прогестерон | Масло солн. | 200[я] | – | – | 2–6 дней | |
| Aq. soln. | ? | – | – | 1–2 дня | ||
| Aq. Susp. | 50–200 | – | – | 7–14 дней | ||
|
Примечания и источники:
|
||||||
Антигонадотропный и антикортикотропный эффекты
MPA подавляет гипоталамус-гипофиз-надпочечники (HPA) и гипоталамус-гипофиз-гонад (HPG) топоры при достаточных дозировках, что приводит к снижению уровня гонадотропины, андрогены, эстрогены, адренокортикотропный гормон (АКТГ) и кортизол, а также уровни глобулин, связывающий половые гормоны (ГСПГ).[13] Имеются данные о том, что подавляющие эффекты MPA на оси HPG опосредуются активацией как PR, так и AR в гипофиз.[155][156] Благодаря своему влиянию на уровень андрогенов, MPA может производить сильные функциональные антиандрогенный эффекты, и используется при лечении андроген-зависимые состояния Такие как преждевременное половое созревание у мальчиков и гиперсексуальность у мужчин.[157] Кроме того, поскольку лекарство также снижает уровень эстрогена, МПА может производить сильные функциональные антиэстрогенный эффекты аналогичным образом и использовались для лечения эстроген-зависимые состояния такие как преждевременное половое созревание у девочек и эндометриоз у женщин. Из-за низкого уровня эстрогена использование MPA без эстрогена представляет собой риск снижения минеральная плотность костей и другие симптомы дефицит эстрогена.[158]
Было обнаружено, что пероральный прием МПА снижает уровень тестостерона у мужчин примерно на 30% (с 831 нг / дл до 585 нг / дл) при дозировке 20 мг / день, примерно на 45-75% (в среднем на 60%; до 150–150%). 400 нг / дл) в дозировке 60 мг / день,[159][160][161] и примерно на 70–75% (с 832–862 нг / дл до 214–251 нг / дл) при дозировке 100 мг / день.[162][163] Дозировки перорального МПА от 2,5 до 30 мг / день в сочетании с эстрогенами использовались для снижения уровня тестостерона у трансгендерных женщин.[164][165][166][167][168][169] Очень высокие дозы МПА для внутримышечного введения от 150 до 500 мг в неделю (но до 900 мг в неделю) могут снизить уровень тестостерона до уровня менее 100 нг / дл.[159][170] Типичная начальная доза внутримышечного MPA для подавления тестостерона у мужчин с парафилиями составляет 400 или 500 мг в неделю.[159]
Андрогенная активность
MPA является мощным полным агонистом AR. Его активация AR может играть важную и важную роль в его антигонадотропных эффектах и в его благоприятных эффектах против рак молочной железы.[155][171][172] Однако, хотя MPA может вызывать андрогенные побочные эффекты, такие как: угревая сыпь и гирсутизм у некоторых женщин,[173][174] это случается редко, и когда возникают такие симптомы, они, как правило, легкие, независимо от применяемой дозировки.[155] Фактически, вероятно, из-за его подавляющего действия на уровни андрогенов, было сообщено, что MPA, как правило, очень эффективен в улучшении уже существующих симптомов гирсутизма у женщин с этим заболеванием.[175][176] Более того, МПА редко вызывает какие-либо андрогенные эффекты у детей с преждевременным половым созреванием, даже в очень высоких дозах.[177] Причина общего отсутствия вирилизирующий эффекты с MPA, несмотря на то, что он связывается и активирует AR с высоким сродством, и это действие потенциально играет важную роль во многих его физиологических и терапевтических эффектах, не совсем ясно. Однако было обнаружено, что MPA взаимодействует с AR иначе, чем другие агонисты рецептора, такие как дигидротестостерон (DHT).[12] Результатом этой разницы, по-видимому, является то, что MPA связывается с AR с аналогичным сродством и внутренней активностью, что и DHT, но требует примерно в 100 раз более высоких концентраций для сопоставимой индукции транскрипция гена, в то же время не противодействуя транскрипционной активности нормальных андрогенов, таких как DHT, в любой концентрации.[12] Таким образом, это может объяснить низкую склонность МПА вызывать андрогенные побочные эффекты.[12]
МПА проявляет слабое андрогенное действие на синтез белка в печени, как и другие слабо андрогенные прогестины, такие как мегестрола ацетат и 19-нортестостерон производные.[3][8] Хотя он не противодействует вызванному эстрогеном повышению уровня триглицериды и Холестерин HDL, DMPA каждые две недели может снизить уровень холестерина ЛПВП.[3] Кроме того, было обнаружено, что MPA подавляет глобулин, связывающий половые гормоны (ГСПГ) производства печень.[8][178][179] Было обнаружено, что при дозировке 10 мг / день МПА перорально, уровень циркулирующего ГСПГ снижается на 14-18% у женщин, принимающих 4 мг / день перорально. эстрадиола валерат.[8] Напротив, в исследовании, в котором комбинировали 2,5 мг / день перорального MPA с различными пероральными эстрогенами, не было обнаружено влияния MPA на вызванное эстрогеном повышение уровней SHBG.[179] В другом исследовании с более высокими дозами уровни SHBG были ниже на 59% в группе женщин, получавших только пероральный MPA в дозе 50 мг / день, по сравнению с контрольной группой женщин, не получавших лечения.[178] В исследовании массивных доз перорального МПА (1000 мг / день) препарат снизил уровень ГСПГ примерно на 80%.[180][181]
В отличие от родственных стероидов мегестрола ацетат и ципротерона ацетат, MPA не антагонист АР и не имеет прямого антиандрогенный Мероприятия.[3] Таким образом, хотя MPA иногда описывается как антиандроген, это не «настоящий» антиандроген (т.е. антагонист AR).[160]
Глюкокортикоидная активность
Как агонист GR, MPA имеет глюкокортикоид активности, и в результате может вызвать симптомы синдром Кушинга,[182] стероидный диабет, и надпочечниковая недостаточность в достаточно высоких дозах.[183] Было высказано предположение, что глюкокортикоидная активность MPA может способствовать потере костной массы.[184] Глюкокортикоидная активность МПА также может приводить к усиление регулирования из рецептор тромбина в кровеносный сосуд стены, которые могут способствовать прокоагулянт эффекты MPA и риск Венозная тромбоэмболия и атеросклероз.[3] Относительная глюкокортикоидная активность MPA является одной из самых высоких среди клинически используемых прогестинов.[3]
| Стероидный препарат | Учебный класс | TR (↑ )а | GR (%)б |
|---|---|---|---|
| Дексаметазон | Кортикостероид | ++ | 100 |
| Этинилэстрадиол | Эстроген | – | 0 |
| Этоногестрел | Прогестин | + | 14 |
| Гестоден | Прогестин | + | 27 |
| Левоноргестрел | Прогестин | – | 1 |
| Медроксипрогестерона ацетат | Прогестин | + | 29 |
| Норэтистерон | Прогестин | – | 0 |
| Norgestimate | Прогестин | – | 1 |
| Прогестерон | Прогестаген | + | 10 |
| Сноски: а = Рецептор тромбина (TR) усиление регулирования (↑) в гладкомышечные клетки сосудов (VSMC). б = РБА (%) для рецептор глюкокортикоидов (GR). Сила: - = Нет эффекта. + = Ярко выраженный эффект. ++ = Сильный эффект. Источники: [3] | |||
Подавление стероидогенеза
Было обнаружено, что MPA действует как конкурентный ингибитор крысы 3α-гидроксистероид дегидрогеназа (3α-HSD).[185][186][187][188] Этот фермент имеет важное значение для трансформация из прогестерон, дезоксикортикостерон, и DHT в ингибиторы нейростероиды Такие как аллопрегнанолон, THDOC, и 3α-андростандиол, соответственно.[189] MPA был описан как очень мощный ингибитор 3α-HSD крысы с IC50 0,2 мкМ и Kя (у крысы яичко гомогенаты ) 0,42 мкМ.[185][186] Однако ингибирование 3α-HSD с помощью MPA, по-видимому, еще не было подтверждено с использованием белков человека, а концентрации, требуемые для белков крыс, намного превышают типичные терапевтические концентрации для человека.[185][186]
MPA был идентифицирован как конкурентный ингибитор человеческого 3β-гидроксистероид дегидрогеназа / Δ5-4 изомераза II (3β-HSD II).[190] Этот фермент необходим для биосинтез из половые стероиды и кортикостероиды.[190] Kя MPA для ингибирования 3β-HSD II составляет 3,0 мкМ, и эта концентрация, как сообщается, близка к циркулирующим уровням лекарства, которые достигаются очень высокими терапевтическими дозами MPA от 5 до 20 мг / кг / день (дозировки от 300 до 1200 мг / день для человека 60 кг (132 фунта)).[190] Помимо 3β-HSD II, другие люди стероидогенный ферменты, в том числе фермент расщепления боковой цепи холестерина (P450scc / CYP11A1) и 17α-гидроксилаза / 17,20-лиаза (CYP17A1), не ингибируется MPA.[190] Было обнаружено, что МПА эффективен при лечении гонадотропин-независимое преждевременное половое созревание И в рак молочной железы в постменопаузальный женщины в высоких дозах, и ингибирование 3β-HSD II может быть ответственно за его эффективность в этих условиях.[190]
ГАМКА рецепторная аллостерическая модуляция
Прогестерон, через преобразование в нейростероиды Такие как 5α-дигидропрогестерон, 5β-дигидропрогестерон, аллопрегнанолон, и прегнанолон (катализируется ферментами 5α- и 5β-редуктаза и 3α- и 3β-HSD), является положительный аллостерический модулятор из ГАМКА рецептор, и связан с различными эффектами, опосредованными этим свойством, включая головокружение, седация, гипнотический состояния, изменения настроения, анксиолиз, и когнитивные нарушения / ухудшение памяти, а также эффективность как противосудорожное средство в лечении менструальная эпилепсия.[189][191] Также было обнаружено, что он производит анестезия благодаря этому действию на животных при введении в достаточно высоких дозировках.[191] Было обнаружено, что MPA значительно снижает захват заболеваемость при добавлении к существующим схемам противосудорожной терапии у 11 из 14 женщин с неконтролируемым эпилепсия, а также, как сообщалось, вызывает анестезию у животных, повышая вероятность того, что он может модулировать ГАМКА рецептор аналогично прогестерону.[192][193]
MPA разделяет одни и те же метаболические пути прогестерона и, аналогично, может превращаться в метаболиты, такие как 5α-дигидро-MPA (DHMPA) и 3α, 5α-тетрагидро-MPA (THMPA).[192] Однако, в отличие от восстановленных метаболитов прогестерона, DHMPA и THMPA не модулируют ГАМК.А рецептор.[192] И наоборот, в отличие от прогестерона, сам MPA фактически модулирует ГАМК.А рецептор, хотя заметно не на сайте связывания нейростероидов.[192] Однако вместо того, чтобы действовать как потенциатор рецептора, MPA, по-видимому, действует как отрицательный аллостерический модулятор.[192] В то время как сниженные метаболиты прогестерона усиливают связывание бензодиазепин флунитразепам в ГАМКА рецептор in vitro, MPA может частично ингибировать связывание флунитразепама до 40% с полумаксимальным ингибированием при 1 мкМ.[192] Однако концентрации MPA, необходимые для ингибирования, высоки по сравнению с терапевтическими концентрациями, и, следовательно, это действие, вероятно, не имеет клинического значения или не имеет никакого значения.[192] Отсутствие потенцирования ГАМКА рецептор MPA или его метаболитов является неожиданным, учитывая очевидные противосудорожные и анестезирующие эффекты MPA, описанные выше, и они остаются необъясненными.[192]
Клинические исследования с использованием массивных доз до 5000 мг / день перорального MPA и 2000 мг / день внутримышечного MPA в течение 30 дней у женщин с распространенным раком молочной железы сообщили об «отсутствии значимых побочных эффектов», что позволяет предположить, что MPA не оказывает значимого прямого действия на ГАМКА рецептор у человека даже при чрезвычайно высоких дозировках.[123]
Стимуляция аппетита
Хотя МПА и родственные ему лекарства мегестрола ацетат эффективны стимуляторы аппетита в очень высоких дозировках,[194] в механизм действия их благотворного воздействия на аппетит не совсем понятно. Тем не мение, глюкокортикоид, цитокин, и возможно анаболический Предполагается, что все связанные механизмы могут быть задействованы, и был вовлечен ряд последующих изменений, включая стимуляцию высвобождения нейропептид Y в гипоталамус, модуляция кальциевые каналы в вентромедиальный гипоталамус, и ингибирование секреции провоспалительные цитокины включая ИЛ-1α, ИЛ-1β, Ил-6, и TNF-α, действия, которые все были связаны с увеличением аппетита.[195]
Другая деятельность
МПА слабо стимулирует распространение из MCF-7 рак молочной железы клетки in vitro, действие, которое не зависит от классических PR и вместо этого опосредуется через компонент мембраны рецептора прогестерона-1 (PGRMC1).[196] Некоторые другие прогестины также активны в этом анализе, тогда как прогестерон действует нейтрально.[196] Неясно, могут ли эти результаты объяснить различные риски рака груди, наблюдаемые при приеме прогестерона. дидрогестерон, и другие прогестины, такие как ацетат медроксипрогестерона и норэтистерон в клинические исследования.[197]
Фармакокинетика
Абсорбция
На удивление мало исследований было проведено фармакокинетика МПА при дозировках замещения в постменопаузе.[198][3] В биодоступность МПА с пероральное введение составляет примерно 100%.[3] Было обнаружено, что однократная пероральная доза 10 мг MPA приводит к пиковым уровням MPA от 1,2 до 5,2 нг / мл в течение 2 часов после приема с использованием радиоиммуноанализ.[198][199] После этого уровни МПА снизились до 0,09-0,35 нг / мл через 12 часов после введения.[198][199] В другом исследовании пиковые уровни MPA составляли от 3,4 до 4,4 нг / мл в течение 1-4 часов после перорального приема 10 мг MPA с использованием радиоиммуноанализа.[198][200] Впоследствии уровни MPA упали до 0,3–0,6 нг / мл через 24 часа после приема.[198][200] В третьем исследовании уровни MPA составляли от 4,2 до 4,4 нг / мл после пероральной дозы 5 мг MPA и 6,0 нг / мл после пероральной дозы 10 мг MPA, в обоих случаях также использовался радиоиммуноанализ.[198][201]
Было обнаружено, что лечение женщин в постменопаузе 2,5 или 5 мг / день МПА в сочетании с эстрадиола валератом в течение двух недель быстро увеличивает уровни циркулирующего МПА, с устойчивое состояние концентрации достигаются через 3 дня, а пиковые концентрации происходят через 1,5–2 часа после приема внутрь.[3][202] При 2,5 мг / день МПА уровни препарата составляли 0,3 нг / мл (0,8 нмоль / л) у женщин в возрасте до 60 лет и 0,45 нг / мл (1,2 нмоль / л) у женщин в возрасте 65 лет и старше, и при 5 мг / день МПА уровни составляли 0,6 нг / мл (1,6 нмоль / л) у женщин в возрасте до 60 лет и у женщин в возрасте 65 лет и старше.[3][202] Следовательно, площадь под кривой уровни лекарства были в 1,6–1,8 раза выше у людей в возрасте 65 лет и старше по сравнению с теми, кто был в возрасте 60 лет и моложе.[8][202] Таким образом, было обнаружено, что уровни MPA меняются с возрастом, и MPA может иметь повышенный риск побочных эффектов у пожилых женщин в постменопаузе.[8][3][202] В этом исследовании оценивались уровни MPA с использованием жидкостная хроматография – тандемная масс-спектрометрия (ЖХ – МС / МС), более точный метод определения крови.[202]
Таблетки МПА перорально можно вводить сублингвально вместо устного.[203][204][205] Ректальное введение MPA также был изучен.[206]
С внутримышечное введение 150 мг микрокристаллический MPA в водная суспензия, лекарство обнаруживается в кровотоке в течение 30 минут, сывороточные концентрации варьируются, но обычно плато составляет 1,0 нг / мл (2,6 нмоль / л) в течение 3 месяцев.[207] После этого происходит постепенное снижение уровней МПА, и лекарство может быть обнаружено в кровотоке в течение 6-9 месяцев после инъекции.[207] В размер частицы кристаллов MPA существенно влияет на скорость его всасывания в организм из местных тканей депо при внутримышечном введении в виде микрокристаллической водной суспензии.[145][208][209] Кристаллы меньшего размера растворяются быстрее и быстрее абсорбируются, что приводит к более короткой продолжительности действия.[145][208][209] Размеры частиц могут различаться в разных формах MPA, что может влиять на клиническую эффективность и переносимость.[145][208][209][210]
Распределение
В связывание с белками плазмы МПа составляет 88%.[3][8] Он слабо связан с альбумин и не связан глобулин, связывающий половые гормоны или же кортикостероид-связывающий глобулин.[3][8]
Метаболизм
В период полувыведения приема МПА при пероральном приеме от 11,6 до 16,6 часов[5] и 33 часа,[3] тогда как период полувыведения с внутримышечный и подкожная инъекция микрокристаллического МПА в водной суспензии составляют 50 и 40 суток соответственно.[6][7] В метаболизм MPA в основном через гидроксилирование, включая положения C6β, C21, C2β и C1β, опосредованные главным образом через CYP3A4, но 3- и 5-дигидро- и 3,5-тетрагидро метаболиты МПА также формируются.[3][8] Деацетилирование MPA и его метаболитов (например, в медроксипрогестерон ) также в значительной степени наблюдалось в исследованиях на приматах (от 30 до 70%).[211] МПА и / или его метаболиты также метаболизируются через спряжение.[71] C6α метил и C17α ацетокси группы MPA делают его более устойчивым к метаболизму и обеспечивают большую биодоступность, чем пероральный прогестерон.[8]
Устранение
MPA - это устранен От 20 до 50% в моча и от 5 до 10% в кал следующий внутривенное введение.[212] Менее 3% дозы составляет выделенный в неконъюгированный форма.[212]
Отношения уровень – эффект
При внутримышечном введении высокие уровни МПА в крови подавляют лютеинизирующий гормон и овуляция в течение нескольких месяцев с сопутствующим снижением уровня прогестерона в сыворотке ниже 0,4 нг / мл.[207] Овуляция возобновляется, когда уровень МПА в крови падает ниже 0,1 нг / мл.[207] Уровень эстрадиола в сыворотке крови остается примерно 50 пг / мл в течение примерно четырех месяцев после инъекции (с диапазоном 10–92 пг / мл после нескольких лет использования), повышаясь, когда уровни MPA упадут ниже 0,5 нг / мл.[207]
Приливы редки, в то время как МПА обнаруживается на значительном уровне в крови в организме, а вагинальный оболочка остается влажным и помятым. В эндометрий подвергается атрофия, с маленькими прямыми железами и строма то есть децидуализированный. Цервикальная слизь останки вязкий. Благодаря стабильному уровню в крови в течение длительного времени и множественным эффектам, предотвращающим оплодотворение, MPA - очень эффективное средство контроль рождаемости.[207]
Кривые время – концентрация
- Уровни гормонов с ацетатом медроксипрогестерона
-

Уровни MPA с 2,5 или 5 мг / день устный МПА в сочетании с 1 или 2 мг / сут. эстрадиола валерат (Индивина ) у женщин в постменопаузе.[213]
-

Уровни МПА после однократного приема 150 мг внутримышечная инъекция МПА (Депо-Провера) в водная суспензия у женщин.[147][214]
-
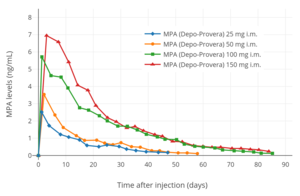
Уровни МПА после однократного приема от 25 до 150 мг внутримышечная инъекция МПА (Депо-Провера) в водная суспензия у женщин.[147][215]
-
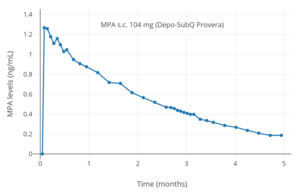
Уровни МПА после однократного приема 104 мг подкожная инъекция MPA (Depo-SubQ Provera) в водная суспензия у женщин.[7]
Химия
MPA - это синтетический прегнане стероидный препарат и производная из прогестерон и 17α-гидроксипрогестерон.[216][2] В частности, это 17α-ацетат сложный эфир из медроксипрогестерон или 6α-метилированный аналог из гидроксипрогестерона ацетат.[216][2] MPA химически известен как 6α-метил-17α-ацетоксипрогестерон или 6α-метил-17α-ацетоксипрегн-4-ен-3,20-дион, а его общее название - сокращение от ацетата 6α-метил-17α-гидроксипрогестерона.[216][2] MPA тесно связан с другими производными 17α-гидроксипрогестерона, такими как хлормадинона ацетат, ципротерона ацетат, и мегестрола ацетат, а также медрогестон и номегестрола ацетат.[216][2] 9α-фтормедроксипрогестерона ацетат (FMPA), C9α фтор аналог МПА и ингибитор ангиогенеза с на два порядка большей эффективностью по сравнению с MPA, было исследовано возможное лечение раки но никогда не продавался.[217][218]
История
МРА был независимо открыт в 1956 г. Syntex и Компания Upjohn.[14][15][219][220] Впервые он был представлен 18 июня 1959 г. компанией Upjohn в Соединенные Штаты под торговой маркой Provera (таблетки 2,5, 5 и 10 мг) для лечения аменорея, метроррагия, и повторный выкидыш.[221][222] Внутримышечная форма MPA, теперь известная как DMPA (400 мг / мл MPA), также была представлена под торговой маркой Depo-Provera в 1960 году в США для лечения эндометрий и рак почек.[28] MPA в сочетании с этинилэстрадиол был представлен в 1964 году компанией Upjohn в США под торговой маркой Provest (таблетки 10 мг MPA и 50 мкг этинилэстрадиола) в качестве оральный контрацептив, но эта формулировка была прекращена в 1970 году.[223][224][130] Этот состав продавался Upjohn за пределами США под торговыми марками Provestral и Provestrol, а Cyclo-Farlutal (или Ciclofarlutal) и Nogest-S[225] были препараты, доступные за пределами США, с другой дозировкой (5 мг MPA и таблетки этинилэстрадиола 50 или 75 мкг).[226][227]
После разработки в конце 1950-х годов DMPA впервые был оценен в клинических испытаниях на предмет использования в качестве инъекционного контрацептива в 1963 году.[228] Апджон искал FDA одобрение внутримышечного DMPA в качестве контрацептива длительного действия под торговой маркой Depo-Provera (150 мг / мл MPA) в 1967 году, но заявка была отклонена.[229][230] Однако этот состав впервые был успешно внедрен в странах за пределами Соединенных Штатов в 1969 году, а к 1992 году был доступен более чем в 90 странах мира.[36] Апджон снова пытался получить одобрение FDA на использование DMPA в качестве противозачаточного средства в 1978 году и еще раз в 1983 году, но оба приложения потерпели неудачу, как и заявка 1967 года.[229][230] Однако в 1992 году это лекарство было окончательно одобрено FDA под торговой маркой Depo-Provera для использования в противозачаточных целях.[229] Подкожный состав DMPA был представлен в США в качестве противозачаточного средства под торговой маркой Depo-SubQ Provera 104 (104 мг / 0,65 мл MPA) в декабре 2004 года и впоследствии был одобрен для лечения эндометриоз связанная с болью в области таза.[231]
MPA также широко продается во всем мире под множеством других торговых марок, таких как Farlutal, Perlutex и Gestapuran, среди прочих.[2][10]
Общество и культура
Родовые имена
Медроксипрогестерона ацетат это родовое имя препарата и его ГОСТИНИЦА, USAN, БАН, и ЯНВАРЬ, пока медроссипрогестерон это DCIT и медроксипрогестерон в DCF формы свободного алкоголя.[216][11][2][232][10] Он также известен как 6α-метил-17α-ацетоксипрогестерон (КАРТА) или же 6α-метил-17α-гидроксипрогестерона ацетат.[216][11][2][10]
Фирменные наименования
MPA продается под большим количеством торговых марок по всему миру.[10][11][2] Его самые основные торговые марки - это Provera в виде таблеток для приема внутрь и Depo-Provera в качестве лекарственного средства. водная суспензия для внутримышечного введения.[10][11][2] Состав MPA в виде водной суспензии для подкожной инъекции также доступен в Соединенные Штаты под торговой маркой Depo-SubQ Provera 104.[10][11] Другие торговые марки MPA, сформулированные отдельно, включают Фарлутал и Саяна для клинического использования и Депо-Промон, Перлутекс, Промон-Е и Верамикс для ветеринарного использования.[10][11][2] В дополнение к составам с одним лекарственным средством, MPA продается в комбинации с эстрогенами CEE, эстрадиолом и эстрадиолвалератом.[10][11][2] Торговые марки MPA в сочетании с CEE в качестве пероральных таблеток в разных странах включают Prempro, Premphase, Premique, Premia и Premelle.[10][11][2] Торговые марки МПА в сочетании с эстрадиолом в виде таблеток для приема внутрь включают Индивина и Тридестра.[10][11][2]
Доступность
Оральный MPA и DMPA широко доступны во всем мире.[10] Пероральный MPA доступен как отдельно, так и в комбинации с эстрогенами CEE, эстрадиолом и эстрадиолвалератом.[10] DMPA зарегистрирован для использования в качестве средства контроля над рождаемостью более чем в 100 странах мира.[19][20][10] Комбинация вводимого МПА и ципионата эстрадиола одобрена для использования в качестве средства контроля рождаемости в 18 странах.[19]
Соединенные Штаты
По состоянию на ноябрь 2016 г.[Обновить], MPA доступен в Соединенные Штаты в следующих составах:[64]
- Таблетки для приема внутрь: Аминь, Курретаб, Цикрин, Провера - 2,5 мг, 5 мг, 10 мг.
- Водная суспензия для внутримышечного введения: Депо-Провера - 150 мг / мл (для контрацепции), 400 мг / мл (для рака).
- Водная суспензия для подкожного введения: Depo-SubQ Provera 104-104 мг / 0,65 мл (для контрацепции)
Он также доступен в сочетании с эстрогеном в следующих составах:
- Таблетки для приема внутрь: CEEs и MPA (Prempro, Prempro (Premarin, Cycrin), Premphase (Premarin, Cycrin 14/14), Premphase 14/14, Prempro / Premphase) - 0,3 мг / 1,5 мг; 0,45 мг / 1,5 мг; 0,625 мг / 2,5 мг; 0,625 мг / 5 мг
В то время как следующие составы были прекращены:
- Таблетки для приема внутрь: этинилэстрадиол и МПА (Провест) - 50 мкг / 10 мг.
- Водная суспензия для внутримышечного введения: ципионат эстрадиола и МПА (Люнель) - 5 мг / 25 мг (для контрацепции)
Штат Луизиана разрешения сексуальные преступники получить MPA.[233]
Поколение
Прогестины в противозачаточных таблетках иногда группируются по поколениям.[234][235] В то время как 19-нортестостерон прогестины последовательно сгруппированы по поколениям, прегнане прогестины, которые используются или использовались в противозачаточных таблетках, обычно не включаются в такую классификацию или сгруппированы просто как «разные» или «прегнаны».[234][235] В любом случае, исходя из даты его введения в такие препараты в 1964 году, MPA можно было рассматривать как прогестин «первого поколения».[236]
Полемика
За пределами США
- В 1994 году, когда DMPA был одобрен в Индии, Экономический и политический еженедельник сообщил, что «FDA наконец лицензировало препарат в 1990 году в ответ на опасения по поводу демографического взрыва в третьем мире и нежелания правительств третьего мира лицензировать препарат, не лицензированный в стране происхождения». [237] Некоторые ученые и женские группы в Индии продолжают выступать против DMPA.[238] В 2016 году Индия ввела в систему общественного здравоохранения внутримышечный препарат DMPA-депо-медроксипрогестерон.[239]
- Канадская коалиция по Depo-Provera, коалиция профессиональных женских медицинских и пропагандистских групп, выступила против утверждения DMPA в Канаде.[240] С момента утверждения DMPA в Канаде в 1997 г. коллективный иск был подан против Pfizer пользователями DMPA, которые разработали остеопороз. В ответ Pfizer заявила, что выполнила свое обязательство по раскрытию и обсуждению рисков DMPA с канадским медицинским сообществом.[241]
- Клинические испытания этого препарата у женщин в Зимбабве вызывали споры в отношении нарушений прав человека и Медицинские эксперименты в Африке.
- Споры разгорелись в Израиль когда правительство обвинили в предоставлении DMPA эфиопским иммигрантам без их согласия. Некоторые женщины утверждали, что им сказали, что это вакцина. Правительство Израиля отвергло обвинения, но дало указание четырем организациям по поддержанию здоровья прекратить делать инъекции DMPA женщинам, «если есть малейшие сомнения в том, что они не поняли последствий лечения».[242]
Соединенные Штаты
Утверждение DMPA в США было долгой и противоречивой. Управление по контролю за продуктами и лекарствами. Оригинальный производитель, Upjohn, неоднократно подавал заявку на одобрение. Консультативные комитеты FDA единогласно рекомендовали одобрение в 1973, 1975 и 1992 годах, как и профессиональный медицинский персонал FDA, но FDA неоднократно отказывало в одобрении. В конечном итоге 29 октября 1992 года FDA одобрило DMPA для контроля рождаемости, который к тому времени использовался более 30 миллионами женщин с 1969 года и был одобрен и использовался почти 9 миллионами женщин в более чем 90 странах, включая объединенное Королевство, Франция, Германия, Швеция, Таиланд, Новая Зеландия и Индонезия.[243] В число спорных моментов вошли:
- Испытания на животных для канцерогенность - DMPA вызывал у собак опухоли рака груди. Критики исследования утверждали, что собаки более чувствительны к искусственному прогестерону и что дозы были слишком высокими, чтобы их можно было экстраполировать на людей. FDA указало, что все вещества, канцерогенные для человека, также канцерогены для животных, и что, если вещество не является канцерогенным, оно не регистрируется как канцероген в высоких дозах. Уровни ДМПА, вызвавшего злокачественные опухоли молочной железы у собак, были в 25 раз больше нормального лютеиновой фазы уровень прогестерона для собак. Это ниже, чем у собак, уровень прогестерона при беременности и зависит от вида.[244]
DMPA вызывал рак эндометрия у обезьян - 2 из 12 протестированных обезьян, это первые зарегистрированные случаи рака эндометрия в макаки резус.[245] Однако последующие исследования показали, что у людей DMPA уменьшает риск рака эндометрия примерно на 80%.[51][52][53]
Говоря о сравнительных исследованиях канцерогенности лекарств на животных, член Бюро по лекарствам FDA дал показания на слушании агентства DMPA: «... данные о животных для этого препарата вызывают большее беспокойство, чем для любого другого известного нам препарата. дано хорошо людям ". - Рак шейки матки в исследованиях Upjohn / NCI. Было обнаружено, что рак шейки матки увеличился в 9 раз в первых исследованиях на людях, зарегистрированных производителем и Национальный институт рака.[246] Однако многочисленные более крупные последующие исследования показали, что использование DMPA не увеличивает риск рака шейки матки.[247][248][249][250][251]
- Принуждение и отсутствие информированного согласия. Тестирование или использование DMPA было сосредоточено почти исключительно на женщинах в развивающиеся страны и бедные женщины в Соединенных Штатах,[252] поднимая серьезные вопросы о принуждении и отсутствии информированного согласия, особенно для неграмотных[253] и для умственно отсталых, которым в некоторых случаях, о которых сообщалось, давали ДМПА длительное время по причинам «гигиены менструального цикла», хотя они не были сексуально активными.[254]
- Исследование в Атланте / Грейди - Апджон изучал влияние DMPA в течение 11 лет в Атланте, в основном на чернокожих женщин, получавших государственную помощь, но не представил никаких необходимых отчетов о последующих действиях в FDA. Прибывшие в конце концов исследователи отметили, что исследования были дезорганизованы. Они обнаружили, что сбор данных был сомнительным, формы согласия и протокол отсутствовали; тем женщинам, чье согласие вообще было получено, не сообщали о возможных побочных эффектах. Женщинам, чьи известные медицинские условия указывали, что использование DMPA может поставить под угрозу их здоровье, давали Несколько женщин, участвовавших в исследовании, умерли; некоторые от рака, а некоторые по другим причинам, например, совершили самоубийство из-за депрессии. Более половины из 13 000 женщин, участвовавших в исследовании, были проиграл для продолжения из-за небрежного ведения учета ». Следовательно, данные этого исследования не были пригодны для использования.[252]
- Обзор ВОЗ - В 1992 г. ВОЗ представила FDA обзор ПОУД в четырех развивающихся странах. В Национальная сеть женского здоровья и другие женские организации засвидетельствовали на слушаниях, что ВОЗ необъективна, поскольку ВОЗ уже распространила ПОУД в развивающихся странах. DMPA был одобрен для использования в Соединенных Штатах на основе обзора ВОЗ ранее представленных данных из таких стран, как Таиланд, доказательств, которые FDA сочло недостаточными и слишком плохо разработанными для оценки риска рака на предварительном слушании.
- Институт Алана Гутмахера предположил, что одобрение США DMPA может повысить его доступность и приемлемость в развивающихся странах.[252][255]
- В 1995 году несколько женских групп здоровья обратились в FDA с просьбой наложить мораторий на DMPA и ввести стандартизированные формы информированного согласия.[256]
Исследование
DMPA был изучен Upjohn для использования в качестве инъекционные контрацептивы, содержащие только прогестагены у женщин в дозе 50 мг один раз в месяц, но плохо контролировал цикл и не продавался для этого применения в этой дозировке.[257] Комбинация DMPA и фосфат полиэстрадиола, эстроген и длительный пролекарство из эстрадиол, изучалась у женщин как комбинированный инъекционный контрацептив для использования внутримышечная инъекция раз в три месяца.[258][259][260]
Высокие дозы пероральной и внутримышечной монотерапии МПА изучались при лечении рака простаты, но оказалось, что она уступает монотерапии с помощью ципротерона ацетат или же диэтилстильбестрол.[261][262][263] Высокие дозы перорального МПА изучались в сочетании с диэтилстильбестролом и КЭЭ в качестве дополнения к высокие дозы эстрогена терапия для лечения рак простаты у мужчин, но не было обнаружено, что он обеспечивает лучшую эффективность, чем один диэтилстильбестрол.[264]
DMPA был изучен для использования в качестве потенциального мужской гормональный контрацептив в сочетании с андрогены /анаболические стероиды тестостерон и нандролон (19-нортестостерон) у мужчин.[265] Однако он никогда не был одобрен для этого показания.[265]
MPA был исследован InKine Pharmaceutical, Salix Pharmaceuticals и Пенсильванский университет как потенциальный противовоспалительное средство лекарства для лечения аутоиммунная гемолитическая анемия, болезнь Крона, идиопатическая тромбоцитопеническая пурпура, и язвенный колит, но не завершила клиническую разработку и никогда не была одобрена по этим показаниям.[266][267] Он был разработан как пероральный препарат в очень высоких дозах, и считалось, что он ингибирует передачу сигналов провоспалительные цитокины Такие как интерлейкин 6 и фактор некроза опухоли альфа, с механизм действия это, как говорили, было похоже на кортикостероиды.[266][267] Для этих показаний препарат MPA имел предварительные торговые марки Colirest и Hematrol.[266]
Было обнаружено, что МПА эффективен при лечении маниакальный симптомы у женщин с биполярное расстройство.[268]
Ветеринарное использование
MPA был использован для уменьшения агрессия и распыление у котов-самцов.[269] Это может быть особенно полезно для контроля такого поведения в стерилизованный коты-мужчины.[269] Лекарство можно вводить кошкам в виде инъекции один раз в месяц.[269]
Смотрите также
- Конъюгированные эстрогены / медроксипрогестерона ацетат
- Эстрадиол / медроксипрогестерона ацетат
- Эстрадиола ципионат / медроксипрогестерона ацетат
- Полиэстрадиолфосфат / медроксипрогестерона ацетат
Примечания
Рекомендации
- ^ https://www.drugs.com/medroxyprogesterone.html
- ^ а б c d е ж грамм час я j k л м п о Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. Январь 2000. С. 638–. ISBN 978-3-88763-075-1. В архиве из оригинала 19.06.2013.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ а б c d Шиндлер А.Е., Кампаньоли С., Друкманн Р., Хубер Дж., Паскуалини Дж. Р., Швеппе К. В., Тийссен Дж. Х. (2008). «Классификация и фармакология прогестинов». Maturitas. 61 (1–2): 171–80. Дои:10.1016 / j.maturitas.2008.11.013. PMID 19434889.
- ^ а б c d е ж "Провера" (PDF). FDA. 2015. Архивировано с оригинал (PDF) 11 февраля 2017 г.. Получено 31 марта 2018.
- ^ а б c «Депо_Провера» (PDF). FDA. 2016. Получено 31 марта 2018.
- ^ а б c d "depo-subQ Provera" (PDF). FDA. 2017. Получено 31 марта 2018.
- ^ а б c d е ж грамм час я j Станчик Ф.З., Бхавнани Б.Р. (сентябрь 2015 г.). «Перепечатка» Применение медроксипрогестерона ацетата для гормональной терапии у женщин в постменопаузе: это безопасно?"". J. Steroid Biochem. Мол. Биол. 153: 151–9. Дои:10.1016 / j.jsbmb.2015.08.013. PMID 26291834. S2CID 23985966.
- ^ а б c d е ж грамм час я «Медроксипрогестерона ацетат». Американское общество фармацевтов систем здравоохранения. В архиве из оригинала 24 декабря 2016 г.. Получено 8 декабря 2016.
- ^ а б c d е ж грамм час я j k л м п о https://www.drugs.com/international/medroxyprogesterone.html
- ^ а б c d е ж грамм час я j k Sweetman, Шон С., изд. (2009). «Половые гормоны и их модуляторы». Мартиндейл: полный справочник лекарств (36-е изд.). Лондон: Фармацевтическая пресса. С. 2113–2114. ISBN 978-0-85369-840-1.
- ^ а б c d е Кемппайнен Дж. А., Лэнгли Е., Вонг К. И., Бобсейн К., Келсе В. Р., Уилсон Е. М. (март 1999 г.). «Различение агонистов и антагонистов андрогенных рецепторов: различные механизмы активации медроксипрогестерона ацетатом и дигидротестостероном». Молекулярная эндокринология. 13 (3): 440–54. Дои:10.1210 / исправление.13.3.0255. PMID 10077001.
- ^ а б Genazzani AR (15 января 1993 г.). Границы гинекологического и акушерского исследования. Тейлор и Фрэнсис. п. 320. ISBN 978-1-85070-486-7. В архиве из оригинала от 20 мая 2016 г.
-
^ а б Стэнли М. Робертс (7 мая 2013 г.). Введение в исследования и разработки биологических и малых молекул: Глава 12. Заместительная гормональная терапия.. Elsevier Science. С. 9–. ISBN 978-0-12-806202-9.
[...] медроксипрогестерона ацетат, также известный как Провера (обнаружен одновременно Серлом и Апджоном в 1956 году) [..]
- ^ а б Снейдер В (2005). «Глава 18: Аналоги гормонов». Открытие лекарств: история. Нью-Йорк: Вили. п. 204. ISBN 0-471-89980-1.
- ^ Всемирная организация здоровья (2019). Типовой список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г.. Женева: Всемирная организация здравоохранения. HDL:10665/325771. WHO / MVP / EMP / IAU / 2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ А. Уэйн Мейкл (1 июня 1999 г.). Заместительная гормональная терапия. Springer Science & Business Media. С. 383–. ISBN 978-1-59259-700-0.
- ^ Специальная программа исследований, разработок и подготовки научных кадров в области репродукции человека (Всемирная организация здравоохранения); Всемирная организация здравоохранения (2002 г.). Исследования репродуктивного здоровья в ВОЗ: двухгодичный отчет, 2000-2001 гг.. Всемирная организация здоровья. С. 17–. ISBN 978-92-4-156208-9.CS1 maint: несколько имен: список авторов (связь)
- ^ а б c d е Багаде О, Павар В., Пател Р., Пател Б., Авасаркар В., Дивейт С. (2014). «Увеличение использования обратимых контрацептивов длительного действия: безопасный, надежный и экономичный контроль над рождаемостью» (PDF). World J Pharm Pharm Sci. 3 (10): 364–392. ISSN 2278-4357. Архивировано из оригинал (PDF) на 2017-08-10. Получено 2016-08-24. Ошибка цитирования: именованная ссылка "BagadePawar2014" была определена несколько раз с разным содержанием (см. страница помощи).
- ^ а б Сулочана Гунашила (14 марта 2011 г.). Практическое лечение гинекологических проблем. JP Medical Ltd. стр. 39–. ISBN 978-93-5025-240-6.
- ^ «ТОП-300 2020». ClinCalc. Получено 11 апреля 2020.
- ^ «Медроксипрогестерона ацетат - Статистика употребления наркотиков». ClinCalc. Получено 11 апреля 2020.
- ^ Фернесс С., Робертс Х, Марджорибанкс Дж., Летаби А. (август 2012 г.). «Гормональная терапия у женщин в постменопаузе и риск гиперплазии эндометрия». Кокрановская база данных систематических обзоров (8): CD000402. Дои:10.1002 / 14651858.CD000402.pub4. ЧВК 7039145. PMID 22895916.
- ^ а б «Медроксипрогестерон». MedlinePlus. 2008-01-09. В архиве из оригинала от 12.07.2010. Получено 2010-07-02.
- ^ а б Панай Н., Фентон А. (февраль 2010 г.). «Биоидентичные гормоны: о чем весь этот ажиотаж?». Климактерический. 13 (1): 1–3. Дои:10.3109/13697130903550250. PMID 20067429. S2CID 244295.
- ^ Light SA, Holroyd S (март 2006 г.). «Использование ацетата медроксипрогестерона для лечения неприемлемого сексуального поведения у пациентов с деменцией» (PDF). Журнал психиатрии и неврологии. 31 (2): 132–4. ЧВК 1413960. PMID 16575429. В архиве (PDF) из оригинала от 07.03.2016.
- ^ «Химический нож». Архивировано из оригинал на 2009-01-07. Получено 2009-01-22.
-
^ а б Депо-Провера (медроксипрогестерона ацетат) (NDA # 012541) - Лекарства @ FDA: одобренные FDA лекарственные препараты, получено 2 апреля 2018,
Оригинальные или предварительные разрешения: 23.09.1960.
- ^ а б c d Мейлер Л (2009). Побочные эффекты Мейлера эндокринных и метаболических препаратов. Амстердам: Elsevier Science. С. 281–284]. ISBN 978-0-444-53271-8. В архиве из оригинала от 23.10.2014.
- ^ Ганзина Ф (октябрь 1979). «Лечение высокими дозами медроксипрогестерона ацетата (MPA) при распространенном раке груди. Обзор». Тумори. 65 (5): 563–85. Дои:10.1177/030089167906500507. PMID 390798. S2CID 23378403.
- ^ Kjaer M (сентябрь 1988 г.). «Роль ацетата медроксипрогестерона (MPA) в лечении аденокарциномы почек». Лечение рака. Rev. 15 (3): 195–209. Дои:10.1016/0305-7372(88)90003-5. PMID 2974757.
- ^ Вандерстаппен Д., Бонте Дж. (1992). «Новые тенденции в использовании медроксипрогестерона ацетата в качестве химиотерапевтического средства при гинекологических злокачественных новообразованиях». Евро. J. Gynaecol. Онкол. 13 (2): 113–23. PMID 1534051.
- ^ Гурен Л. (2005). «Гормональное лечение взрослого пациента-транссексуала». Horm. Res. 64 Дополнение 2 (2): 31–6. Дои:10.1159/000087751. PMID 16286768. S2CID 42507159.
- ^ Анупам Сачдева; AK Dutta (31 августа 2012 г.). Достижения в педиатрии. JP Medical Ltd. стр. 1202–. ISBN 978-93-5025-777-7.
- ^ Хаммерштейн, Дж. (1990). «Антиандрогены: клинические аспекты». Волосы и болезни волос. С. 827–886. Дои:10.1007/978-3-642-74612-3_35. ISBN 978-3-642-74614-7.
- ^ а б Анне Надакавукарен (28 февраля 2011 г.). Наша глобальная окружающая среда: взгляд на здоровье, седьмое издание. Waveland Press. С. 63–. ISBN 978-1-4786-0976-6.
- ^ а б Трассел Дж. (2011). «Противозачаточная эффективность». В Hatcher RA, Trussell J, Nelson AL, Cates W., Kowal D, Policar MS (ред.). Противозачаточные технологии (20-е изд.). Нью-Йорк: Ardent Media. С. 779–863. ISBN 978-1-59708-004-0. OCLC 781956734. Таблица 26–1 = Таблица 3–2 Процент женщин, у которых возникла незапланированная беременность в течение первого года обычного использования и первого года безупречного использования контрацепции, а также процент женщин, продолжающих использовать в конце первого года. Соединенные Штаты. В архиве 2017-02-15 в Wayback Machine
- ^ а б c Бакри С., Мери З.О., Скализ Т.Дж., Махмуд М.С., Фадиэль А., Нафтолин Ф. (июль 2008 г.). «Депо-медроксипрогестерона ацетат: обновление». Arch. Гинеколь. Акушерство. 278 (1): 1–12. Дои:10.1007 / s00404-007-0497-z. PMID 18470526. S2CID 11340062.
- ^ а б c Вестхофф C (август 2003 г.). «Инъекция депо-медроксипрогестерона ацетата (Депо-Провера): высокоэффективный вариант контрацепции с доказанной долгосрочной безопасностью». Контрацепция. 68 (2): 75–87. Дои:10.1016 / S0010-7824 (03) 00136-7. PMID 12954518.
- ^ а б c d е Трассел Дж. (2004). «Противозачаточная эффективность». В Хэтчер Р.А., Трассел Дж., Стюарт Ф.Х., Нельсон А.Л., Кейтс-младший У., Гость Ф., Ковал Д. (ред.). Противозачаточные технологии (18-е изд.). Нью-Йорк: Ardent Media. С. 773–845. ISBN 0-9664902-5-8.
- ^ а б c Трассел Дж. (Август 2004 г.). «Противозачаточные средства в США». Контрацепция. 70 (2): 89–96. Дои:10.1016 / j.contraception.2004.03.009. ЧВК 3638209. PMID 15288211.
- ^ Трассел Дж., Хэтчер Р.А., Кейтс В., Стюарт Ф. Х., Кост К. (сентябрь 1990 г.). «Руководство по интерпретации исследований противозачаточной эффективности». Акушерство и гинекология. 76 (3 Pt 2): 558–67. PMID 2199875.
- ^ Трассел Дж. (1994). «Показатели неудач контрацепции». В Hatcher RA, Trussell J, Stewart F, Stewart GK, Kowal D, Guest F, Cates W, Policar MS (ред.). Противозачаточные технологии (16-е изд.). Нью-Йорк: Издательство Ирвингтона. стр.637 –688. ISBN 0-8290-3171-5.
- ^ Трассел Дж. (1998). «Противозачаточная эффективность». В Хэтчер Р.А., Трасселл Дж., Стюарт Ф., Кейтс В., Стюарт Г.К., Гость Ф., Ковал Д. (ред.). Противозачаточные технологии (17-е изд.). Нью-Йорк: Ardent Media. стр.779 –844. ISBN 0-9664902-0-7.
- ^ FDA (1998). «Руководство для промышленности - Единая маркировка противозачаточных средств» (PDF). Архивировано из оригинал (PDF) 25 февраля 2007 г.. Получено 2007-06-21.
- ^ Трассел Дж. (2007). «Противозачаточная эффективность». В Хэтчер Р.А., Трассел Дж., Нельсон А.Л., Кейтс В., Стюарт Ф.Х., Ковал Д. (ред.). Противозачаточные технологии (19-е изд.). Нью-Йорк: Ardent Media. Архивировано из оригинал на 2008-05-31. Получено 2007-06-21.
- ^ Трассел Дж., Воан Б. (1999). «Несостоятельность противозачаточных средств, прекращение использования и возобновление их использования в связи с методом: результаты Национального исследования роста семьи 1995 года» (PDF). Перспективы планирования семьи. 31 (2): 64–72, 93. Дои:10.2307/2991641. JSTOR 2991641. PMID 10224544. В архиве (PDF) из оригинала от 02.12.2008.
- ^ а б c Хэтчер Р.А. (2004). «Инъекции Депо-Провера, имплантаты и таблетки, содержащие только прогестин (минипиллы)». В Хэтчер Р.А., Трассел Дж., Стюарт Ф.Х., Нельсон А.Л., Кейтс-младший У., Гость Ф., Ковал Д. (ред.). Противозачаточные технологии (18-е изд.). Нью-Йорк: Ardent Media. С. 461–494. ISBN 0-9664902-5-8.
- ^ а б c Сперофф Л., Дарни П.Д. (2005). «Инъекционная контрацепция». Клиническое руководство по контрацепции (4-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. С. 201–220. ISBN 0-7817-6488-2.
- ^ Мишель Д.Р. (2004). «Контрацепция». В Strauss JF, Barbieri RL (ред.). Репродуктивная эндокринология Йен и Джаффе (5-е изд.). Филадельфия: Эльзевьер Сондерс. С. 899–938. ISBN 0-7216-9546-9.
- ^ а б Кауниц А.М. (декабрь 2001 г.). «Текущие варианты инъекционных контрацептивов в США». Семинары по репродуктивной медицине. 19 (4): 331–7. Дои:10.1055 / с-2001-18641. PMID 11727175.
- ^ а б Бигригг А., Эванс М., Гболад Б., Ньютон Дж., Поллард Л., Шаревски А., Томас С., Уоллинг М. (июль 1999 г.). «Депо Провера. Позиционный документ по клиническому применению, эффективности и побочным эффектам». Британский журнал планирования семьи. 25 (2): 69–76. PMID 10454658.
- ^ а б «Депо-медроксипрогестерона ацетат (DMPA) и риск рака эндометрия. Совместное исследование неоплазии и стероидных контрацептивов ВОЗ». Международный журнал рака. 49 (2): 186–90. Сентябрь 1991 г. Дои:10.1002 / ijc.2910490207. PMID 1831802. S2CID 221776781.
- ^ Сантен Р.Дж. (2004). «Эндокринология рака груди и эндометрия». В Strauss JF, Barbieri RL (ред.). Репродуктивная эндокринология Йен и Джаффе (5-е изд.). Филадельфия: Эльзевьер Сондерс. С. 787–809. ISBN 0-7216-9546-9.
-
^ Барц Д., Гольдберг А.Б. (2011). «Инъекционные противозачаточные средства». В Hatcher RA, Trussell J, Nelson AL, Cates W Jr, Kowal D, Policar MS (ред.). Противозачаточные технологии (20-е изд.). Нью-Йорк: Ardent Media. С. 212–213. ISBN 978-1-59708-004-0. OCLC 781956734.
Преимущества инъекций DMPA. 5. Снижение риска внематочной беременности. По сравнению с женщинами, которые вообще не используют противозачаточные средства, женщины, использующие ДМПА, имеют меньший риск внематочной беременности. Хотя общий риск беременности и, следовательно, внематочной беременности снижается с помощью ДМПА, следует исключить возможность внематочной беременности, если женщина, принимающая ДМПА, забеременеет. Одно исследование показало, что 1,5% женщин, забеременевших на ДМПА, имели внематочную беременность, такой же уровень внематочной беременности, как и у женщин, забеременевших без использования противозачаточных средств.27
- ^ Боргатта Л., Мурти А., Чуанг С., Бердсли Л., Бернхилл М.С. (сентябрь 2002 г.). «Беременность, диагностированная при использовании Депо-Провера». Контрацепция. 66 (3): 169–72. Дои:10.1016 / S0010-7824 (02) 00340-2. PMID 12384205.
- ^ О'Брайен, доктор медицины, Гийбо Дж (сентябрь 2006 г.). «Контрацепция для женщин, страдающих эпилепсией». Эпилепсия. 47 (9): 1419–22. Дои:10.1111 / j.1528-1167.2006.00671.x. PMID 16981856. S2CID 22284176.
- ^ «Увеличение использования обратимых контрацептивов длительного действия». Nursing Times.net. 21 октября 2008 г. В архиве из оригинала 26 августа 2009 г.. Получено 2009-06-19.
- ^ «CG30 Обратимая контрацепция длительного действия: краткое справочное руководство» (PDF). Национальный институт здоровья и клинического совершенства. Архивировано из оригинал (PDF) на 2009-09-20. Получено 2009-06-19.
-
^ «Набор правил сексуального здоровья» (PDF). Новая концепция качества и результатов контрактов GMS - набор данных внедрения и бизнес-правила. Ввод в эксплуатацию первичной помощи. 1 мая 2009 г. В архиве (PDF) из оригинала 10 августа 2011 г.. Получено 2009-06-19.
Обобщено на
* «Контрацепция - показатели качества управления». Обзоры клинических знаний NHS. Институт инноваций и усовершенствований NHS. Получено 2009-06-19. [постоянная мертвая ссылка ] - ^ а б c Холторф К (Январь 2009 г.). «Споры о биоидентичных гормонах: являются ли биоидентичные гормоны (эстрадиол, эстриол и прогестерон) более безопасными или более эффективными, чем обычно используемые синтетические версии в заместительной гормональной терапии?» (PDF). Последипломная медицина. 121 (1): 73–85. Дои:10.3810 / PGM.2009.01.1949. PMID 19179815. S2CID 2060730. Архивировано из оригинал (PDF) на 2011-07-08.
- ^ Чирильяно М (июнь 2007 г.). «Биоидентичная гормональная терапия: обзор доказательств» (PDF). Журнал женского здоровья. 16 (5): 600–31. Дои:10.1089 / jwh.2006.0311. PMID 17627398. Архивировано из оригинал (PDF) на 2011-01-06.
- ^ Бутби Л.А., Деринг П.Л. (август 2008 г.). «Биоидентичная гормональная терапия: панацея, не имеющая дополнительных доказательств». Текущее мнение в области акушерства и гинекологии. 20 (4): 400–7. Дои:10.1097 / GCO.0b013e3283081ae9. PMID 18660693. S2CID 22449765.
- ^ а б c d "Drugs @ FDA: одобренные FDA лекарственные препараты". Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. В архиве из оригинала 16 ноября 2016 г.. Получено 31 марта 2018.
- ^ Энгорн Б., Флерлаге Дж. (1 мая 2014 г.). Электронная книга Harriet Lane Handbook. Elsevier Health Sciences. С. 846–. ISBN 978-0-323-11246-8.
- ^ Адриана П. Тициани (1 июня 2013 г.). Руководство по лекарствам для медсестер Хаварда. Elsevier Health Sciences. С. 989–. ISBN 978-0-7295-8162-2.
- ^ Фреймут А. Лейденбергер (17 апреля 2013 г.). Klinische Endokrinologie für Frauenärzte. Springer-Verlag. С. 528–. ISBN 978-3-662-08110-5.
- ^ Стейси, Дон. Депо Провера: укол противозачаточных средств В архиве 2008-10-10 на Wayback Machine Доступ 13 октября 2009 г.
- ^ ВОЗ (2004). «Контрацептивы, содержащие только прогестагены». Медицинские критерии приемлемости для использования противозачаточных средств (3-е изд.). Женева: Репродуктивное здоровье и исследования, ВОЗ. ISBN 92-4-156266-8. В архиве из оригинала 31.05.2009.
- ^ FFPRHC (2006). «Медицинские критерии приемлемости для использования противозачаточных средств в Великобритании (2005/2006)» (PDF). Архивировано из оригинал (PDF) 19 июня 2007 г.. Получено 2007-01-11.
- ^ а б c d «Медроксипрогестерон: информация о лекарствах предоставлена Lexi-Comp». Руководство Merck. 2009-12-01. В архиве из оригинала от 24.07.2010. Получено 2010-07-08.
- ^ King SR (9 ноября 2012 г.). Нейростероиды и нервная система. Springer Science & Business Media. С. 45–. ISBN 978-1-4614-5559-2. В архиве из оригинала от 5 ноября 2017 года.
- ^ а б Pfizer (Октябрь 2004 г.). «Противозачаточные инъекции Депо-Провера, маркировка пациентов в США» (PDF). Архивировано из оригинал (PDF) на 2007-02-06. Получено 2007-02-21.
- ^ Аматаякуль К., Сивасомбун Б., Танангкул О. (сентябрь 1978 г.). «Метаболизм витаминов и микроэлементов у пользователей медроксипрогестерона ацетата». Контрацепция. 18 (3): 253–69. Дои:10.1016 / с0010-7824 (78) 80019-5. PMID 720068.
- ^ а б Нельсон, Анита Л (2014). «DMPA: избитый и в синяках, но все еще нужен и используется в США». Экспертный обзор акушерства и гинекологии. 5 (6): 673–686. Дои:10.1586 / eog.10.60. ISSN 1747-4108.
-
^ а б Джеффри К. Аронсон (15 октября 2015 г.). Побочные эффекты лекарств Мейлера: Международная энциклопедия побочных реакций и взаимодействий с лекарствами. Elsevier Science. С. 2–. ISBN 978-0-444-53716-4.
Возможно, удивительно, но, похоже, появляется консенсус в отношении того, что имплантаты депо медроксипрогестерона ацетата на самом деле не приводят к увеличению частоты депрессии или серьезности ранее существовавшей депрессии даже через 1 или 2 года, и при этом они не вызывают значительного веса. прирост.
- ^ «Воздействие ДМПА во время беременности может вызвать низкий вес при рождении». Прогресс в исследованиях репродукции человека (23): 2–3. 1992. PMID 12286194.
- ^ а б c Рожерио А. Лобо (5 июня 2007 г.). Лечение женщины в постменопаузе: основные и клинические аспекты. Эльзевир. С. 211–. ISBN 978-0-08-055309-2.
-
^ Кауниц А.М. (1999). «Гормональные контрацептивы длительного действия: оценка влияния на плотность, вес и настроение костей». Женщины Int J Fertil Med. 44 (2): 110–7. PMID 10338269.
Несмотря на эффективность и растущую приемлемость этих долгосрочных методов, некоторые клиницисты и женщины неохотно используют их из-за опасений по поводу снижения плотности костной ткани при ДМПА, а также депрессивных симптомов и проблем с массой тела при использовании инъекционных препаратов и имплантатов. Недавний многоцентровый опыт не показал увеличения депрессивных симптомов после 1 года использования DMPA и 2 лет использования Norplant, даже среди пользователей с наивысшими средними показателями депрессивных симптомов до терапии.
- ^ а б c Уорли Б.Л., Гур Т.Л., Шаффир Дж. (Февраль 2018 г.). «Взаимосвязь между прогестиновыми гормональными контрацептивами и депрессией: систематический обзор». Контрацепция. 97 (6): 478–489. Дои:10.1016 / j.contraception.2018.01.010. PMID 29496297.
-
^ Вестхофф C (август 2003 г.). «Инъекция депо-медроксипрогестерона ацетата (Депо-Провера): высокоэффективный вариант контрацепции с доказанной долгосрочной безопасностью». Контрацепция. 68 (2): 75–87. Дои:10.1016 / с0010-7824 (03) 00136-7. PMID 12954518.
Другой распространенной проблемой переносимости гормональной контрацепции у пациентов является их влияние на настроение [95]. Большинство опубликованных отчетов указывают на то, что ДМПА не вызывает депрессивных симптомов. В крупном 1-летнем клиническом исследовании DMPA с участием 3857 женщин в США менее 2% пользователей сообщили о депрессии [15]. В других отчетах в различных учреждениях, включая частную практику [96], подростковые клиники [97,98], психиатрические больницы [99] и городские клиники планирования семьи [100,101], не было обнаружено неблагоприятного воздействия DMPA на депрессию. . [...] Используя различные объективные показатели депрессивных симптомов, общие данные как для ОК, так и для ДМПА подтверждают, что эти агенты не оказывают значительного влияния на настроение. Хотя наличие в анамнезе симптомов настроения до использования ОК может предрасполагать подгруппу женщин к негативным изменениям настроения, данные о ДМПА позволяют предположить, что даже женщины, у которых до лечения были симптомы депрессии, могут переносить терапию без обострения этих симптомов.
- ^ а б c d Вестхофф С., Трумэн С., Калмусс Д., Кушман Л., Дэвидсон А., Рулин М., Хартвелл С. (апрель 1998 г.). «Депрессивные симптомы и Депо-Провера». Контрацепция. 57 (4): 237–40. Дои:10.1016 / с0010-7824 (98) 00024-9. PMID 9649914.
- ^ Финк Дж., Пфафф Д.В., Левин Дж. (31 августа 2011 г.). Справочник по нейроэндокринологии. Академическая пресса. С. 564–. ISBN 978-0-12-378554-1.
- ^ Дженис Райден (2009). Практическая гинекология: руководство для врача первичного звена. ACP Press. С. 379–. ISBN 978-1-934465-05-9.
- ^ Хлатки М.А., Бутройд Д., Виттингхофф Е., Шарп П., Вули М.А. (февраль 2002 г.). «Качество жизни и депрессивные симптомы у женщин в постменопаузе после приема гормональной терапии: результаты исследования по замене сердца и эстроген / прогестин (HERS)». JAMA. 287 (5): 591–7. Дои:10.1001 / jama.287.5.591. PMID 11829697.
- ^ Wiegratz I, Kuhl H (август 2004 г.). «Прогестагенная терапия: различия в клинических эффектах?». Тенденции Endocrinol. Метаб. 15 (6): 277–85. Дои:10.1016 / j.tem.2004.06.006. PMID 15358281. S2CID 35891204.
- ^ Россоу Дж. Э., Андерсон Г. Л., Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SA, Howard BV, Johnson KC, Kotchen JM, Ockene J (июль 2002 г.). «Риски и преимущества эстрогена и прогестина у здоровых женщин в постменопаузе: основные результаты рандомизированного контролируемого исследования инициативы« Здоровье женщин »» (PDF). JAMA. 288 (3): 321–33. Дои:10.1001 / jama.288.3.321. PMID 12117397. S2CID 20149703.
- ^ Bethea CL (февраль 2011 г.). «МПА: ацетат медроксипрогестерона - очень плохой совет для женщин». Эндокринология. 152 (2): 343–5. Дои:10.1210 / en.2010-1376. ЧВК 3037166. PMID 21252179.
- ^ Прентис Р.Л., Андерсон Г.Л. (2008). «Инициатива по охране здоровья женщин: извлеченные уроки». Ежегодный обзор общественного здравоохранения. 29: 131–50. Дои:10.1146 / annurev.publhealth.29.020907.090947. PMID 18348708.
- ^ Buist DS, Newton KM, Miglioretti DL, Beverly K, Connelly MT, Andrade S, Hartsfield CL, Wei F, Chan KA, Kessler L (ноябрь 2004 г.). «Шаблоны прописывания гормональной терапии в Соединенных Штатах». Акушерство и гинекология. 104 (5 Pt 1): 1042–50. Дои:10.1097 / 01.AOG.0000143826.38439.af. PMID 15516400. S2CID 31593637.
- ^ а б Бейер-Вестендорф Дж., Бауэрсахс Р., Хах-Вундерле В., Зоц Р. Б., Ротт Г. (октябрь 2018 г.). «Половые гормоны и венозная тромбоэмболия - от контрацепции до заместительной гормональной терапии». ВАСА. 47 (6): 441–450. Дои:10.1024 / 0301-1526 / a000726. PMID 30008249.
- ^ а б c d ДеЛугери Т.Г. (июнь 2011 г.). «Эстроген и тромбоз: противоречия и здравый смысл». Rev Endocr Metab Disord. 12 (2): 77–84. Дои:10.1007 / s11154-011-9178-0. PMID 21559819. S2CID 28053690.
- ^ а б c Mantha, S .; Karp, R .; Рагхаван, В .; Terrin, N .; Bauer, K. A .; Цвикер, Дж. И. (2012). «Оценка риска венозных тромбоэмболических событий у женщин, принимающих только прогестиновые контрацептивы: метаанализ». BMJ. 345 (август 2007 г.): e4944. Дои:10.1136 / bmj.e4944. ISSN 1756-1833. ЧВК 3413580. PMID 22872710.
- ^ а б Теппер Н.К., Дженг Дж., Кертис К.М., Буто М.Э., Буле С.Л., Уайтман М.К. (март 2019 г.). «Венозная тромбоэмболия среди женщин, начинающих депо медроксипрогестерона ацетата сразу после родов». Акушер Гинеколь. 133 (3): 533–540. Дои:10.1097 / AOG.0000000000003135. PMID 30741807.
- ^ Van Hylckama Vlieg, A .; Миддельдорп, С. (2011). «Гормональная терапия и венозная тромбоэмболия: где мы сейчас?». Журнал тромбоза и гемостаза. 9 (2): 257–266. Дои:10.1111 / j.1538-7836.2010.04148.x. ISSN 1538-7933. PMID 21114755. S2CID 32394836.
- ^ Benagiano, G .; Примьеро, Ф. (1983). «Текущее состояние контрацептивов длительного действия». Наркотики. 25 (6): 570–609. Дои:10.2165/00003495-198325060-00003. ISSN 0012-6667. PMID 6223801. S2CID 45898359.
- ^ Ротт Х (февраль 2019 г.). «Противозачаточные таблетки и тромботические риски: различия в методах контрацепции с эстрогеном и без него». Hamostaseologie. 39 (1): 42–48. Дои:10.1055 / с-0039-1677806. PMID 30669160.
- ^ а б Скарабин PY (август 2018). «Прогестагены и венозная тромбоэмболия у женщин в менопаузе: обновленный мета-анализ перорального и трансдермального эстрогенов». Климактерический. 21 (4): 341–345. Дои:10.1080/13697137.2018.1446931. PMID 29570359. S2CID 4229701.
- ^ а б Sitruk-Ware R, Nath A (июнь 2011 г.). «Метаболические эффекты противозачаточных стероидов». Rev Endocr Metab Disord. 12 (2): 63–75. Дои:10.1007 / s11154-011-9182-4. PMID 21538049. S2CID 23760705.
- ^ а б Kuhl H (2011). «Фармакология прогестагенов» (PDF). J Reproduktionsmed Эндокринол. 8 (1): 157–177. В архиве (PDF) из оригинала от 11.10.2016.
-
^ «Депо медроксипрогестерона ацетат и эффекты на кости. Мнение Комитета № 602». Июнь 2014 г. В архиве из оригинала от 30.04.2015. Получено 2015-05-03. Цитировать журнал требует
| журнал =(помощь) - ^ а б FDA (17 ноября 2004 г.). «Добавлено предупреждение о черном ящике относительно длительного использования противозачаточных инъекций Депо-Провера». Архивировано из оригинал 21 декабря 2005 г.. Получено 2006-05-12.
- ^ Всемирная организация здоровья (Сентябрь 2005 г.). «Гормональная контрацепция и здоровье костей». Планирование семьи. В архиве из оригинала от 14 мая 2006 г.. Получено 2006-05-12.
- ^ Кертис К.М., Мартинс С.Л. (май 2006 г.). «Контрацептивы, содержащие только прогестагены, и минеральная плотность костей: систематический обзор». Контрацепция. 73 (5): 470–87. Дои:10.1016 / j.contraception.2005.12.010. PMID 16627031.
- ^ Канди Т., Корниш Дж., Эванс М.С., Робертс Х., Рейд И.Р. (январь 1994 г.). «Восстановление плотности костной ткани у женщин, прекративших прием медроксипрогестерона ацетата». BMJ. 308 (6923): 247–8. Дои:10.1136 / bmj.308.6923.247. ЧВК 2539337. PMID 8111260.
- ^ Скоулз Д., ЛаКруа, Аризона, Итикава Л.Э., Барлоу В.Е., Отт С.М. (сентябрь 2002 г.). «Инъекционные гормональные контрацептивы и плотность костей: результаты проспективного исследования». Эпидемиология. 13 (5): 581–7. Дои:10.1097/00001648-200209000-00015. PMID 12192229.
- ^ Скоулз Д., ЛаКруа, Аризона, Итикава Л.Э., Барлоу В.Е., Отт С.М. (февраль 2005 г.). «Изменение минеральной плотности костной ткани среди женщин-подростков, использующих и прекращающих противозачаточные средства депо медроксипрогестерона ацетата». Архивы педиатрии и подростковой медицины. 159 (2): 139–44. Дои:10.1001 / архпеди.159.2.139. PMID 15699307.
- ^ Орр-Уокер Б.Дж., Эванс М.К., Эймс Р.В., Клируотер Дж.М., Канди Т., Рейд И.Р. (ноябрь 1998 г.). «Влияние прошлого использования инъекционного противозачаточного депо медроксипрогестерона ацетата на минеральную плотность костей у нормальных женщин в постменопаузе». Клиническая эндокринология. 49 (5): 615–8. Дои:10.1046 / j.1365-2265.1998.00582.x. PMID 10197077. S2CID 22565912.
- ^ Канди Т., Корниш Дж., Робертс Х., Рейд И. Р. (май 2002 г.). «Менопаузальная потеря костной массы у лиц, длительное время использующих противозачаточные средства депо медроксипрогестерона ацетата». Американский журнал акушерства и гинекологии. 186 (5): 978–83. Дои:10.1067 / моб.2002.122420. PMID 12015524.
- ^ Уолш Дж. С., Истелл Р., Пил Н. Ф. (февраль 2010 г.). «Использование депо медроксипрогестерона ацетата после пика костной массы связано с увеличением метаболизма костной ткани, но без снижения минеральной плотности костной ткани». Фертильность и бесплодие. 93 (3): 697–701. Дои:10.1016 / j.fertnstert.2008.10.004. PMID 19013564.
- ^ Комитет гинекологов Американского колледжа акушеров-гинекологов по гинекологической практике (сентябрь 2008 г.). «Заключение Комитета ACOG № 415: Депо медроксипрогестерона ацетат и эффекты на кости». Акушерство и гинекология. 112 (3): 727–30. Дои:10.1097 / AOG.0b013e318188d1ec. PMID 18757687.
- ^ Polis CB, Phillips SJ, Curtis KM, Westreich DJ, Steyn PS, Raymond E, Hannaford P, Turner AN (октябрь 2014 г.). «Гормональные методы контрацепции и риск заражения ВИЧ у женщин: систематический обзор эпидемиологических данных». Контрацепция. 90 (4): 360–90. Дои:10.1016 / j.contraception.2014.07.009. PMID 25183264.
- ^ Департамент репродуктивного здоровья и исследований ВОЗ (16 февраля 2012 г.). «Техническое заявление: Гормональная контрацепция и ВИЧ». Женева: Всемирная организация здравоохранения. В архиве с оригинала от 30 января 2015 г.
- ^ Департамент репродуктивного здоровья и исследований ВОЗ (23 июля 2014 г.). «Руководство 2014 года: методы гормональной контрацепции для женщин с высоким риском заражения ВИЧ и живущих с ВИЧ» (PDF). Женева: Всемирная организация здравоохранения. В архиве (PDF) с оригинала от 30 января 2015 г.
- ^ AVAC (27 января 2015 г.). "Новости с фронта HC-HIV: идет дождь мета (анализов)!". Нью-Йорк: Коалиция в защиту вакцины против СПИДа. В архиве с оригинала от 30 января 2015 г.
- ^ Ральф Л.Дж., Маккой С.И., Шиу К., Падиан Н.С. (февраль 2015 г.). «Использование гормональных контрацептивов и риск заражения женщин ВИЧ: метаанализ обсервационных исследований». Ланцет. Инфекционные заболевания. 15 (2): 181–9. Дои:10.1016 / S1473-3099 (14) 71052-7. ЧВК 4526270. PMID 25578825.
- ^ Моррисон К.С., Чен П.Л., Квок С., Баетен Дж. М., Браун Дж., Крук А. М., Ван Дамм Л., Делани-Моретльве С., Фрэнсис С. К., Фридланд Б. А., Хейс Р. Дж., Хеффрон Р., Капига С., Карим К. А., Карпофф С., Каул Р. , McClelland RS, McCormack S, McGrath N, Myer L, Rees H, van der Straten A, Watson-Jones D, van de Wijgert JH, Stalter R, Low N (январь 2015 г.). «Гормональная контрацепция и риск заражения ВИЧ: метаанализ данных отдельных участников». PLOS Медицина. 12 (1): e1001778. Дои:10.1371 / journal.pmed.1001778. ЧВК 4303292. PMID 25612136.
- ^ Факультет сексуального репродуктивного здоровья (январь 2015 г.). «Заявление CEU: депо медроксипрогестерона ацетат (DMPA, Depo-Provera) и риск заражения ВИЧ» (PDF). Лондон: Королевский колледж акушеров и гинекологов. Архивировано из оригинал (PDF) 2015-01-30.
- ^ Бринд Дж., Кондли С.Дж., Мошер С.В., Морс А.Р., Кимбалл Дж. (2015). «Риск заражения ВИЧ у пользователей депо-медроксипрогестерона ацетата (DMPA): систематический обзор и метаанализ». Проблемы Law Med. 30 (2): 129–39. PMID 26710371.
- ^ Консорциум ECHO Trial (13 июня 2019 г.). «Заболеваемость ВИЧ среди женщин, использующих внутримышечное депо медроксипрогестерона ацетат, медную внутриматочную спираль или имплантат левоноргестрела для контрацепции: рандомизированное многоцентровое открытое исследование». Ланцет. 394 (10195): 303–313. Дои:10.1016 / S0140-6736 (19) 31288-7. ЧВК 6675739. PMID 31204114.
- ^ Дальберг К. (февраль 1982 г.). «Некоторые эффекты депо-медроксипрогестерона ацетата (DMPA): наблюдения у грудного ребенка и у длительного пользователя». Международный журнал гинекологии и акушерства. 20 (1): 43–8. Дои:10.1016/0020-7292(82)90044-3. PMID 6126406. S2CID 8295162.
- ^ Пардтайсонг Т., Йенчит С., Грей Р. (апрель 1992 г.). «Долгосрочный рост и развитие детей, подвергшихся воздействию Депо-Провера во время беременности или кормления грудью». Контрацепция. 45 (4): 313–24. Дои:10.1016 / 0010-7824 (92) 90053-В. PMID 1387602.
- ^ а б Мусс Х. Б., Круз Дж. М. (август 1992 г.). «Высокодозная терапия прогестином при метастатическом раке груди». Анналы онкологии. 3 Дополнение 3: 15–20. Дои:10.1093 / annonc / 3.suppl_3.S15. PMID 1390312.
- ^ Паннути Ф, Мартони А., Леназ Г.Р., Пиана Э., Нанни П. (апрель 1978 г.). «Возможный новый подход к лечению метастатического рака груди: массивные дозы медроксипрогестерона ацетата». Рак лечить Rep. 62 (4): 499–504. PMID 350387.
- ^ Simons JP, Schols AM, Hoefnagels JM, Westerterp KR, ten Velde GP, Wouters EF (февраль 1998 г.). «Влияние ацетата медроксипрогестерона на потребление пищи, состав тела и расход энергии в покое у пациентов с запущенным, негормоночувствительным раком: рандомизированное плацебо-контролируемое исследование». Рак. 82 (3): 553–60. Дои:10.1002 / (sici) 1097-0142 (19980201) 82: 3 <553 :: aid-cncr18> 3.0.co; 2-0. PMID 9452274.
- ^ Всемирная организация здравоохранения (2004 г.). Остатки некоторых ветеринарных препаратов в животных и пищевых продуктах: монографии, подготовленные Шестьдесят вторым совещанием Объединенного комитета экспертов ФАО / ВОЗ по пищевым добавкам, Рим, 4-12 февраля 2004 г.. Продовольственная и сельскохозяйственная организация. п. 49. ISBN 978-92-5-105195-5. В архиве из оригинала 17 июня 2014 г.
- ^ Бентел Дж. М., Биррелл С. Н., Пикеринг М. А., Диджей Холдс, Диджей Хорсфолл, Тилли В. Д. (август 1999 г.). «Агонистическая активность рецептора андрогенов синтетического прогестина, медроксипрогестерона ацетата, в клетках рака груди человека». Молекулярная и клеточная эндокринология. 154 (1–2): 11–20. Дои:10.1016 / S0303-7207 (99) 00109-4. PMID 10509795. S2CID 25584803.
- ^ а б c Пуллен М.А., Лапинг Н., Эдвардс Р., Брей Дж. (Сентябрь 2006 г.). «Определение конформационных изменений рецептора прогестерона с использованием анализов, подобных ELISA». Стероиды. 71 (9): 792–8. Дои:10.1016 / j.steroids.2006.05.009. PMID 16784762. S2CID 24703323.
- ^ Викстрём А, Грин Б, Йоханссон Э.Д. (1984). «Концентрация медроксипрогестерона ацетата в плазме и функция яичников во время лечения медроксипрогестерона ацетатом в дозах 5 и 10 мг». Acta Obstetricia et Gynecologica Scandinavica. 63 (2): 163–8. Дои:10.3109/00016348409154654. PMID 6233840. S2CID 45767999.
- ^ а б Blum RW (22 октября 2013 г.). Здравоохранение подростков: клинические вопросы. Elsevier Science. С. 216–. ISBN 978-1-4832-7738-7.
- ^ а б Шиндлер А.Е., Кампаньоли С., Друкманн Р., Хубер Дж., Паскуалини Дж. Р., Швеппе К. В., Тийссен Дж. Х. (декабрь 2003 г.). «Классификация и фармакология прогестинов». Maturitas. 46 Приложение 1: S7 – S16. Дои:10.1016 / j.maturitas.2003.09.014. PMID 14670641.
- ^ Glasier A (2006). «Контрацепция». В DeGroot LJ, Jameson JL (ред.). Эндокринология (5-е изд.). Филадельфия: Эльзевьер Сондерс. С. 2993–3003. ISBN 978-0-7216-0376-6.
- ^ Свободный DS, Stancel GM (2006). «Эстрогены и прогестины». В Brunton LL, Lazo JS, Parker KL (ред.). Гудман и Гилман: Фармакологические основы терапии (11-е изд.). Нью-Йорк: Макгроу-Хилл. С. 1541–1571. ISBN 0-07-142280-3.
- ^ а б Ривера Р., Якобсон И., Граймс Д. (ноябрь 1999 г.). «Механизм действия гормональных контрацептивов и внутриматочных противозачаточных средств». Американский журнал акушерства и гинекологии. 181 (5, Pt 1): 1263–9. Дои:10.1016 / S0002-9378 (99) 70120-1. PMID 10561657.
- ^ Фриц М.А., Сперофф Л. (28 марта 2012 г.). Клиническая гинекологическая эндокринология и бесплодие. Липпинкотт Уильямс и Уилкинс. С. 761–. ISBN 978-1-4511-4847-3.
- ^ Knörr K, Beller FK, Lauritzen C (17 апреля 2013 г.). Lehrbuch der Gynäkologie. Springer-Verlag. С. 214–. ISBN 978-3-662-00942-0.
- ^ Knörr K, Knörr-Gärtner H, Beller FK, Lauritzen C (8 марта 2013 г.). Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion. Springer-Verlag. С. 583–. ISBN 978-3-642-95583-9.
- ^ А. Лабхарт (6 декабря 2012 г.). Клиническая эндокринология: теория и практика. Springer Science & Business Media. С. 554–. ISBN 978-3-642-96158-8.
- ^ Horský J, Presl J (1981). «Гормональное лечение нарушений менструального цикла». В Horsky J, Presl K (ред.). Функция яичников и ее нарушения: диагностика и лечение. Springer Science & Business Media. С. 309–332. Дои:10.1007/978-94-009-8195-9_11. ISBN 978-94-009-8195-9.
-
^ Иоахим Уфер (1969). Принципы и практика гормональной терапии в гинекологии и акушерстве. де Грюйтер. п. 49.
17α-гидроксипрогестерона капроат является депо-гестагеном, не имеющим побочных действий. Доза, необходимая для индукции секреторных изменений в примированном эндометрии, составляет около 250 мг. за менструальный цикл.
- ^ Виллибальд Пшайрембель (1968). Praktische Gynäkologie: für Studierende und Ärzte. Вальтер де Грюйтер. С. 598, 601. ISBN 978-3-11-150424-7.
- ^ Ферин Дж. (Сентябрь 1972 г.). «Эффекты, продолжительность действия и метаболизм у человека». В Тауск М (ред.). Фармакология эндокринной системы и родственные препараты: прогестерон, препараты для прогестации и противозачаточные средства. II. Pergamon Press. С. 13–24. ISBN 978-0080168128. OCLC 278011135.
- ^ Хенцл М.Р., Эдвардс Дж. А. (10 ноября 1999 г.). «Фармакология прогестинов: производные 17α-гидроксипрогестерона и прогестины первого и второго поколения». В Sitruk-Ware R, Mishell DR (ред.). Прогестины и антипрогестины в клинической практике. Тейлор и Фрэнсис. С. 101–132. ISBN 978-0-8247-8291-7.
- ^ Джанет Браттон (1976). Фармакология половых гормонов. Академическая пресса. п. 114. ISBN 978-0-12-137250-7.
- ^ а б c d Пел GW (апрель 1994). «Фармакодинамические эффекты вводимых один раз в месяц комбинированных инъекционных контрацептивов». Контрацепция. 49 (4): 361–85. Дои:10.1016/0010-7824(94)90033-7. PMID 8013220. Ошибка цитирования: указанная ссылка «pmid8013220» была определена несколько раз с разным содержанием (см. страница помощи).
- ^ Toppozada MK (апрель 1994). «Существующие раз в месяц комбинированные инъекционные контрацептивы». Контрацепция. 49 (4): 293–301. Дои:10.1016/0010-7824(94)90029-9. PMID 8013216.
- ^ а б c Goebelsmann U (1986). «Фармакокинетика противозачаточных стероидов у людей». В Gregoire AT, Blye RP (ред.). Противозачаточные стероиды: фармакология и безопасность. Springer Science & Business Media. С. 67–111. Дои:10.1007/978-1-4613-2241-2_4. ISBN 978-1-4613-2241-2. Ошибка цитирования: именованная ссылка "Goebelsmann1986" была определена несколько раз с разным содержанием (см. страница помощи).
- ^ Беккер H, Дюстерберг B, Клостерхалфен H (1980). «[Биодоступность ацетата ципротерона после перорального и внутримышечного применения у мужчин (авторский перевод)]» [Биодоступность ацетата ципротерона после перорального и внутримышечного применения у мужчин]. Urologia Internationalis. 35 (6): 381–5. Дои:10.1159/000280353. PMID 6452729.
- ^ Мольц Л., Хаазе Ф., Шварц Ю., Хаммерштейн Дж. (Май 1983 г.). «[Лечение вирилизованных женщин с внутримышечным введением ципротерона ацетата]» [Эффективность внутримышечно применяемого ципротерона ацетата при гиперандрогении]. Geburtshilfe Und Frauenheilkunde. 43 (5): 281–7. Дои:10.1055 / с-2008-1036893. PMID 6223851.
- ^ Райт Дж. К., Берджесс диджей (29 января 2012 г.). Инъекции и имплантаты длительного действия. Springer Science & Business Media. С. 114–. ISBN 978-1-4614-0554-2.
-
^ Чу Й.Х., Ли Ц., Чжао Ц.Ф. (апрель 1986 г.). «Фармакокинетика мегестрола ацетата у женщин, получающих внутримышечно инъекционный контрацептив эстрадиол-мегестрола длительного действия». Китайский журнал клинической фармакологии.
Результаты показали, что после инъекции концентрация МА в плазме быстро увеличивалась. Среднее время пикового уровня MA в плазме составляло 3-й день, наблюдалась линейная зависимость между логарифмом концентрации MA в плазме и временем (днем) после введения у всех субъектов, период полувыведения фазы элиминации t1 / 2β = 14,35 ± 9,1 дня.
- ^ Раннебаум BC, Рабе Т., Кизель Л. (6 декабря 2012 г.). Женская контрацепция: новости и тенденции. Springer Science & Business Media. С. 429–. ISBN 978-3-642-73790-9.
- ^ Артини П.Г., Генаццани А.Р., Петралья Ф. (11 декабря 2001 г.). Достижения в гинекологической эндокринологии. CRC Press. С. 105–. ISBN 978-1-84214-071-0.
- ^ Кинг Т.Л., Брукер М.С., Крибс Дж. М., Фэхи Дж. О. (21 октября 2013 г.). Акушерство Варни. Издательство "Джонс и Бартлетт". С. 495–. ISBN 978-1-284-02542-2.
- ^ а б c Пулен Р., Бейкер Д., Пуарье Д., Лабри Ф. (март 1989 г.). «Опосредованное андрогеном и глюкокортикоидным рецептором ингибирование пролиферации клеток медроксипрогестерона ацетатом в клетках рака молочной железы человека ZR-75-1». Исследования и лечение рака груди. 13 (2): 161–72. Дои:10.1007 / bf01806528. PMID 2525057. S2CID 26116247.
- ^ Брэди Б.М., Андерсон Р.А., Киннибург Д., Бэрд Д.Т. (апрель 2003 г.). «Демонстрация опосредованного рецептором прогестерона подавления гонадотропина у мужчин». Клиническая эндокринология. 58 (4): 506–12. Дои:10.1046 / j.1365-2265.2003.01751.x. PMID 12641635. S2CID 12567639.
- ^ Салех FM, Грудзинскас А.Дж., Брэдфорд Дж.М. (11 февраля 2009 г.). Преступники на сексуальной почве: выявление, оценка рисков, лечение и правовые вопросы. Издательство Оксфордского университета. п. 44. ISBN 978-0-19-517704-6. В архиве из оригинала 17 июня 2014 г.
- ^ Всемирная организация здоровья (2009). Стюарт М.С., Куимци М., Хилл С.Р. (ред.). Типовой формуляр ВОЗ 2008 г.. Всемирная организация здоровья. п. 368. HDL:10665/44053. ISBN 9789241547659.
- ^ а б c Лотштейн, Лесли М. (1996). «Антиандрогенное лечение сексуальных расстройств: Руководство по установлению стандартов лечения». Сексуальная зависимость и компульсивность. 3 (4): 313–331. Дои:10.1080/10720169608400122. ISSN 1072-0162.
- ^ а б Опасные сексуальные преступники: отчет рабочей группы Американской психиатрической ассоциации. Американский психиатрический паб. 1999. С. 112–144. ISBN 978-0-89042-280-9.
- ^ Кравиц Х.М., Хейвуд Т.В., Келли Дж., Лайлс С., Кавано Дж. Л. (1996). «Медроксипрогестерон и парафилы: имеет ли значение уровень тестостерона?». Закон о психиатрии Bull Am Acad. 24 (1): 73–83. PMID 8891323.
- ^ Новак Э., Хендрикс Дж. У., Чен Т. Т., Секман К. Э., Ройер Г. Л., Почи П. Е. (октябрь 1980 г.). «Производство кожного сала и уровни тестостерона в плазме у человека после лечения высокими дозами медроксипрогестерона ацетата и введения андрогенов». Акта Эндокринол. 95 (2): 265–70. Дои:10.1530 / acta.0.0950265. PMID 6449127.
- ^ Киршнер М.А., Шнайдер Г. (февраль 1972 г.). «Подавление оси клеток гипофиза-Лейдига и выработки кожного сала у нормальных мужчин медроксипрогестерона ацетатом (провера)». Акта Эндокринол. 69 (2): 385–93. Дои:10.1530 / acta.0.0690385. PMID 5066846.
- ^ Ашеман Х., Гурен Л.Дж. (1993). «Гормональное лечение транссексуалов». Журнал психологии и сексуальности человека. 5 (4): 39–54. Дои:10.1300 / J056v05n04_03. ISSN 0890-7064.
- ^ Meriggiola MC, Gava G (ноябрь 2015 г.). «Эндокринная помощь трансгендерным людям, часть II. Обзор гормонального лечения кросс-пола, исходы и побочные эффекты у трансженщин». Clin. Эндокринол. (Oxf). 83 (5): 607–15. Дои:10.1111 / с.12754. PMID 25692882. S2CID 39706760.
- ^ Гурен Л.Дж., Гилтай Э.Дж., Банк М.С. (январь 2008 г.). «Длительное лечение транссексуалов гормонами противоположного пола: большой личный опыт». J. Clin. Эндокринол. Метаб. 93 (1): 19–25. Дои:10.1210 / jc.2007-1809. PMID 17986639.
- ^ Deutsch M (17 июня 2016 г.). «Рекомендации по первичной и гендерно-подтверждающей помощи трансгендерам и гендерно небинарным людям» (PDF) (2-е изд.). Калифорнийский университет в Сан-Франциско: Центр передового опыта в области здоровья трансгендеров. п. 28.
- ^ Даль М., Фельдман Дж. Л., Голдберг Дж., Джабери А. (2015). «Эндокринная терапия для взрослых трансгендеров в Британской Колумбии: рекомендуемые рекомендации» (PDF). Прибрежное здоровье Ванкувера. Получено 15 августа 2018.
- ^ Leinung MC, Feustel PJ, Joseph J (2018). «Гормональное лечение трансгендерных женщин пероральным эстрадиолом». Transgend Health. 3 (1): 74–81. Дои:10.1089 / trgh.2017.0035. ЧВК 5944393. PMID 29756046.
- ^ Мейер, Уолтер Дж .; Уокер, Пол А .; Эмори, Ли Э .; Смит, Эдвард Р. (1985). «Физические, метаболические и гормональные эффекты при длительной терапии медроксипрогестерона ацетатом на мужчин». Фертильность и бесплодие. 43 (1): 102–109. Дои:10.1016 / S0015-0282 (16) 48326-3. ISSN 0015-0282. PMID 3155506.
- ^ Биррелл С.Н., Холл RE, Тилли В.Д. (январь 1998 г.). «Роль рецептора андрогена в раке груди человека». Журнал биологии и неоплазии молочных желез. 3 (1): 95–103. Дои:10.1023 / А: 1018730519839. PMID 10819508. S2CID 12044431.
- ^ Бьюкенен Дж., Биррелл С. Н., Питерс А. А., Бьянко-Миотто Т., Рамзи К., Копы Е. Джей, Ян М., Харрис Дж. М., Симила Х.А., Мур Н. Л., Бентел Дж. М., Риччиарделли С., Хорсфолл Д. Д., Батлер Л. М., Тилли В. Д. (сентябрь 2005 г.) . «Сниженные уровни рецепторов андрогенов и функция рецепторов при раке груди способствуют нарушению ответа на медроксипрогестерона ацетат». Исследования рака. 65 (18): 8487–96. Дои:10.1158 / 0008-5472.CAN-04-3077. PMID 16166329.
- ^ Рис М.С., Надежда С., Равникар В. (12 августа 2005 г.). Аномальный менструальный цикл. Тейлор и Фрэнсис. п. 213. ISBN 978-1-84214-212-7. В архиве с оригинала 31 декабря 2013 г.
- ^ Аронсон, JK (20 января 2009 г.). Побочные эффекты Мейлера эндокринных и метаболических препаратов. Эльзевир. п. 283. ISBN 978-0-444-53271-8. В архиве с оригинала 31 декабря 2013 г.
- ^ Эттингер Б., Голдитч И.М. (декабрь 1977 г.). «Медроксипрогестерона ацетат для оценки гипертестостеронизма у женщин с волосяным покровом». Фертильность и бесплодие. 28 (12): 1285–8. Дои:10.1016 / S0015-0282 (16) 42970-5. PMID 590535.
- ^ Корреа де Оливейра РФ, Новаес Л.П., Лима МБ, Родригес Дж., Франко С., Хенаифес А.И., Франкаланчи С.П. (декабрь 1975 г.). «Новое средство от гирсутизма». Анналы внутренней медицины. 83 (6): 817–9. Дои:10.7326/0003-4819-83-6-817. PMID 1200527.
- ^ Ричман Р. А., Андервуд Л. Е., Французский Ф. С., Ван Вик Дж. Дж. (Декабрь 1971 г.). «Побочные эффекты больших доз медроксипрогестерона (MPA) при идиопатической изосексуальной преждевременности». Журнал педиатрии. 79 (6): 963–71. Дои:10.1016 / s0022-3476 (71) 80191-9. PMID 4332067.
- ^ а б Лучано, А. А. (1992). «Эндометриоз - роль медроксипрогестерона ацетата». Журнал акушерства и гинекологии. 12 (sup2): S38 – S44. Дои:10.3109/01443619209045611. ISSN 0144-3615.
- ^ а б Нахтигалл Л.Е., Раджу У., Банерджи С., Ван Л., Левиц М. (2000). «Профили связывания эстрадиола в сыворотке крови у женщин в постменопаузе, проходящих три распространенных заместительной терапии эстрогенами: ассоциации с уровнями глобулина, связывающего половые гормоны, эстрадиола и эстрона». Менопауза. 7 (4): 243–50. Дои:10.1097/00042192-200007040-00006. PMID 10914617. S2CID 3076514.
- ^ Lundgren S, Lønning PE, Utaaker E, Aakvaag A, Kvinnsland S (июнь 1990 г.). «Влияние прогестинов на уровни гормонов сыворотки у женщин в постменопаузе с распространенным раком груди - I. Общие выводы». J Стероид Биохим. 36 (1–2): 99–104. Дои:10.1016 / 0022-4731 (90) 90118-в. PMID 2362454.
- ^ Lundgren S, Lønning PE (июнь 1990 г.). «Влияние прогестинов на уровни гормонов сыворотки у женщин в постменопаузе с распространенным раком груди - II. Дифференциальный эффект ацетата мегестрола и ацетата медроксипрогестерона на сульфат эстрона в сыворотке и глобулин, связывающий половые гормоны». J Стероид Биохим. 36 (1–2): 105–9. Дои:10.1016 / 0022-4731 (90) 90119-д. PMID 2141886.
- ^ Меррин П.К., Александр В.Д. (август 1990 г.). «Синдром Кушинга, вызванный медроксипрогестероном». BMJ. 301 (6747): 345. Дои:10.1136 / bmj.301.6747.345-а. ЧВК 1663616. PMID 2144198.
- ^ Системные эффекты пероральных глюкокортикоидов, в архиве из оригинала 28.01.2014
- ^ Исида Ю., Исида Ю., Хеерш Дж. Н. (август 2002 г.). «Фармакологические дозы медроксипрогестерона могут вызвать потерю костной массы из-за активности глюкокортикоидов: гипотеза». Остеопорос Инт. 13 (8): 601–5. Дои:10.1007 / s001980200080. PMID 12181616. S2CID 23343761.
- ^ а б c Sunde A, Rosness PA, Eik-Nes KB (август 1982 г.). «Эффекты in vitro медроксипрогестерона ацетата на ферменты метаболизма стероидов у крыс: селективное ингибирование активности 3 альфа-гидроксистероид оксидоредуктазы». Журнал стероидной биохимии. 17 (2): 197–203. Дои:10.1016/0022-4731(82)90122-4. PMID 6213817.
- ^ а б c Penning TM, Sharp RB, Krieger NR (декабрь 1985 г.). «Очистка и свойства 3 альфа-гидроксистероид дегидрогеназы из цитозоля мозга крысы. Ингибирование нестероидными противовоспалительными препаратами и прогестинами». Журнал биологической химии. 260 (28): 15266–72. PMID 2933398.
- ^ Пазол К., Уилсон М.Э., Валлен К. (июнь 2004 г.). «Медроксипрогестерона ацетат противодействует влиянию лечения эстрогенами на социальное и сексуальное поведение самок макак». Журнал клинической эндокринологии и метаболизма. 89 (6): 2998–3006. Дои:10.1210 / jc.2003-032086. ЧВК 1440328. PMID 15181090.
- ^ Мейер Л., Венард С., Шеффер В., Патте-Менса С., Менса-Няган АГ (апрель 2008 г.). «Биологическая активность 3-альфа-гидроксистероидной оксидоредуктазы в спинном мозге регулирует термические и механические болевые пороги после повреждения седалищного нерва». Нейробиология болезней. 30 (1): 30–41. Дои:10.1016 / j.nbd.2007.12.001. PMID 18291663. S2CID 5830825.
- ^ а б Меллон Ш., Гриффин Л. Д. (2002). «Нейростероиды: биохимия и клиническое значение». Тенденции в эндокринологии и метаболизме. 13 (1): 35–43. Дои:10.1016 / с1043-2760 (01) 00503-3. PMID 11750861. S2CID 11605131.
- ^ а б c d е Ли Т.К., Миллер В.Л., Аухус Р.Дж. (июнь 1999 г.). «Медроксипрогестерона ацетат и дексаметазон являются конкурентными ингибиторами различных стероидогенных ферментов человека». Журнал клинической эндокринологии и метаболизма. 84 (6): 2104–10. Дои:10.1210 / jcem.84.6.5646. PMID 10372718.
- ^ а б Söderpalm AH, Lindsey S, Purdy RH, Hauger R, Wit de H (апрель 2004 г.). «Введение прогестерона вызывает у мужчин и женщин легкое седативное действие». Психонейроэндокринология. 29 (3): 339–54. Дои:10.1016 / s0306-4530 (03) 00033-7. PMID 14644065. S2CID 21796848.
- ^ а б c d е ж грамм час Маколи Дж. В., Кробот П. Д., Жесткий Д. Д., Рейнольдс И. Дж. (Май 1993 г.). «Модуляция связывания [3H] флунитразепама природными и синтетическими прогестагенными агентами». Фармакология, биохимия и поведение. 45 (1): 77–83. Дои:10.1016 / 0091-3057 (93) 90089-с. PMID 8516376. S2CID 42764270.
- ^ Вайцман А. (1 февраля 2008 г.). Нейроактивные стероиды в функции мозга, поведении и нервно-психических расстройствах: новые стратегии исследований и лечения. Springer Science & Business Media. С. 104, 107, 112. ISBN 978-1-4020-6854-6.
-
^ Хофбауэр К.Г., Анкер С.Д., Инуи А., Николсон-младший (22 декабря 2005 г.). Фармакотерапия кахексии. CRC Press. С. 292–. ISBN 978-1-4200-4895-7.
Аналогичным образом было показано, что медроксипрогестерон [ацетат] увеличивает аппетит и потребление пищи со стабилизацией массы тела в дозе 1000 мг (500 мг дважды в день) .13 Хотя препарат можно использовать в дозе от 500 до 4000 мг в день, побочные эффекты усиливаются. пероральные дозы 1000 мг в день.16
- ^ Дойл Д., Хэнкс Г., Черный Н. И. (3 февраля 2005 г.). Оксфордский учебник паллиативной медицины. Издательство Оксфордского университета. п. 553. ISBN 978-0-19-856698-4. В архиве из оригинала 18 июня 2013 г.
- ^ а б Neubauer H, Ma Q, Zhou J, Yu Q, Ruan X, Seeger H, Fehm T., Mueck AO (октябрь 2013 г.). «Возможная роль PGRMC1 в развитии рака груди». Климактерический. 16 (5): 509–13. Дои:10.3109/13697137.2013.800038. PMID 23758160. S2CID 29808177.
- ^ Траберт Б., Шерман М.Э., Каннан Н., Станчик Ф.З. (сентябрь 2019 г.). «Прогестерон и рак груди». Endocr. Rev. 41 (2): 320–344. Дои:10.1210 / endrev / bnz001. ЧВК 7156851. PMID 31512725.
- ^ а б c d е ж Станчик, Франк З .; Бхавнани, Бхагу Р. (2014). «Использование ацетата медроксипрогестерона для гормональной терапии у женщин в постменопаузе: это безопасно?». Журнал стероидной биохимии и молекулярной биологии. 142: 30–38. Дои:10.1016 / j.jsbmb.2013.11.011. ISSN 0960-0760. PMID 24291402. S2CID 22731802.
- ^ а б Виктор, Арне; Йоханссон, Элоф Д. (1976). «Фармакокинетические наблюдения ацетата медроксипрогестерона, вводимого перорально и интравагинально». Контрацепция. 14 (3): 319–329. Дои:10.1016/0010-7824(76)90099-8. ISSN 0010-7824. PMID 975821.
- ^ а б Hiroi, M .; Stanczyk, F.Z .; Goebelsmann, U .; Brenner, P.F .; Лумкин, М.Е .; Мишелл, Д. (1975). «Радиоиммуноанализ сывороточного медроксипрогестерона ацетата (Провера) у женщин после перорального и интравагинального введения». Стероиды. 26 (3): 373–386. Дои:10.1016 / 0039-128X (75) 90082-3. ISSN 0039-128X. PMID 1198624. S2CID 24777672.
- ^ Svensson, L.-O .; Джонсон, С. Хедман; Ольссон, С.-Э. (1994). «Концентрации медроксипрогестерона ацетата, эстрадиола и эстрона в плазме после перорального приема Климаксила, Трисеквенс / Провера и Дивина. Рандомизированное, одинарное слепое, тройное перекрестное исследование биодоступности у женщин в менопаузе». Maturitas. 18 (3): 229–238. Дои:10.1016/0378-5122(94)90129-5. ISSN 0378-5122. PMID 8015506.
- ^ а б c d е Ярвинен, Аско; Кайнулайнен, Петри; Ниссила, Минна; Никканен, Ханна; Кела, Марджо (2004). «Фармакокинетика эстрадиола валерата и медроксипрогестерона ацетата в разных возрастных группах женщин в постменопаузе». Maturitas. 47 (3): 209–217. Дои:10.1016 / j.maturitas.2003.01.001. ISSN 0378-5122. PMID 15036491.
-
^ «Медроксипрогестерона ацетат - Краткое описание лекарственного средства». Цифровой справочник лиц, назначающих лекарства (PDR). ConnectiveRx. Архивировано из оригинал на 2018-10-07. Получено 2019-06-17.
При необходимости таблетки можно вводить сублингвально †; абсорбция адекватна этим путем.
-
^ Саттон, Фрэнк Д. (1975). «Прогестерон для амбулаторного лечения синдрома Пиквика». Анналы внутренней медицины. 83 (4): 476–9. Дои:10.7326/0003-4819-83-4-476. ISSN 0003-4819. PMID 1101759.
Сублингвальный путь был выбран, чтобы избежать нерегулярного всасывания, которое может возникнуть в результате одновременного приема пищи.
- ^ Джайн Дж, Кван Д., Форсьер М. (апрель 2019 г.). «Медроксипрогестерона ацетат в гендерно-подтверждающей терапии для трансженщин: результаты ретроспективного исследования». Журнал клинической эндокринологии и метаболизма. 104 (11): 5148–5156. Дои:10.1210 / jc.2018-02253. ISSN 0021-972X. PMID 31127826.
- ^ ван Хогдалем Э.Дж., де Бур А.Г., Бреймер Д.Д. (август 1991 г.). «Фармакокинетика ректального введения лекарств. Часть II. Клиническое применение лекарств периферического действия и выводы». Клин Фармакокинет. 21 (2): 110–28. Дои:10.2165/00003088-199121020-00003. PMID 1884566. S2CID 11720029.
- ^ а б c d е ж Мишель Д.Р. (май 1996 г.). «Фармакокинетика противозачаточного средства депо медроксипрогестерона ацетата». Журнал репродуктивной медицины. 41 (5 Дополнение): 381–90. PMID 8725700.
- ^ а б c Гарза-Флорес Дж., Холл ЧП, Перес-Паласиос Дж. (1991). «Гормональные противозачаточные средства длительного действия для женщин». J. Steroid Biochem. Мол. Биол. 40 (4–6): 697–704. Дои:10.1016 / 0960-0760 (91) 90293-э. PMID 1958567. S2CID 26021562.
- ^ а б c Габельник, Генри Л .; Холл, Питер Э. (1987). «Долговременные методы регулирования фертильности». Журнал контролируемого выпуска. 6 (1): 387–394. Дои:10.1016/0168-3659(87)90092-7. ISSN 0168-3659.
- ^ Antal, E; Дик, C; Wrightiii, C; Валлийский, I; Блок, Е. (1989). «Сравнительная биодоступность двух суспензий ацетата медроксипрогестерона». Международный журнал фармацевтики. 54 (1): 33–39. Дои:10.1016/0378-5173(89)90162-2. ISSN 0378-5173.
- ^ Исихара М., Кирдани Ю., Осава Ю., Сандберг А.А. (январь 1976 г.). «Метаболическая судьба ацетата медроксипрогестерона у бабуина». Журнал стероидной биохимии. 7 (1): 65–70. Дои:10.1016/0022-4731(76)90167-9. PMID 1271819.
- ^ а б ДеВита В.Т., Лоуренс Т.С., Розенберг С.А. (7 января 2015 г.). Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии. Wolters Kluwer Health. С. 1149–. ISBN 978-1-4698-9455-3.
- ^ Ярвинен, Аско; Кайнулайнен, Петри; Ниссила, Минна; Никканен, Ханна; Кела, Марджо (2004). «Фармакокинетика эстрадиола валерата и медроксипрогестерона ацетата в разных возрастных группах женщин в постменопаузе». Maturitas. 47 (3): 209–217. Дои:10.1016 / j.maturitas.2003.01.001. ISSN 0378-5122. PMID 15036491.
- ^ Ортис А., Хироль М., Станчик Ф.З., Гебельсманн У., Мишель Д.Р. (январь 1977 г.). «Концентрации медроксипрогестерона ацетата (MPA) в сыворотке и функция яичников после внутримышечной инъекции депо-MPA». J. Clin. Эндокринол. Метаб. 44 (1): 32–8. Дои:10.1210 / jcem-44-1-32. PMID 833262.
- ^ Fotherby K, Koetsawang S, Mathrubutham M (ноябрь 1980 г.). «Фармакокинетическое исследование различных доз Депо Провера». Контрацепция. 22 (5): 527–36. Дои:10.1016/0010-7824(80)90105-5. PMID 6451351.
- ^ а б c d е ж Elks J (14 ноября 2014 г.). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Springer. п. 657. ISBN 978-1-4757-2085-3. В архиве из оригинала от 5 ноября 2017 года.
- ^ Адемуива Ф.О., Миллер К.Д. (декабрь 2008 г.). «Включение антиангиогенной терапии в лечение метастатического рака груди». Clin. Рак молочной железы. 8 Дополнение 4: S151–6. Дои:10.3816 / CBC.2008.s.011. PMID 19158035.
- ^ https://adisinsight.springer.com/drugs/800011224
- ^ FR 1295307, "Procédé de preparation de dérivés cyclopentano-phénanthréniques", опубликовано 8 июня 1962 г., передано Syntex SA
- ^ США предоставили 3377364, Spero G, «6-метил-17альфа-гидроксипрогестерон, 17-ацилаты низших жирных кислот и способы их получения», опубликовано 1968-04-09, переуступлено Upjohn Company.
-
^ Грин W (1987). «Одиссея Депо-Провера: противозачаточные средства, канцерогенные препараты и анализ управления рисками». Файл. Food Drug Cosm. LJ. Чикаго (42): 567–587.
Депо-Провера - это лекарство, производимое компанией The Upjohn Co., активным ингредиентом которого является ацетат медроксипрогестерона (MPA). FDA впервые одобрило этот препарат в 1959 году для лечения аменореи, 5 нерегулярных маточных кровотечений, а также угрожающих и привычных абортов.
- ^ Хартманн К.Э., Джером Р.Н., Линдегрен М.Л., Поттер С.А., Шилдс Т.С., Суравич Т.С., Эндрюс Дж.С. (2013). Первичная терапия аномального маточного кровотечения. PMID 23617013.
- ^ Гелийнс А. (1991). Инновации в клинической практике: динамика развития медицинских технологий. Национальные академии. С. 167–. НАП: 13513.
- ^ Издательство William Andrew (22 октября 2013 г.). Энциклопедия фармацевтического производства. Эльзевир. С. 1501–. ISBN 978-0-8155-1856-3.
- ^ Кольбе HK (1976). Тезаурус по вопросам народонаселения / контроля рождаемости (PDF). Программа демографической информации, Отдел научных коммуникаций, Департамент медицины и связей с общественностью, Университет Джорджа Вашингтона. В архиве (PDF) из оригинала от 09.10.2016.
-
^ Боливар Де Ли Дж (1966). ... Ежегодник акушерства и гинекологии. Издатели ежегодников. п. 339.
Одним из них является ацетат медроксипрогестерона, который продается в Соединенных Штатах компанией Upjohn как Provest и доступен за границей как Provestral, Provestrol, Cyclo-Farlutal и более откровенно наводящий на размышления Nogest.
- ^ Финкельштейн М (1966). Исследования стероидов. Пергамон. С. 469, 542.
- ^ Кристофер Ли (11 ноября 2009 г.). Эпидемиология рака груди. Springer Science & Business Media. С. 110–. ISBN 978-1-4419-0685-4.
- ^ а б c Левитт Д.И. (30 апреля 2015 г.). Чернокожие женщины и международное право: сознательные взаимодействия, движения и действия. Издательство Кембриджского университета. С. 230–231. ISBN 978-1-316-29840-4.
-
^ а б Документация по проблемам женщин. Центр библиотеки и документации Всеиндийской ассоциации христианского высшего образования. Январь 1998 г.
Между тем Upjohn неоднократно добивался одобрения FDA для использования DMPA в качестве противозачаточного средства, но заявки были отклонены в 1967, 1978 и еще раз в 1983, [...]
- ^ Shoupe D, Mishell DR (28 сентября 2015 г.). Справочник по контрацепции: руководство по практическому ведению. Humana Press. С. 126–. ISBN 978-3-319-20185-6.
- ^ Morton I, Hall JM (31 октября 1999 г.). Краткий словарь фармакологических агентов: свойства и синонимы. Springer Science & Business Media. С. 173–. ISBN 978-0-7514-0499-9.
- ^ Законодательное собрание штата Луизиана. «§43.6. Назначение медроксипрогестерона ацетата (МПА) некоторым лицам, совершившим сексуальные преступления». Пересмотренный Устав Луизианы. Получено 8 июля 2019.
- ^ а б Unzeitig V, van Lunsen RH (15 февраля 2000 г.). Выбор контрацепции и реальность: Материалы 5-го Конгресса Европейского общества контрацепции. CRC Press. С. 73–. ISBN 978-1-85070-067-8.
- ^ а б Рабочая группа МАИР по оценке канцерогенных рисков для человека; Всемирная организация здоровья; Международное агентство по изучению рака (2007 г.). Комбинированные эстроген-прогестагенные контрацептивы и комбинированная эстроген-прогестагеновая терапия менопаузы. Всемирная организация здоровья. п. 44. ISBN 978-92-832-1291-1.
- ^ Джон Дэвид Гордон (2007). Акушерство, гинекология и бесплодие: руководство для врачей. Scrub Hill Press, Inc., стр. 228–. ISBN 978-0-9645467-7-6.
- ^ «Противозачаточные средства. Дело для общественного расследования». Экономический и политический еженедельник. 29 (15): 825–6. 1994. Номер документа базы данных Popline 096527.
- ^ Сороджини, Н.Б. (январь – март 2005 г.). «Почему женские группы выступают против инъекционных контрацептивов». Индийский журнал медицинской этики. 13 (1). Архивировано из оригинал (– Академический поиск) 6 мая 2006 г.
- ^ «Справочное руководство по инъекционным противозачаточным средствам (MPA)» (PDF). nhm.gov.in. Получено 26 февраля 2020.
- ^ Мэдлин Боско (6 декабря 1991 г.). "Письмо Канадской коалиции Депо-Провера достопочтенному Бенуа Бушару, национальному министру здравоохранения и социального обеспечения". Канадская сеть женского здоровья. Архивировано из оригинал 5 февраля 2007 г.. Получено 2006-08-22.
- ^ "Групповой иск подан в отношении противозачаточного препарата". CTV.ca. 19 декабря 2005 г. В архиве с оригинала 13 августа 2006 г.. Получено 2006-08-22.
- ^ "«Архивная копия». В архиве из оригинала от 20.06.2015. Получено 2015-06-20.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Лири В.Е. (октябрь 1992 г.). «США одобряют инъекционные наркотики в качестве противозачаточных средств». The New York Times в Интернете: A1, A14. PMID 11646958. В архиве из оригинала 2008-12-08.
- ^ "Прогестины (Резюме и оценка МАИР, Приложение 7, 1987)". В архиве из оригинала 7 ноября 2017 г.. Получено 15 октября 2016.
- ^ Эми Гудман (февраль – март 1985 г.). «Дело против Depo-Provera - проблемы в США». Многонациональный монитор. 6 (2 & 3). В архиве из оригинала от 03.10.2006.
- ^ «Споры по поводу Депо-Провера». Письмо Вашингтона о наркотиках и устройствах. 9 (1): 2 января 1977 г. PMID 12335988.
- ^ Томас ДБ, Йе-Зи, Рэй Р.М. (январь 1995 г.). «Карцинома шейки матки in situ и использование депо-медроксипрогестерона ацетата (DMPA). Совместное исследование ВОЗ неоплазии и стероидных контрацептивов». Контрацепция. 51 (1): 25–31. Дои:10.1016 / 0010-7824 (94) 00007-J. PMID 7750280.
- ^ «Депо-медроксипрогестерона ацетат (DMPA) и риск инвазивного плоскоклеточного рака шейки матки. Совместное исследование ВОЗ по неоплазии и стероидным контрацептивам». Контрацепция. 45 (4): 299–312. Апрель 1992 г. Дои:10.1016 / 0010-7824 (92) 90052-У. PMID 1387601.
- ^ Томас Д. Б., Рэй Р. М. (ноябрь 1995 г.). «Депо-медроксипрогестерона ацетат (DMPA) и риск инвазивных аденокарцином и аденосквамозных карцином шейки матки. Совместное исследование ВОЗ по неоплазии и стероидным контрацептивам». Контрацепция. 52 (5): 307–12. Дои:10.1016 / 0010-7824 (95) 00215-В. PMID 8585888.
- ^ Шапиро С., Розенберг Л., Хоффман М., Келли Дж. П., Купер Д. Д., Каррара Г., Денни Л. Е., дю Туа Дж., Аллан Б. Р., Стандер И. А., Уильямсон А. Л. (июнь 2003 г.). «Риск инвазивного рака шейки матки в связи с использованием инъекционных прогестагенных контрацептивов и комбинированных эстроген / прогестагенных оральных контрацептивов (Южная Африка)». Причины рака и борьба с ними. 14 (5): 485–95. Дои:10.1023 / А: 1024910808307. PMID 12946044. S2CID 34683749.
- ^ Кауниц А.М. (май 1996 г.). «Противозачаточные средства депо медроксипрогестерона ацетата и риск рака груди и гинекологического рака». Журнал репродуктивной медицины. 41 (5 Дополнение): 419–27. PMID 8725705.
- ^ а б c Хокинс К., Эллиотт Дж. (5 мая 1996 г.). «Ищу одобрения». Монитор Альбиона. Архивировано из оригинал 21 ноября 2015 г.. Получено 20 ноября 2006.
- ^ «Стерилизация несовершеннолетних вызывает споры». Репортер по планированию семьи / народонаселению; Обзор государственных законов и политики. 2 (4): 77–8. Август 1973 г. PMID 12257656.
- ^ Иган Т.М., Зигерт Р.Дж., Фэрли Н.А. (август 1993 г.). «Использование гормональных контрацептивов в учреждениях: причины использования, согласие и безопасность у женщин с психическими и умственными недостатками». Медицинский журнал Новой Зеландии. 106 (961): 338–41. PMID 8341476.
- ^ Сингх С. (май 1995 г.). «Подростковые знания и использование инъекционных контрацептивов в развивающихся странах». Журнал здоровья подростков. 16 (5): 396–404. Дои:10.1016 / S1054-139X (94) 00060-R. PMID 7662691.
- ^ «Клиницисты конфликтуют с группами потребителей из-за возможного запрета Depo». Обновление противозачаточных технологий. 16 (1): 11–4. Январь 1995 г. PMID 12319319.
- ^ Toppozada M (июнь 1977 г.). «Клиническое применение ежемесячных инъекционных противозачаточных препаратов». Акушерское гинекологическое обследование. 32 (6): 335–47. Дои:10.1097/00006254-197706000-00001. PMID 865726.
- ^ Джозеф Уильям Голдзихер; Кеннет Фотерби (1994). Фармакология противозачаточных стероидов. Raven Press. п. 154. ISBN 978-0-7817-0097-9.
- ^ Zañartu J, Rice-Wray E, Goldzieher JW (октябрь 1966 г.). «Контроль фертильности с помощью инъекционных стероидов длительного действия. Предварительный отчет». Акушер Гинеколь. 28 (4): 513–5. Дои:10.1097/00006250-196610000-00011 (неактивно 01.11.2020). PMID 5925038.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Гарри Бекман (1967). Ежегодник лекарственной терапии. Издатели ежегодников.
- ^ Пиотровски Z, Гринберг RE (2016). «Антиандрогенная монотерапия в лечении рака простаты». Рак простаты. С. 515–521. Дои:10.1016 / B978-0-12-800077-9.00055-4. ISBN 9780128000779.
- ^ Форстер TH, Stoffel F, Gasser TC (2002). «Гормональная терапия при распространенном раке простаты». Передний Radiat Ther Oncol. Границы лучевой терапии и онкологии. 36: 49–65. Дои:10.1159/000061329. ISBN 3-8055-7217-4. PMID 11842755.
- ^ Ньюлинг Д.В. (март 1997 г.). «Паллиативная терапия распространенного рака простаты с особым упором на результаты недавних европейских клинических испытаний». Br J Urol. 79 Дополнение 1: 72–81. Дои:10.1111 / j.1464-410X.1997.tb00805.x. PMID 9088277.
- ^ Денис Л.Дж., Гриффитс К., Кайсари А.В., Мерфи Г.П. (1 марта 1999 г.). Учебник рака простаты: патология, диагностика и лечение: патология, диагностика и лечение. CRC Press. С. 296–. ISBN 978-1-85317-422-3.
- ^ а б Нишлаг Э (2010). «Клинические испытания мужской гормональной контрацепции» (PDF). Контрацепция. 82 (5): 457–70. Дои:10.1016 / j.contraception.2010.03.020. PMID 20933120.
- ^ а б c https://adisinsight.springer.com/drugs/800008646
- ^ а б Сринивасан Р., Лихтенштейн Г.Р. (апрель 2004 г.). «Последние разработки в фармакологическом лечении болезни Крона». Мнение эксперта по исследованию наркотиков. 13 (4): 373–91. Дои:10.1517/13543784.13.4.373. PMID 15102587. S2CID 22533823.
- ^ Саксена, Ашвини; Скаини, Гизелли; Bavaresco, Daniela V .; Лейте, Камила; Valvassoria, Samira S .; Карвалью, Андре Ф .; Кеведо, Жоао (2017). «Роль протеинкиназы C в биполярном расстройстве: обзор современной литературы». Молекулярная нейропсихиатрия. 3 (2): 108–124. Дои:10.1159/000480349. ISSN 2296-9209. ЧВК 5701269. PMID 29230399.
- ^ а б c Симпсон Б.С., Папич М.Г. (март 2003 г.). «Фармакологический менеджмент в ветеринарной поведенческой медицине». Вет. Clin. North Am. Маленький Аним. Практика. 33 (2): 365–404, vii. Дои:10.1016 / S0195-5616 (02) 00130-4. PMID 12701517.
внешняя ссылка
- «Медроксипрогестерона ацетат». Портал информации о наркотиках. Национальная медицинская библиотека США.




