Триметилфосфин - Trimethylphosphine
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Триметилфосфан | |
| Систематическое название ИЮПАК | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 969138 | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.008.932 |
| Номер ЕС |
|
| MeSH | триметил + фосфин |
PubChem CID | |
| Номер ООН | 1993 |
| |
| |
| Характеристики | |
| C3ЧАС9п | |
| Молярная масса | 76.079 г · моль−1 |
| Внешность | Бесцветная жидкость |
| Плотность | 735 мг · см−3 |
| Температура плавления | -86 ° С (-123 ° F, 187 К) |
| Точка кипения | От 38 до 39 ° C (от 100 до 102 ° F; от 311 до 312 K) |
| Давление газа | 49,9 кПа (при 20 ° C) |
| Структура | |
| Тригонально-пирамидальный | |
| 1.19 Дебай | |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H225, H315, H319, H335 | |
| P210, P261, P305 + 351 + 338 | |
| точка возгорания | -19 ° С (-2 ° F, 254 К) |
| Родственные соединения | |
Родственные соединения | Домашний питомец3 NMe3 PH3 PPh3 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
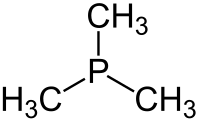
Триметилфосфин это фосфорорганическое соединение с формулой P (CH3)3, обычно сокращенно PMe3. Эта бесцветная жидкость имеет сильно неприятный запах, характерный для алкилфосфинов. Соединение обычное лиганд в координационная химия.
Структура и склеивание
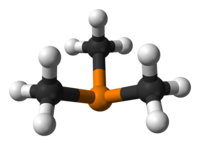
Это пирамидальный молекула с приблизительным C3v симметрия. Валентные углы C – P – C составляют примерно 98,6 °.[2]
Валентные углы C – P – C согласуются с представлением о том, что фосфор преимущественно использует 3p-орбитали для образования связей и что существует небольшая sp-гибридизация атома фосфора. Последнее - общая черта химии фосфора. В результате неподеленная пара триметилфосфина имеет преимущественно s-характер, как и в случае фосфина, PH3.[3]
PMe3 можно приготовить путем лечения трифенилфосфит с метилмагний хлорид:[4]
- 3 канала3MgCl + P (OC6ЧАС5)3 → P (CH3)3 + 3 С6ЧАС5OMgCl
Синтез проводится в дибутиловый эфир, из которых более летучие PMe3 можно перегонять.
Реакции
С ПКа из 8.65, PMe3 реагирует с сильными кислотами с образованием солей [HPMe3]ИКС.[2] Эта реакция обратима. С сильными основаниями, такими как алкиллитиевые соединения, метильная группа подвергается депротонированию с образованием PMe2CH2Ли.
PMe3 легко окисляется кислородом до оксида фосфина. Он реагирует с бромистый метил давать бромид тетраметилфосфония.[5]
Координационная химия
Триметилфосфин является очень основным лиганд который образует комплексы с большинством металлов. В качестве лиганда триметилфосфин Угол конуса Толмана составляет 118 °.[6] Этот угол указывает на степень стерической защиты, которую этот лиганд обеспечивает металлу, с которым он связан.
Будучи относительно компактным фосфином, некоторые из них могут связываться с одним переходным металлом, как показано на примере существования Pt (PEt3)4.[7] Его комплекс с иодидом серебра AgI (PMe3) представляет собой устойчивое к воздуху твердое вещество, которое выделяет PMe3 при нагревании.

Безопасность
PMe3 токсичен и пирофорен. Он превращается в более безопасный оксид фосфина после лечения с гипохлорит натрия или же пероксид водорода.[9]
Рекомендации
- ^ а б «Триметилфосфин (CHEBI: 35890)». Химические объекты, представляющие биологический интерес (ChEBI). Великобритания: Европейский институт биоинформатики. 6 июня 2006 г. Имена ИЮПАК. Получено 25 сентября 2011.
- ^ а б Аннет Шиер и Хуберт Шмидбаур «Р-донорные лиганды» в Энциклопедии неорганической химии 2006, Wiley-VCH, Weinheim. Дои:10.1002 / 0470862106.ia177
- ^ Э. Флюк, Химия фосфина, Topics in Current Chemistry Vol. 35, 64 с., 1973.
- ^ Leutkens, Jr., M. L .; Sattelberger, A. P .; Мюррей, H.H .; Basil, J.D .; Факлер, младший, Дж. П. (1990). Роберт Дж. Анджелики (ред.). «Триметилфосфин». Неорганические синтезы. Неорганические синтезы. Нью-Йорк: J. Wiley & Sons. 28: 305–310. Дои:10.1002 / 9780470132593.ch76. ISBN 0-471-52619-3.CS1 maint: несколько имен: список авторов (связь)
- ^ Х. Ф. Кляйн (1978). «Метилид триметилфосфония (триметилметиленфосфоран)». Неорганические синтезы. XVIII: 138–140. Дои:10.1002 / 9780470132494.ch23.
- ^ Г. Л. Мисслер, Д. А. Тарр Неорганическая химия, 3-е изд., Издательство Pearson / Prentice Hall, ISBN 0-13-035471-6.
- ^ Т. Йошида Т. Мацуда С. Оцука (1990). «Тетракис (триэтилфосфин) платина (0)». Неорганические синтезы. 28: 122. Дои:10.1002 / 9780470132593.ch32.CS1 maint: использует параметр авторов (связь)
- ^ Sattler, A .; Паркин, Г. (2011). «Образование катионного алкилиденового комплекса посредством формального отвода гидрида: синтез и структурная характеристика [W (PMe3) 4 ([small eta] 2-CHPMe2) H] X (X = Br, I)». Химические коммуникации. 47: 12828–12830. Дои:10.1039 / C1CC15457E.CS1 maint: использует параметр авторов (связь)
- ^ http://www.sigmaaldrich.com/catalog/product/aldrich/324116?lang=en®ion=US&cm_sp=Insite-_-prodRecCold_xorders-_-prodRecCold2-2
