Тетрадентатный лиганд - Tetradentate ligand
Тетрадентатные лиганды находятся лиганды которые связываются с четырьмя донорными атомами с центральным атомом с образованием координационного комплекса. Это количество связывающихся донорных атомов называется дентальность и способ классификации лигандов. Тетрадентатные лиганды широко распространены в природе в виде хлорофилл который имеет сердцевинный лиганд, называемый хлорин, и гем с основным лигандом, называемым порфирин. Они добавляют большую часть цвета, наблюдаемого у растений и людей. Фталоцианин представляет собой искусственный макроциклический тетрадентатный лиганд, который используется для создания синих и зеленых пигментов.
Форма
Тетрадентатные лиганды можно классифицировать по топологии связей между донорными атомами. Обычными формами являются линейные (также называемые последовательными), кольцевые или триподные. Тетраподальный лиганд, который также является тетрадентатным, имеет четыре ветви с донорными атомами и мостик, который не является донором. При связывании с центральным атомом возможно несколько расположений, называемых геометрическими изомерами.
Линейные лиганды
Линейный тетрадентатный лиганд имеет четыре донорных атома в линию, каждый последующий донор соединен одним из трех мостиков.
Линейный тетрадетатный лиганд, связанный с металлом в тетраэдрической координации, может соединяться только одним способом. Если лиганд несимметричный, то есть два хиральных расположения.
Линейный тетрадетатный лиганд связывается с металлом в плоско-квадратной координации одним способом. Расположение против часовой стрелки или по часовой стрелке эквивалентно.
Линейные лиганды в октаэдрической координации

У линейного тетрадентатного лиганда донорные атомы расположены вдоль или в цепочке, так что каждый соседний донорный атом должен быть смежным с центральным атомом. Такое расположение приводит к трем стереохимическим результатам. Четыре донорные группы могут быть коэкваториальными. Эта геометрия называется транс потому что оставшиеся незанятые позиции на октаэдре взаимно транс (противоположны).[1][2][3] Когда два внутренних донорных атома, например вторичные амины в триен или EDDA, являются пирамидными, два диастереомера для транс-расположения определяются относительной стереохимией этих центров. Обычно эти доноры являются взаимно трансгендерными, что приводит к образованию хирального комплекса C2-симметричные комплексы. Такое расположение иллюстрируют комплексы Лиганд Троста.
У лиганда может быть один изгиб, один на полюсе и три на экваторе центрального атома. Это называется бета СНГ-β (бета). Остальные октаэдрические позиции СНГ (рядом) друг с другом. Треугольники координирующих атомов и центрального атома имеют две компланарные и один перпендикулярный друг другу. Это хиральное расположение, поэтому есть два возможных зеркальных отображения. Расположение, в котором цепь идет вниз и по часовой стрелке, называется лямбда Λ, а где цепь идет вниз и против часовой стрелки, называется дельта Δ.[2] Если цепь не симметрична, то могут быть получены разные изомеры, в зависимости от того, какой конец лиганда имеет изгиб. Если на одном конце цепочки три донорных атома совпадают, мер- и фак- можно использовать префиксы, используемые для тридентатных лигандов, давая β-мер- если тройка расположена на меридиане или β-фак если три расположены на грани октаэдра.[1]
Цепь может иметь два изгиба, так что один на полюсе, два на экваторе и один на противоположном полюсе. Ни один из треугольников координирующих атомов и центрального атома не компланарен. Это называется СНГ-α (альфа). Это хиральное расположение, поэтому существует два возможных зеркальных отображения. Расположение, в котором цепь идет вниз по часовой стрелке и вниз, называется лямбда Λ, а где она идет вниз, против часовой стрелки и вниз, называется дельта Δ.[4][2]
Триподальные лиганды
Триподальные тетрадентатные лиганды имеют донорный атом, связанный через три цепи с другими донорными атомами. Верхняя часть штатива называется вершиной, а донорный атом в этой позиции является апикальным или также известен как мостиковый атом. Остальные три атома-донора находятся на «ножках» штатива. Примеры могут иметь три идентичные цепи, присоединенные к атому в третичном порядке. Этот атом может быть азотом, фосфором или мышьяком. Молекулы, содержащие фосфор или донорные атомы мышьяка, остаются жесткими на P или As и могут сохранять свою форму, в отличие от соединений азота, которые быстро рацемизируются. Если все ножки штатива симметричны и идентичны друг другу, будет только один способ крепления в восьмигранной координации. Однако на центральном атоме остаются два неэквивалентных положения, поэтому, если присоединяются два разных монодентатных или несимметричный бидентатный лиганд, будут два возможных изомера. Если ступни различаются, значит, изомеров больше. Когда две ножки одинаковы, а одна отличается, существует три расположения, две из которых являются энантиомерами друг друга. Когда есть три разных ветви, есть шесть возможных изомеров, но два являются энантиомерами другой пары, а два - симметричными.[5]
Атомы с пятью координатными положениями обычно тригонально-бипирамидный или же квадратная пирамида в форме. Симметричный триподный тетрадентатный лиганд может образовывать два изомера на квадратной пирамиде, в зависимости от того, находится ли мостиковый донор на вершине или в основании пирамиды. Дополнительное свободное место в квадратной пирамиде находится на основании. Квадратная пирамидальная координация имеет тенденцию происходить там, где шестичленное кольцо образуется с мостиком, мостиком, донорным атомом основания и центральным атомом. Более длинная нога (с тремя мостиковыми атомами) соединяется с вершиной пирамиды, и симметрия теряется.[6]
Для тригональной бипирамиды лиганд в форме треноги имеет наиболее симметричное положение с мостиковым донором на одной из вершин, а ножки штатива располагаются вокруг основания, оставляя свободное место на противоположной вершине. Это C3v симметрия. Тригональная бипирамидная координация имеет тенденцию происходить там, где образуются пятичленные кольца с мостом, мостом, донорными атомами ножек и центральным атомом.[6]
В четырех координатах триподный лиганд заполнял бы все доступные позиции, геометрия тригональная пирамида. Форма искажена от тетраэдр из-за несимметричности штатива.[6]
Классификация
Помимо формы, тетрадентатные лиганды можно классифицировать по лигирующим атомам на лиганде. Для линейных лигандов можно указать порядок. Лиганд может иметь отрицательный заряд, когда он находится в комплексе с центральным атомом. Это может развиться из-за потери ионов водорода при растворении вещества.
Другими характеристиками являются размер колец, образованных центральным металлом с двумя донорными атомами и промежуточной цепью лиганда. Обычно эти кольца имеют пять или шесть членов, но иногда и семь атомов.[7] Для лигандов кольцевой формы важно общее количество атомов в кольце, поскольку оно определяет размер дырки для центрального атома.[7] Каждый дополнительный атом в кольце увеличивает радиус дырки с 0,1 до 0,15 Å.[7]
Лиганды также характеризуются зарядом. Тетрадентатные лиганды могут быть нейтральными, так что заряд всего комплекса такой же, как у центрального атома. Тетрадентатный моноанионный (TMDA) лиганд имеет один донорный атом с отрицательным зарядом.[8] Тетрадентатный дианионный лиганд имеет двойной отрицательный заряд, а тетрадентатные трианионные лиганды имеют тройной отрицательный заряд. Максимальный заряд приходится на тетрадентатные тетраанионные лиганды, которые могут стабилизировать металлы в высоких степенях окисления, однако такие лиганды также должны противостоять окислению, чтобы выжить в сильно окисляющем атоме.[9]
Список
| имя | сокращение | формула | форма | тип | обвинять | МВт | центральные атомы | рис |
|---|---|---|---|---|---|---|---|---|
| Хлорин | звенеть | NNNN | –2 | 312.3678 | Mg | 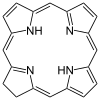 | ||
| Коррин | звенеть | NNNN | –1 | 306.40 | Co | 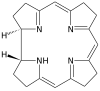 | ||
| 1,4,7,10-тетраоксациклододекан | 12-крон-4 | (C2ЧАС4O)4 | звенеть | ОООО | 0 | 176.21 | Ли | 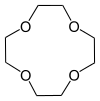 |
| 1,4,8,11-тетраазациклотетрадекан | циклам | (NHCH2CH2NHCH2CH2CH2)2 | звенеть | NNNN | 200.33 | переходные металлы | 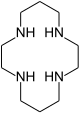 | |
| 1,4,7,10-тетраазациклододекан | цикл | звенеть | N4 | 172.271 | Zn |  | ||
| Дибензотетраметилтетрааза [14] аннулен[10] | tmtaa | звенеть | NNNN | 2- | UO2 | |||
| N, N-этилендиаминдиуксусная кислота | NH2C2ЧАС4N (CH2COOH)2 | триподный | NNO2 | 2– | ||||
| N, N'-этилендиаминдиуксусная кислота | (-CH2NHCH2COOH)2 | линейный | О НЕТ | 2– | ||||
| N-гидроксиимино-2,2'-дипропионовая кислота | ЧАС3HIDPA | HON (CH (CH3) CO2ЧАС)2 | линейный | ONOO | 3– | V4+ |  | |
| диэтилентриаминуксусная кислота | DTMA[1] | NH2C2ЧАС4NHC2ЧАС4NHCH2COOH | линейный | NNNO | 1– | Co | ||
| изо-диэтилентриаминуксусная кислота | я-DTMA[1] | (NH2C2ЧАС4)2NCH2COOH | триподный | NN2НО | 1– | Co | ||
| Лиганд Jäger's N2O2 | линейный акцент | ONNO N2О2 | Ni | |||||
| Нафталоцианин | C48H26N8 | звенеть | NNNN | 714.79 |  | |||
| Нитрилотриуксусная кислота | NTA | N (CH2CO2ЧАС)3 | триподный | НЕТ3 | 3– | 191.14 | Ca2+, Cr, Cu2+, а Fe3+, Ni | 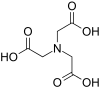 |
| Фталоцианин | ЧАС2ПК | C32ЧАС18N8 | звенеть | NNNN | 2– | Cu, Co | 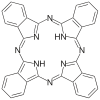 | |
| Порфирин[11] | звенеть | NNNN | Mg, V, Fe, Ni | 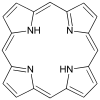 | ||||
| Родоторуловая кислота | C14H24N4O6 | Я формирую | ОООО | 344.36 | Fe3+ |  | ||
| Сален лиганд | линейный | ONNO N2О2 | 268.31 | |||||
| сальпн-лиганд | сальпн | линейный | О НЕТ | 2− | 282.34 | Cr, Cu, Fe, Ni |  | |
| тетары (мезо- и рацемические изомеры)[12] | [(CH3)2Как (CH2)3Как (C6ЧАС5) CH2]2 | линейный | AsAsAsAs | 0 | Co2+ | |||
| 1,1,4,7,10,10-гексафенил-1,4,7,10-тетрафосфадекан тетрафос | тет-1 | линейный | PPPP | 0 | 670.68 | Fe+ RU+ Операционные системы+ Re3+[2] Pd2+ Pt2+ | ||
| 1,4,7,10-тетратиадодекан[13] | [12] -ан-S4 | звенеть | SSSS | 0 | Cu2+ | |||
| 1,4,7,10-тетратиатридекан[13] | [13] -ан-S4 | звенеть | SSSS | 0 | Cu2+ | |||
| 1,4,8,11-тетратиатетрадекан[13] | [14] -ан-S4 | звенеть | SSSS | 0 | Cu2+ | |||
| 1,4,8,12-тетратиапентадекан[13] | [15] -ан-S4 | звенеть | SSSS | 0 | Cu2+ | |||
| 1,5,9,13-тетратиагексадекан[13] | [14] -ан-S4 | звенеть | SSSS | 0 | Cu2+ | |||
| 2,5,8-тритиа [9] (2,5) тиофенофан [13] | звенеть | SSSS | 0 | Cu2+ | ||||
| Диметиловый эфир триэтиленгликоля | TG3 | CH3(OCH2CH2)3ОСН3 | линейный | ОООО | 0 | 178.23 | нейтральный Na, K[14] | |
| Триэтилентетрамин | ТЕТА Trien | [CH2NHCH2CH2NH2]2 | линейный | NNNN | 146.24 | Cu2+ | ||
| трис- (диметиларсинопропил) -арсин[15] | Как [CH2CH2CH2Поскольку (CH3)2]3 | штатив | AsAs3 | 0 | Fe2+ Ni2+ Co3+ окт Ni3+ tbp | |||
| трис-(о-диметиларсинофенил) -арсин[15] | В качестве[о-C6ЧАС4Как (CH3)2]3 | штатив | AsAs3 | 0 | Pt2+ Pd2+ Ni2+ tbp RU2+ окт | |||
| трис-(о-дифениларсинофенил) -арсин[15] | В качестве[о-C6ЧАС4Как (C6ЧАС5)2]3 | штатив | AsAs3 | 0 | Pt2+ Pd2+ RU0 Rh+ Ni2+ tbp Re2+ RU2+ Операционные системы2+ Rh3+ Pd4+ Pt4+ окт | |||
| CH3[Как (CH3)о-C6ЧАС4]3AsCH (3)2[15] | линейный | В качестве4 | 0 | Pd2+ квадратный пирамидал | ||||
| [Как (C6ЧАС5)2о-C6ЧАС4Как (C6ЧАС5) CH2]2[15] | линейный | В качестве4 | 0 | Ni2+ 4 координаты Ni2+ Co2+ пять координат | ||||
| трис-(о-дифенилфосфинофенил) -фосфин[15] | штатив тетрафосфин Венанци | П[о-C6ЧАС4ПК6ЧАС5)2]3 | штатив | PP3 | 0 | Pd2+ Pt2+ RU0 RU2+ Операционные системы2+ Cr0 Cr+ Cr3+ Mn+ Co3+ окт Ni2+ Fe2+ Co+ Co2+ tbp | ||
| Трис (2-пиридилметил) амин | TPA | триподный | N3N | 290.37 | Cu |  | ||
| 2,2'-би-1,10-фенантролин[16] | BIPHEN | линейный | N4 | 0 | Cd Sm Am |
Биомолекулы
Гем это гетероциклический макроцикл кольцевой тетрадентатный лиганд. Это важная молекула в красные кровяные тельца.
Хлорофилл имеет несколько форм и играет важную роль в фотосинтезе растений. Бактерии могут использовать варианты, называемые бактериохлорофиллы.
Рекомендации
- ^ а б c d Шнайдер, Питер В .; Коллман, Джеймс П. (октябрь 1968 г.). «Комплексы кобальта (III) с двумя изомерными диэтилентриаминоуксусными кислотами». Неорганическая химия. 7 (10): 2010–2015. Дои:10.1021 / ic50068a010.
- ^ а б c d Баутиста, Мария Тереза; Эрл, Келли Энн; Мальтби, Патрисия Энн; Моррис, Роберт Гарольд; Швейцер, Кэролайн Терезия (март 1994). «Новые дигидрогенные комплексы: синтез и спектроскопические свойства комплексов железа (II), рутения (II) и осмия (II), содержащих мезо-тетрафос-1 лиганд ". Канадский химический журнал. 72 (3): 547–560. Дои:10.1139 / v94-078.
- ^ Sloan, Thomas E .; Буш, Дэрил Х. (27 мая 1980 г.). «Стереохимическое описание и обозначение систем координации». Стереохимия оптически активных соединений переходных металлов. п. 401. Дои:10.1021 / bk-1980-0119.ch021.
- ^ "Координационная химия I Структуры и изомеры" (PDF). п. 51.
- ^ КОИНЭ, Норио; ЯМАГУЧИ, Хироюки; ТАНИГАКИ, Тейичи; ХИДАКА, Дзинсай; ШИМУРА, Йоичи (1974). «ПРИГОТОВЛЕНИЕ И СТРУКТУРНОЕ НАЗНАЧЕНИЕ ИЗОМЕРОВ КАЛИЯ ТРАНС (N) - (С-МЕТИЛЗАМЕЩЕННЫЙ АММОНИАТРИАЦЕТАТО) (β-АЛАНИНАТО) КОБАЛЬТАТ (III)». Письма по химии. 3 (9): 993–996. Дои:10.1246 / кл.1974.989. открытый доступ
- ^ а б c Амбундо, Эдна А .; Ю, Цююэ; Ochrymowycz, L.A .; Рорабахер, Д. Б. (август 2003 г.). "Кинетика электронного переноса триподно-лигандных комплексов меди (II / I)". Неорганическая химия. 42 (17): 5267–5273. Дои:10.1021 / ic030176c.
- ^ а б c Линдой, Леонард Ф. (1989). Химия макроциклических лигандных комплексов (1. изд., Переведено в цифровую печать. Ред.). Кембридж [Англия]: Издательство Кембриджского университета. п.4. ISBN 052125261X.
- ^ Chomitz, WayneA .; Арнольд, Джон (16 февраля 2009 г.). «Использование тетрадентатных моноанионных лигандов для стабилизации химически активных комплексов металлов». Химия - Европейский журнал. 15 (9): 2020–2030. Дои:10.1002 / chem.200801069.
- ^ Коллинз, Терренс Дж .; Костка, Кимберли Л .; Мунк, Эккард; Уффельман, Эрих С. (июль 1990 г.). «Стабилизация моноядерного пятикоординатного железа (IV)». Журнал Американского химического общества. 112 (14): 5637–5639. Дои:10.1021 / ja00170a037.
- ^ Педрик, Элизабет А .; Assefa, Mikiyas K .; Wakefield, Megan E .; Ву, Гуан; Хейтон, Тревор В. (15 мая 2017 г.). «Координация уранила 14-членным макроциклом дибензотетраметилтетрааза [14] аннуленом». Неорганическая химия. 56 (11): 6638. Дои:10.1021 / acs.inorgchem.7b00700. PMID 28504885.
- ^ Известны многочисленные производные порпирина. См. Список в Buchler, J. W .; Dreher, C .; Кунзель, Ф. М. (1995). Бухлер, Дж. У. (ред.). Комплексы металлов с тетрапиррольными лигандами III. Берлин: Springer. п. 5. ISBN 978-3-540-59281-5.
- ^ Боснич, Б .; Jackson, W. G .; Уайлд, С. Б. (декабрь 1973 г.). «Металлические комплексы диссимметричных арсинов. Стереохимия, топологическая стабильность и спектры комплексов кобальта (III), содержащих линейный квадриденатный тетра-трет-арсиновый лиганд». Журнал Американского химического общества. 95 (25): 8269–8280. Дои:10.1021 / ja00806a012.
- ^ а б c d е ж Занелло, П. (1990). «ЭЛЕКТРОХИМИЯ МОНОЯДЕРНЫХ КОМПЛЕКСОВ МЕДИ. СТРУКТУРНЫЕ РЕОРГАНИЗАЦИИ, СОПРОВОДЯЩИЕ РЕДОКС ИЗМЕНЕНИЯ». В Бернале, Иван (ред.). Стереохимический контроль, связывание и стерические перестройки. Амстердам: Эльзевир. п. 208. ISBN 0444888411.
- ^ Down, J. L .; Lewis, J .; Мур, Б .; Уилкинсон, Г. (1959). «Растворимость щелочных металлов в эфирах». Журнал химического общества: 3767. Дои:10.1039 / JR9590003767.
- ^ а б c d е ж МакОлифф, К. А. (1973). Комплексы переходных металлов с фосфорными, мышьяковыми и сурьмяными лигандами.. Macmillan Ecucation. С. 282–285. ISBN 9780333136287.
- ^ Tucker, Lyndsay E .; Littman, Galen C .; Урит, Стюарт; Наджент, Джозеф В .; Thummel, Randolph P .; Reibenspies, Joseph H .; Джонс, С. Барт; Ли, Хи-Сын; Хэнкок, Роберт Д. (2020-09-08). «Флуоресцентные и металлсвязывающие свойства высокоорганизованного тетрадентатного лиганда 2,2'-Bi-1,10-фенантролина и его замечательное сродство к кадмию (II)». Неорганическая химия: acs.inorgchem.0c00361. Дои:10.1021 / acs.inorgchem.0c00361. ISSN 0020-1669.
