Микробный симбиоз и иммунитет - Microbial symbiosis and immunity
Эта статья требует внимания эксперта по предмету. Конкретная проблема: несфокусированный контент, плохая структура, большая часть написана неопытным студентом-редактором. (Февраль 2017 г.) |

Долгосрочные тесные взаимодействия между симбиотическими микробами и их хозяином могут изменять ответы иммунной системы хозяина на другие микроорганизмы, включая патогены, и необходимы для поддержания надлежащего гомеостаз.[1] В иммунная система представляет собой систему защиты хозяина, состоящую из анатомических физических барьеров, а также физиологических и клеточных реакций, которые защищают хозяин против вредных микроорганизмов, ограничивая реакцию хозяина на безвредные симбионты. Люди являются домом для 1013 до 1014 бактерии, примерно эквивалентно количеству клеток человека,[2] и хотя эти бактерии могут быть патогенными для своего хозяина, большинство из них взаимовыгодное как хозяину, так и бактериям.
Иммунная система человека состоит из двух основных типов иммунитета: врожденного и адаптивного. В врожденная иммунная система состоит из неспецифических защитных механизмов против чужеродных клеток внутри хозяина, включая кожу в качестве физического барьера для входа, активации каскад дополнений для идентификации чужеродных бактерий и активации необходимых клеточных реакций, а также белые кровяные клетки которые удаляют посторонние вещества. В адаптивная иммунная система, или приобретенная иммунная система, представляет собой патоген-специфический иммунный ответ, который осуществляется лимфоциты через презентация антигена на Молекулы MHC различать я и не-я антигены.
Микробы могут способствовать развитию иммунной системы хозяина в кишечнике и коже и могут помочь предотвратить патогены от вторжения. Некоторые выпускают противовоспалительные продукты, защищающие от паразитарных кишечных микробов. Комментарии способствовать развитию В-клетки которые производят защитные антитела, Иммуноглобулин А (IgA). Это может нейтрализовать патогены и экзотоксины и способствуют развитию иммунных клеток и иммунного ответа слизистых оболочек. Однако микробы причастны к заболеваниям человека, включая воспалительное заболевание кишечника, ожирение и рак.
Общие принципы
Эта секция нуждается в расширении. Вы можете помочь добавляя к этому. (Март 2017 г.) |
Микробный симбиоз полагается на межвидовая коммуникация.[3]между хозяином и микробными симбионтами. Иммунитет исторически характеризовался в многоклеточные организмы как контролируемые иммунной системой хозяина, когда воспринимаемое чужеродное вещество или клетка стимулирует иммунный ответ. Конечный результат этого ответа может варьироваться от избавления от вредного патогена до толерантности к полезному микробу и аутоиммунный ответ это вредит самому хозяину.
Совсем недавно было показано, что симбиотические микроорганизмы также участвуют в этом иммунном ответе, что указывает на то, что иммунный ответ не изолирован только от клеток-хозяев. Эти полезные микроорганизмы участвовали в подавлении роста патогенов в кишечнике и противораковом иммунитете среди других реакций.
Желудочно-кишечный тракт
Человек желудочно-кишечный тракт (ЖКТ) состоит из рот, глотка, пищевод, желудок, тонкий кишечник, и толстая кишка, и представляет собой непрерывную трубку длиной 9 метров; самая большая площадь поверхности тела, подверженная воздействию внешней среды. Кишечник предлагает микробам питательные вещества и защиту, позволяя им процветать с кишечным микробным сообществом из 10 человек.14 полезные и патогенные бактерии, археи, вирусы, и эукариоты. В свою очередь, многие из этих микробов выполняют важные функции для хозяина, включая расщепление волокон.[4] и производство витамины[5] где кишечные микробы играют, по крайней мере, роль в производстве витаминов, таких как А, Би 2, B3, B5, B12, C, D и K.
В кишечнике человека иммунная система вступает в контакт с большим количеством чужеродных микробов, как полезных, так и патогенных. Иммунная система способна защитить хозяина от этих патогенных микробов, не вызывая ненужных и вредных иммунных реакций на стимулы. Желудочно-кишечный тракт микробиота оказывает прямое влияние на иммунные реакции человеческого организма. это означает, что регулярная микробиота необходима для здоровой иммунной системы хозяина, поскольку организм более восприимчив к инфекционным и неинфекционным заболеваниям. болезни.
Регулирование иммунных ответов
Комменсальные бактерии в желудочно-кишечном тракте выживают, несмотря на обилие местных иммунных клеток.[6] Гомеостаз в кишечнике требует стимуляции толл-подобные рецепторы комменсальными микробами.[6] Когда мышей выращивают в стерильных условиях, у них отсутствуют циркулирующие антитела, и они не могут продуцировать слизь, антимикробные белки или Т-клетки слизистой оболочки.[6] Кроме того, у мышей, выращенных в стерильных условиях, отсутствуют толерантность и часто страдают от реакции гиперчувствительности.[6] Созревание желудочно-кишечного тракта опосредуется рецепторы распознавания образов (PRR), которые распознают несамостоятельное патоген-ассоциированные молекулярные паттерны (PAMP) включая компоненты клеточной стенки бактерий и нуклеиновые кислоты.[7] Эти данные свидетельствуют о том, что комменсальные микробы способствуют гомеостазу кишечника и развитию иммунной системы.[6]
Чтобы предотвратить постоянную активацию иммунных клеток и возникающее в результате воспаление, хозяева и бактерии эволюционировали, чтобы поддерживать гомеостаз кишечника и развитие иммунной системы.[8] Например, человеческий симбионт Bacteroides fragilis производит полисахарид A (PSA), который связывается с толл-подобный рецептор 2 (TLR-2) на CD4+ Т-клетки.[9] В то время как передача сигналов TLR2 может активировать клиренс пептидов, PSA вызывает противовоспалительный ответ, когда он связывается с TLR2 на CD4.+ Т-клетки.[9] Посредством связывания TLR2 PSA подавляет провоспалительные ответы TH17, способствуя толерантность и установление комменсальной колонизации кишечника.[9]
Комменсальные кишечные микробы создают различные метаболиты, которые связывают арилуглеводородные рецепторы (AHR). AHR представляет собой индуцируемый лигандом фактор транскрипции, обнаруживаемый в иммунных и эпителиальных клетках, и связывание AHR необходимо для нормальной иммунной активации, поскольку было показано, что отсутствие связывания AHR вызывает чрезмерную активацию иммунных клеток.[1] Эти микробные метаболиты имеют решающее значение для защиты хозяина от ненужного воспаления в кишечнике.
Развитие изолированных лимфоидных тканей
Микробы вызывают развитие изолированных лимфоидные фолликулы в тонком кишечнике людей и мышей, которые являются участками иммунного ответа слизистых оболочек. Изолированные лимфоидные фолликулы (ILF) собирают антигены через М клетки, развивать зародышевые центры, и содержат много В-клеток.[10] Грамотрицательный Комменсальные бактерии вызывают развитие индуцибельных лимфоидных фолликулов, высвобождая пептидогилканы содержащий диаминопимелиновая кислота во время деления клеток.[10] Пептидогликаны связываются с NOD1 рецептор на кишечные эпителиальные клетки.[10] В результате клетки кишечного эпителия экспрессируют хемокиновый лиганд 20 (CCL20) и Бета-дефенсин 3.[10] CCL20 и Бета-дефенсин 3 активируют клетки, которые опосредуют развитие изолированных лимфоидных тканей, включая клетки-индукторы лимфоидной ткани и клетки-организаторы лимфоидной ткани.[10]
Кроме того, существуют и другие механизмы, с помощью которых комменсалы способствуют созреванию изолированных лимфоидных фолликулов. Например, продукты комменсальных бактерий связываются с TLR2 и TLR4, что приводит к NF-κB опосредованная транскрипция TNF, который необходим для созревания зрелых изолированных лимфоидных фолликулов.[11]
Защита от патогенов
Микробы могут предотвращать рост вредных патогенов, изменяя pH, потребляя питательные вещества, необходимые для выживания патогенов, и выделяя токсины и антитела, которые подавляют рост патогенов.[12]
Иммуноглобулин А
IgA предотвращает проникновение и колонизацию патогенных бактерий в кишечнике. Его можно найти в виде мономера, димера или тетрамера, что позволяет ему одновременно связывать несколько антигенов.[13] IgA покрывает патогенные бактериальные и вирусные поверхности (иммунное исключение), предотвращая колонизацию, блокируя их прикрепление к клеткам слизистой оболочки, а также может нейтрализовать PAMP.[8][14] IgA способствует развитию TH17 и регуляторные Т-клетки FOXP3 +.[15][16] Учитывая его критическую функцию в желудочно-кишечном тракте, количество IgA-секретирующих плазматических клеток в тощая кишка больше, чем общая популяция плазматических клеток Костный мозг, лимфа, и селезенка комбинированный.[13]
Сигналы, полученные от микробиоты, привлекают IgA-секретирующие плазматические клетки к участкам слизистой оболочки.[8] Например, бактерии на апикальной поверхности эпителиальных клеток фагоцитируются дендритные клетки расположен под пейеровы пятна и в собственная пластинка, что в конечном итоге приводит к дифференцировке В-клеток в плазматические клетки, которые секретируют IgA, специфичные для кишечных бактерий.[17] Роль сигналов микробиоты в рекрутировании IgA-секретирующих плазматических клеток была подтверждена в экспериментах с обработанными антибиотиками специфическими патогенами, свободными и MyD88 КО мышей, которые имеют ограниченные комменсалы и сниженную способность реагировать на комменсалы. Количество кишечных CD11b+ IgA+ плазматические клетки был снижен у этих мышей, что предполагает роль комменсалов в рекрутировании IgA-секретирующих плазматических клеток.[18] На основании этих данных комменсальные микробы могут защищать хозяина от вредных патогенов, стимулируя выработку IgA.
Антимикробные пептиды

Члены микробиоты способны продуцировать антимикробные пептиды, защищая людей от чрезмерного воспаления кишечника и заболеваний, связанных с микробами. Различные комменсалы (в первую очередь Грамположительные бактерии ), секрет бактериоцины, пептиды, которые связываются с рецепторами на близкородственных клетках-мишенях, образуя ионопроницаемые каналы и поры в клеточной стенке.[19] В результате отток метаболитов и содержимого клеток и рассеяние ионные градиенты вызывает гибель бактериальных клеток.[19] Однако бактериоцины также могут вызывать гибель, перемещаясь в периплазматическое пространство и неспецифически расщепляя ДНК (колицин E2), инактивируя рибосома (колицин E3), ингибируя синтез пептидогликан, основной компонент бактериального клеточная стенка (колицин М).[19]
Бактериоцины обладают огромным потенциалом для лечения болезней человека. Например, диарея у людей может быть вызвана множеством факторов, но часто вызывается бактериями, такими как Clostridium difficile.[19] Микробиспора штамм ATCC PTA-5024 секретирует бактериоцин микробиспорицин, который убивает Clostridia путем нацеливания простагландин синтез.[20] Кроме того, бактериоцины особенно перспективны из-за их различий в механизмах, чем антибиотики означает много устойчивые к антибиотикам бактерии не устойчивы к этим бактериоцинам. Например, in vitro рост метициллин-устойчивый S. aureus (MRSA) ингибировался бактериоцином низин A, производства Lactococcus lactis.[19][21] Низин А подавляет устойчивость к метициллину S. aureus путем связывания с предшественником синтеза клеточной стенки бактерий, липид II. Это препятствует способности синтезировать клеточную стенку, что приводит к повышенной проницаемости мембраны, нарушению электрохимических градиентов и возможной смерти.[22]
Обогащение фукозы
Кишечный эпителий человека укреплен углеводы подобно фукоза выражено на апикальный поверхность эпителиальных клеток.[23] Bacteroides thetaiotaomicron, бактериальный вид в подвздошная кишка и двоеточие, стимулирует ген кодирование фукоза, Fut2, в эпителиальных клетках кишечника.[23] В этом мутуалистическом взаимодействии укрепляется эпителиальный барьер кишечника, и люди защищены от вторжения деструктивных микробов, в то время как Б. thetaiotaomicron преимущества, потому что он может использовать фукозу для производства энергии и ее роль в регуляции бактериальных генов.[23]
Кожа

В микробиота кожи жизненно важен как линия защиты от инфекции, физический барьер между окружающей средой и внутренней частью хозяина. Комменсальные микробы, обитающие на коже, такие как Эпидермальный стафилококк, производить антимикробные пептиды (AMP), которые помогают иммунной системе хозяина.[24] Эти AMP сигнализируют об иммунных ответах и поддерживают воспалительный процесс. гомеостаз путем модуляции высвобождения цитокины.[24] S. epidermidis секретирует небольшую молекулу АМФ, которая приводит к повышенной экспрессии β-дефенсинов человека.[24] С. эпидермид также стимулирует выработку IL-17A + CD8 + Т-клеток, что повышает иммунитет хозяина.[25]
Воздействие этих кожных комменсальных бактерий на раннем этапе развития имеет решающее значение для толерантности к этим микробам хозяином, поскольку встречи с Т-клетками позволяют распространять комменсальные антигены во время развития.[26] S. epidermidis и другая важная микрофлора работают аналогично гомеостаз и общее состояние здоровья во всех областях человеческого тела, таких как ротовая полость, влагалище, желудочно-кишечный тракт, и ротоглотка.[24]
Роль в болезни
Равновесиесимбионты и патобионты имеют решающее значение для борьбы с внешними патогенами и предотвращения многих вредных заболеваний. Дисбактериоз или дисбаланс в бактериальном составе кишечника, причастны к воспалительному заболеванию кишечника, ожирению и аллергическим заболеваниям у людей и других животных.[27]
Рак

Кишечные микробы могут играть роль в рак развитие через множество механизмов. Сульфатредуцирующие бактерии производят сероводород, что приводит к геномный Повреждение ДНК.[28] Более высокие показатели рака толстой кишки связаны с повышенным количеством сульфатредуцирующих бактерий в кишечнике.[28] Дополнительно, анаэробные бактерии в толстой кишке преобразовать первичный желчные кислоты во вторичную желчную кислоту, которая участвует в колоректальном канцерогенезе.[28] Кишечные бактерии метаболиты Такие как короткоцепочечные жирные кислоты (SCFA), Витамины группы B и н1, N12-диацетилспермин также участвует в подавлении колоректального рака.[1] Грамотрицательные бактерии производить липополисахарид (ЛПС), который привязан к TLR-4 и через TGF-β передача сигналов, приводит к экспрессии факторов роста и медиаторов воспаления, которые способствуют неоплазия.[28]
Было показано, что члены здорового микробиома кишечника увеличиваются интерферон-γ -производство CD8 Т-клетки и инфильтрация опухоли дендритные клетки (TILs) в кишечнике.[29] Эти CD8 Т-клетки не только повышают устойчивость к внутриклеточные патогены Такие как Listeria monocytogenes но также было показано, что они важны для противоракового иммунитета, особенно против MC38. аденокарцинома где они вместе с TIL увеличиваются MHC I выражение.[29]
Аллергические и иммунные нарушения
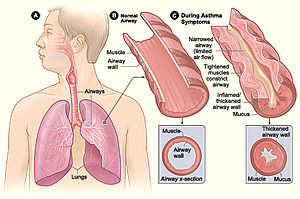
Человеческий микробиом позитивно модулирует иммунитет хозяина, помогая защитить себя от потенциальных патогенов, но также может привести к чрезмерной иммунной реакции на чужеродные вещества, даже иногда к атаке самого хозяина. Воспалительное заболевание кишечника (ВЗК) и астма это два расстройства, на которые влияют метаболиты микробиоты, вызывающие иммунные реакции. Короткоцепочечные жирные кислоты (SCFAs) связаны с уменьшением аллергического воспаления при астме.[30] в то время как SCFAs и витамины B уменьшают воспаление IBD.[31]
SCFAs (ацетат, бутират и пропионат ) представляют собой метаболиты, создаваемые бактериями в кишечнике, эти молекулы затем ингибируют гистоновые деацетилазы (HDAC), а также G-белковые рецепторы, действуя как сигнальные молекулы.[1] Ингибирование ингибиторов HDAC ядерный фактор-κB (NF-κB) и провоспалительные фактор некроза опухоли (TNF) а также оказывает противовоспалительное действие на макрофаги и дендритные клетки.[1]
Активация иммунитета слизистых оболочек и кишечной микробиоты может способствовать воспалительному заболеванию кишечника. Многие бактерии вызывают воспаление в кишечнике, в том числе: кишечная палочка, которые воспроизводятся в макрофаги и секреты цитокин фактор некроза опухоли.[32] Однако некоторые бактерии, в том числе симбионт человека B. fragilis, может предотвратить колит производя полисахарид А (PSA).[33] PSA индуцирует производство Ил-10, иммунодепрессивный цитокин, подавляющий воспаление.[34] Лечение дендритных клеток костного мозга и наивных CD4+ Т-клетки с очищенным PSA приводили к увеличению продукции IL-10.[34]
Чтобы имитировать колит и активировать воспалительные Т-клетки в экспериментальных условиях, мышей дикого типа лечили тринитробензолсульфоновой кислотой (TNBS).[34] После этого этим мышам перорально вводили PSA. Экспрессия провоспалительных цитокинов (Ил-17а и TNFα ) в CD4+ клеток измеряли с ELISA. Исследователи обнаружили, что по сравнению с CD4+ клетки контрольных мышей, CD4+ клетки мышей, обработанных PSA, продуцировали сниженные уровни провоспалительных цитокинов IL-17a и TNFα.[34] Кроме того, после колонизации кишечника B. fragilis, Ил-23 выражение спленоциты было заметно сокращено.[34] Эти данные предполагают, что ПСА, секретируемый B. fragilis подавляет воспалительный процесс во время колита, приводя к увеличению выработки IL-10 и уменьшению продукции IL-17, TNFα и IL-23.[34]
Комменсальные бактерии также могут регулировать иммунные реакции, вызывающие аллергию. Например, комменсальные бактерии стимулируют TLR4, который может подавлять аллергические реакции на пищу.[35]
Метаболические нарушения
Было обнаружено, что на основные метаболические заболевания влияют метаболиты кишечной микробиоты, в том числе: сердечное заболевание, заболевание почек, диабет 2 типа и ожирение.[1] Разбивка по L-карнитин из красного мяса кишечными микробами в N-оксид триметиламина (TMAO) был связан с атеросклороз, что может привести к ожирению, сердечным заболеваниям и диабету 2 типа.[36] в то время как болезни сердца и почек можно предсказать с помощью п-крезол уровни.[37] SCFAs модулируют секрецию ренина, связывая Olfr78, снижая кровяное давление и снижая риск заболевания почек.[38]
Исследования на стерильных мышах показали, что отсутствие кишечных микробов защищает от ожирения.[39] Хотя точный механизм, с помощью которого микробы играют роль в ожирении, еще предстоит выяснить, была выдвинута гипотеза, что кишечная микробиота участвует в преобразовании пищи в полезную энергию и хранение жира.[39]
Неврологические расстройства
Микробиота кишечника влияет на многие аспекты здоровья человека, даже на неврологические расстройства, которые могут быть вызваны дисбалансом молекул или гормонов. Расстройство аутистического спектра (РАС),[1] дисфункция центральной нервной системы[1] и депрессия[40] было обнаружено, что все они подвержены влиянию микробиоты.

Хотя РАС обычно описывается различиями в поведении, они также могут проявляться желудочно-кишечными симптомами.[41] У некоторых людей с РАС отмечен дисбактериоз желудочно-кишечного тракта, что приводит к повышенной кишечной проницаемости.[41] У модельных мышей с РАС и дисбактериозом желудочно-кишечного тракта (активация материнского иммунитета) была обнаружена повышенная кишечная проницаемость, которая была скорректирована введением бактериального симбионта кишечника человека. B. fragilis.[41]
Развитие микроглии играет ключевую роль в дисфункции центральной нервной системы, бактериальные метаболиты SCFA регулируют микроглия гомеостаз, который имеет решающее значение для нормального развития ЦНС.[42] Также решающее значение для развития мозга имеет создание плотных контактов в гематоэнцефалический барьер чтобы контролировать переход между кровью и мозгом. Мыши без зародышей имеют повышенную проницаемость гематоэнцефалического барьера из-за снижения экспрессии белков плотных контактов окклюдин и клаудин-5 по сравнению с мышами с нормальной кишечной микробиотой.[43]
Бутират -продуцирующие бактерии и дофамин метаболит 3,4-дигидроксифенилуксусная кислота связаны с более высокими показателями качества жизни, в то время как γ-аминомасляная кислота был связан с более высоким уровнем депрессии.[40]
Рекомендации
- ^ а б c d е ж грамм час Грачи, Мишель Дж .; Гаррет, Венди С. (27 мая 2016 г.). «Микробиота кишечника, метаболиты и иммунитет хозяина». Nature Reviews Иммунология. 16 (6): 341–352. Дои:10.1038 / нет.2016.42. ISSN 1474-1733. ЧВК 5541232. PMID 27231050.
- ^ Мазманян, Саркис (2006). «Отношения любви и ненависти между бактериальными полисахаридами и иммунной системой хозяина». Nature Reviews Иммунология. 849–858 (11): 849–858. Дои:10.1038 / nri1956. PMID 17024229. S2CID 20380038.
- ^ Маккенни Дэвид; Браун Кэтрин; Эллисон Дэвид (1995). «Влияние экзопродуктов Pseudomonas aeruginosa на продукцию фактора вирулентности у Burkholderia cepacia: доказательства межвидовой коммуникации». Журнал бактериологии. 177 (23): 6989–6991. Дои:10.1128 / jb.177.23.6989-6992.1995. ЧВК 177571. PMID 7592496.
- ^ Хольшер, Ханна Д. (2017-03-04). «Пищевые волокна, пребиотики и микробиота желудочно-кишечного тракта». Кишечные микробы. 8 (2): 172–184. Дои:10.1080/19490976.2017.1290756. ISSN 1949-0984. ЧВК 5390821. PMID 28165863.
- ^ ЛеБлан, Жан Ги; Милани, Кристиан; де Джорджи, Грасиела Савой; Сесма, Фернандо; ван Зиндерен, Дуве; Вентура, Марко (апрель 2013 г.). «Бактерии как поставщики витаминов для своего хозяина: перспектива микробиоты кишечника». Текущее мнение в области биотехнологии. 24 (2): 160–168. Дои:10.1016 / j.copbio.2012.08.005. ISSN 1879-0429. PMID 22940212.
- ^ а б c d е Браун, Э.М. (2013). «Свежий взгляд на гигиеническую гипотезу: как воздействие кишечных микробов вызывает иммунные эффекторные реакции при атопическом заболевании». Семинары по иммунологии. 25 (5): 378–387. Дои:10.1016 / j.smim.2013.09.003. PMID 24209708.
- ^ Palm, Noah W .; de Zoete, Marcel R .; Флавелл, Ричард А. (август 2015 г.). «Взаимодействие иммунной микробиоты при здоровье и болезни». Клиническая иммунология. 159 (2): 122–127. Дои:10.1016 / j.clim.2015.05.014. ISSN 1521-6616. ЧВК 4943041. PMID 26141651.
- ^ а б c Серф-Бенсуссан, Надин; Габорио-Ротио, Валери (01.10.2010). «Иммунная система и микробиота кишечника: друзья или враги?». Nature Reviews Иммунология. 10 (10): 735–744. Дои:10.1038 / nri2850. PMID 20865020. S2CID 13257259.
- ^ а б c Round, июнь L .; Ли, С. Мелани; Ли, Дженнифер; Тран, Глория; Джабри, Бана; Chatila, Talal A .; Мазманян, Саркис К. (20.05.2011). «Путь Toll-подобного рецептора устанавливает комменсальную колонизацию кишечника». Наука. 332 (6032): 974–977. Дои:10.1126 / science.1206095. ЧВК 3164325. PMID 21512004.
- ^ а б c d е Eberl, G .; Лохнер, М. (09.09.2009). «Развитие лимфоидной ткани кишечника на стыке собственной личности и микробиоты». Иммунология слизистой оболочки. 2 (6): 478–485. Дои:10.1038 / миль.2009.114. PMID 19741595.
- ^ Бускра, Джахида; Брезильон, Кристоф; Берар, Марион; Вертс, Кэтрин; Варона, Роза; Бонека, Иво Гомпертс; Эберл, Жерар (27 ноября 2008 г.). «Генез лимфоидной ткани, индуцированный комменсалами через NOD1, регулирует гомеостаз кишечника». Природа. 456 (7221): 507–510. Bibcode:2008Натура.456..507Б. Дои:10.1038 / природа07450. PMID 18987631. S2CID 205215248.
- ^ Камада, Н. (2013). «Контроль болезнетворных микроорганизмов и патобионтов микробиотой кишечника». Иммунология природы. 14 (7): 685–690. Дои:10.1038 / ni.2608. ЧВК 4083503. PMID 23778796.
- ^ а б Кубы Иммунология. С. 90–92. ISBN 9781429203944.
- ^ Mantis, N.J .; Rol, N .; Кортези, Б. (2011-11-01). «Комплексная роль секреторного IgA в иммунитете и гомеостазе слизистой оболочки кишечника». Иммунология слизистой оболочки. 4 (6): 603–611. Дои:10.1038 / миль.2011.41. ЧВК 3774538. PMID 21975936.
- ^ Макферсон, AJ (2008). «Иммунная география индукции и функции IgA». Иммунология слизистой оболочки. 1 (1): 11–22. Дои:10.1038 / ми.2007.6. PMID 19079156.
- ^ Камада, Н. (2013). «Роль микробиоты кишечника в иммунитете и воспалительных заболеваниях». Nature Reviews Иммунология. 13 (5): 321–335. Дои:10.1038 / nri3430. PMID 23618829. S2CID 205491968.
- ^ Хупер Лора В., Брай Линн, Фальк Пер Г., Гордон Джеффри И. (1998). «Симбиоз микробов и хозяев в кишечнике млекопитающих: изучение внутренней экосистемы». BioEssays. 20 (4): 336–343. Дои:10.1002 / (sici) 1521-1878 (199804) 20: 4 <336 :: aid-bies10> 3.3.co; 2-j. PMID 9619105.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Кунисава, Дзюн; Годда, Масаси; Хашимото, Эри; Исикава, Идзуми; Хигучи, Морио; Судзуки, Юдзи; Гото, Ёсиюки; Панея, Касандра; Иванов, Ивайло И. (23.04.2013). «Микробно-зависимые плазматические клетки CD11b + IgA + опосредуют устойчивые ранние фазы кишечных IgA-ответов у мышей». Nature Communications. 4: 1772. Bibcode:2013НатКо ... 4,1772 тыс.. Дои:10.1038 / ncomms2718. ЧВК 3644083. PMID 23612313.
- ^ а б c d е Хаммами, Риад; Фернандес, Бенуа; Лакруа, Кристоф; Флисс, Исмаил (30 октября 2012 г.). «Антиинфекционные свойства бактериоцинов: обновленная информация». Клеточные и молекулярные науки о жизни. 70 (16): 2947–2967. Дои:10.1007 / s00018-012-1202-3. PMID 23109101. S2CID 16228657.
- ^ Кастильоне, Франция; Лаццарини, Америга; Каррано, Лючия; Корти, Эмилиана; Чичилиато, Исмаэла; Гастальдо, Лучано; Кандиани, Паоло; Лози, Даниэле; Маринелли, Флавия (25 января 2008 г.). «Определение структуры и механизма действия микробиспорицина, мощного лантибиотика, активного против мультирезистентных патогенов». Химия и биология. 15 (1): 22–31. Дои:10.1016 / j.chembiol.2007.11.009. PMID 18215770.
- ^ Piper, C .; Draper, L.A .; Коттер, П. Д .; Ross, R.P .; Хилл, К. (01.09.2009). «Сравнение активности лактицина 3147 и низина против лекарственно-устойчивых видов Staphylococcus aureus и Enterococcus». Журнал антимикробной химиотерапии. 64 (3): 546–551. Дои:10.1093 / jac / dkp221. PMID 19561147.
- ^ Hsu, Shang-Te D .; Брейкинк, Ифджан; Тищенко, Евгений; Lutters, Мэнди А.Г .; де Крюжфф, Бен; Каптейн, Роберт; Бонвин, Александр М. Дж. Дж .; ван Нуланд, Нико А. Дж. (2004-10-01). «Комплекс низин-липид II обнаруживает пирофосфатную клетку, которая обеспечивает основу для новых антибиотиков». Структурная и молекулярная биология природы. 11 (10): 963–967. Дои:10.1038 / nsmb830. HDL:1874/385449. PMID 15361862. S2CID 13181577.
- ^ а б c Гото, Ёсиюки; Киёно, Хироши (2012). «Эпителиальный барьер: интерфейс для перекрестной коммуникации между кишечной флорой и иммунной системой». Иммунологические обзоры. 245 (1): 147–163. Дои:10.1111 / j.1600-065X.2011.01078.x. PMID 22168418.
- ^ а б c d Галло Ричард Л., Накацудзи Теруаки (2011). «Микробный симбиоз с системой врожденной иммунной защиты кожи». Журнал следственной дерматологии. 131 (10): 1974–1980. Дои:10.1038 / jid.2011.182. ЧВК 3174284. PMID 21697881.
- ^ Наик, Шрути; Буладу, Николя; Linehan, Jonathan L .; Хан, Сон-Джи; Харрисон, Оливер Дж .; Вильгельм, Кристоф; Конлан, Шон; Химмельфарб, Сара; Byrd, Allyson L .; Деминг, Клейтон; Хиноны, Мариам (2 апреля 2015 г.). «Взаимодействие комменсала с дендритными клетками определяет уникальную защитную сигнатуру иммунной защиты кожи». Природа. 520 (7545): 104–108. Bibcode:2015Натура.520..104Н. Дои:10.1038 / природа14052. ISSN 0028-0836. ЧВК 4667810. PMID 25539086.
- ^ Шаршмидт, Тиффани К. (январь 2017 г.). «Установление толерантности к комменсальным кожным бактериям: время решает все». Дерматологические клиники. 35 (1): 1–9. Дои:10.1016 / j.det.2016.07.007. ISSN 0733-8635. ЧВК 5130113. PMID 27890233.
- ^ ДеГруттола, Арианна К .; Низкий, Дарен; Мидзогути, Ацуши; Мидзогучи, Эмико (25 февраля 2017 г.). «Современное понимание дисбактериоза при заболеваниях на моделях человека и животных». Воспалительные заболевания кишечника. 22 (5): 1137–1150. Дои:10.1097 / MIB.0000000000000750. ЧВК 4838534. PMID 27070911.
- ^ а б c d Халлар, Мередит А. Дж .; Burnett-Hartman, Andrea N .; Лампе, Йоханна В. (01.01.2014). Кишечные микробы, диета и рак. Лечение рака и исследования. 159. С. 377–399. Дои:10.1007/978-3-642-38007-5_22. ISBN 978-3-642-38006-8. ISSN 0927-3042. ЧВК 4121395. PMID 24114492.
- ^ а б Тануэ, Такеши; Морита, Сатору; Plichta, Damian R .; Skelly, Ashwin N .; Суда, Ватару; Сугиура, Юки; Нарушима, Сейко; Вламакис, Гера; Мотоо, Иори; Сугита, Кайоко; Сиота, Ацуши (январь 2019 г.). «Определенный комменсальный консорциум вызывает CD8 Т-клетки и противораковый иммунитет». Природа. 565 (7741): 600–605. Bibcode:2019Натура.565..600Т. Дои:10.1038 / s41586-019-0878-z. ISSN 1476-4687. PMID 30675064. S2CID 59159425.
- ^ Мин, Буки (18 февраля 2014 г.). «Факультет 1000 оценки кишечной микробиоты. Метаболизм пищевых волокон влияет на аллергические заболевания дыхательных путей и гемопоэз». Дои:10.3410 / ф.718228193.793491060. Цитировать журнал требует
| журнал =(Помогите) - ^ Сингх, Нагендра; Гурав, Ашиш; Шивапракашам, сатхиш; Брэди, Эван; Падиа, Рави; Ши, Хуэйдун; Тангараджу, Мутхусами; Prasad, Puttur D .; Manicassamy, Santhakumar; Манн, Дэвид Х .; Ли, Джеффри Р. (январь 2014 г.). «Активация Gpr109a, рецептора ниацина и бутирата метаболита комменсала, подавляет воспаление толстой кишки и канцерогенез». Иммунитет. 40 (1): 128–139. Дои:10.1016 / j.immuni.2013.12.007. ISSN 1074-7613. ЧВК 4305274. PMID 24412617.
- ^ Сартор, Р. Бальфур; Мазманян, Саркис К. (01.07.2012). «Кишечные микробы при воспалительных заболеваниях кишечника». Американский журнал гастроэнтерологических добавок. 1 (1): 15–21. Дои:10.1038 / ajgsup.2012.4.
- ^ Round, июнь L .; Мазманян, Саркис К. (16.02.2017). «Микробиом кишечника формирует иммунные реакции кишечника во время здоровья и болезни». Nature Reviews Иммунология. 9 (5): 313–323. Дои:10.1038 / nri2515. ЧВК 4095778. PMID 19343057.
- ^ а б c d е ж Мазманян, Саркис К .; Round, июнь L .; Каспер, Деннис Л. (2008). «Фактор микробного симбиоза предотвращает воспалительные заболевания кишечника». Природа. 453 (7195): 620–625. Bibcode:2008Натура.453..620М. Дои:10.1038 / природа07008. PMID 18509436. S2CID 205213521.
- ^ Башир, Мохамед Эльфатих Х .; Луи, Стив; Ши, Хай Нин; Наглер-Андерсон, Кэтрин (2004-06-01). «Передача сигналов Toll-подобного рецептора 4 кишечными микробами влияет на восприимчивость к пищевой аллергии». Журнал иммунологии. 172 (11): 6978–6987. Дои:10.4049 / jimmunol.172.11.6978. PMID 15153518.
- ^ Терри, Пол; Чен, Цзянган (2013-04-11). «Факультет 1000 оценки метаболизма кишечной микробиоты l-карнитина, питательного вещества в красном мясе, способствует развитию атеросклероза». Дои:10.3410 / ф.717998892.793474469. Цитировать журнал требует
| журнал =(Помогите) - ^ Meijers, Björn K.I .; Клаас, Кэтлин; Бамменс, Берт; де Лур, Генриетта; Viaene, Liesbeth; Вербеке, Кристин; Кайперс, Дирк; Ванрентергхем, Ив; Эвенепол, Питер (июль 2010 г.). «p-Крезол и сердечно-сосудистый риск при легкой и средней степени заболевания почек». Клинический журнал Американского общества нефрологов. 5 (7): 1182–1189. Дои:10.2215 / CJN.07971109. ISSN 1555-9041. ЧВК 2893077. PMID 20430946.
- ^ Persson, A Erik G; Карлстрем, Маттиас (21 мая 2013 г.). «Факультет 1000 оценки обонятельных рецепторов, отвечающих на сигналы кишечной микробиоты, играет роль в секреции ренина и регуляции артериального давления». Дои:10.3410 / ф.717978217.793476920. Цитировать журнал требует
| журнал =(Помогите) - ^ а б Кардинг, Саймон; Вербеке, Кристин; Випонд, Дэниел Т .; Corfe, Bernard M .; Оуэн, Лорен Дж. (02.02.2015). «Дисбактериоз микробиоты кишечника при болезни». Микробная экология в здоровье и болезнях. 26: 26191. Дои:10.3402 / mehd.v26.26191. ISSN 0891-060X. ЧВК 4315779. PMID 25651997.
- ^ а б Валлес-Коломер, Мирейя; Фалони, Гвен; Дарзи, Юсеф; Tigchelaar, Ettje F .; Ван, Цзюнь; Tito, Raul Y .; Шивек, Кармен; Курильщиков Александр; Йооссенс, Мари; Вейменга, Сиска; Клаас, Стефан (апрель 2019 г.). «Нейроактивный потенциал микробиоты кишечника человека в качестве жизни и депрессии». Природная микробиология. 4 (4): 623–632. Дои:10.1038 / с41564-018-0337-х. ISSN 2058-5276. PMID 30718848. S2CID 59603019.
- ^ а б c Hsiao, Elaine Y .; Макбрайд, Сара У .; Сянь, София; Шэрон, Гил; Hyde, Embriette R .; МакКью, Тайлер; Codelli, Julian A .; Чоу, Джанет; Reisman, Sarah E .; Петросино, Джозеф Ф .; Паттерсон, Пол Х. (19 декабря 2013 г.). «Микробиота регулирует физиологию кишечника и поведенческие аномалии, связанные с аутизмом». Клетка. 155 (7): 1451–1463. Дои:10.1016 / j.cell.2013.11.024. ISSN 0092-8674. ЧВК 3897394. PMID 24315484.
- ^ Давидович, Летиция (22.06.2015). «Факультет 1000 оценок микробиоты хозяина постоянно контролирует созревание и функцию микроглии в ЦНС». Дои:10.3410 / ф.725528105.793507643. Цитировать журнал требует
| журнал =(Помогите) - ^ Бранисте, Виорика; Аль-Асмах, Маха; Коваль, Чеслава; Ануар, Фархана; Аббаспур, Афруз; Тот, Миклош; Корецка, Агата; Бакочевич, Надя; Нг, Лай Гуань; Кунду, Параг; Гуляш, Балаж (19.11.2014). «Микробиота кишечника влияет на проницаемость гематоэнцефалического барьера у мышей». Научная трансляционная медицина. 6 (263): 263ra158. Дои:10.1126 / scitranslmed.3009759. ISSN 1946-6234. ЧВК 4396848. PMID 25411471.
