Иозифосские лиганды - Josiphos ligands - Wikipedia
А Иозифосский лиганд это тип хиральный дифосфин который был изменен на субстрат -специфический; они широко используются для энантиоселективный синтез.[1] Они названы в честь техника, который сделал первый, Джози Пулео.[2]

История
Гомогенный катализ часто используется для энантиоселективные превращения. В лиганды несут хиральную информацию, и поэтому они модифицированы для отдельных субстратов. Лиганды также могут влиять на хемоселективность катализатора. Лиганды Josiphos, часто называемые привилегированные лиганды, важны из-за их способности давать высокие выходы при энантиоселективном синтезе.[4][5]
Лиганды Josiphos были разработаны в 1990-х годах Антонио Тони в исследованиях ферроценил лиганды, ранее открытые Т. Хаяши (1986). Эти исследования были сосредоточены на катализируемом Au (I) альдольная реакция в Центральных исследовательских лабораториях бывшей Ciba (ныне Новартис ). Дифосфиновые лиганды были получены из вторичных фосфинов, сегодня они известны как семейство лигандов Josiphos, которое получило название в честь Джози Пулео, техника, который подготовил первый лиганд. Впервые он был опробован в энамиде, катализируемом Ru. гидрирование синтез, приводящий к ее Более 99% и TOF 1000 ч.−1.[6][7] Лиганд был успешно применен для синтеза гербицид (S) -метолахлор, активный ингредиент наиболее распространенного гербицида в США. Синтез идет через энантиоселективное гидрирование из я добываю (фигура 2).[8][9][10] Реакция протекает со 100% конверсией с Тонна более 7 000 000 и Частота оборота (TOF) более 2000000 ч−1. Этот процесс является наиболее масштабным применением энантиоселективного гидрирования, производящим более 10 000 тонн / год желаемого продукта с 79% ее.
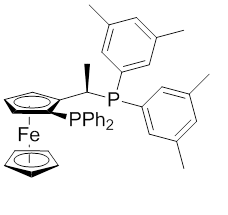
Рисунок 2: Ксилифосный лиганд
Лиганды также используются в неэнантиоселективных реакциях. Они были хорошими лигандами в катализируемой Pd реакции арилхлориды и арилвинилтозилаты с TON 20 000 или выше.[11] Также в карбонилировании, катализируемом Pd / Josiphos.[12] Сцепление с Гриньяром и Муфта Негиши реакции[13][14]
Ряд лигандов Josiphos коммерчески доступны по лицензии от Solvias. (R-S) и его энантиомер обычно используются, поскольку они обеспечивают более высокий выход и более высокую энантиоселективность, чем диастереомер (R, R).[15][16] Ферроценовые леса оказались универсальными.[15][17][18][19][20][21] Одним из структурных параметров, влияющих на реактивность, является угол прикуса. Угол P1-M-P2 имеет среднее значение 92,7 °.[15]
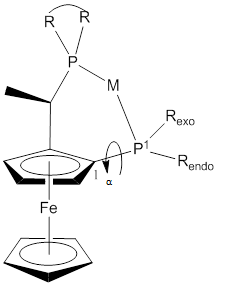
Рисунок 3: Вид общей конформации комплекса лигандов Josiphos
Общий консенсус в отношении наименования заключается в сокращении индивидуального лиганда как (R) - (S) -R2ПФ-ПР ’2. Заместитель в Cp пишется перед F, а R в хиральном центре после F.[1]
Синтез лигандов Josiphos
Общий подход к получению лигандов Josiphos представлен на рисунке 4, начиная с Амин Уги.

Рисунок 4: Схема общего синтеза лигандов Josiphos[22]
Важным улучшением со времени первого намерения, уже отмеченным на рисунке 4, стало использование N (CH3)2 группа в качестве уходящей группы, а не ацетат. Также было обнаружено, что использование уксусной кислоты в качестве растворителя дает лучшие выходы.
Реакции с использованием лигандов Josiphos
Некоторые реакции, которые осуществляются с использованием комплексов M-Josiphos в качестве катализатора, перечислены ниже. 1) Гидроборирование стирола

Рисунок 5: Гидроборирование стирола[23]
С ее до 92% и TOF от 5 до 10 часов−1. Реакцию проводят при -78 ° C. Комплекс Rh-binap Хаяши дает лучший урожай.[24]
2) Гидроформилирование стирола.

Рисунок 6: Гидроформилирование стирола
Выход продукта (R) до 78% ee, при низких значениях TON и TOF, 10-210 и 1-14 часов−1, соответственно.[1][25]
3) Восстановительное аминирование
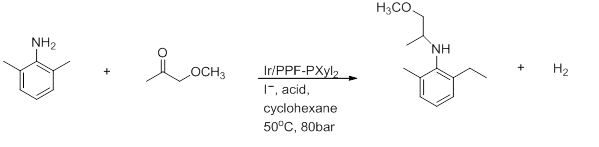
Рисунок 7: Восстановительное аминирование[26]
Это препарат (S) -метолахлора. Это сильно зависит от растворителя, в котором AcOH необходим для достижения хороших выходов и 100% конверсии.
4) Гидрирование экзоциклического метилимина.

Рисунок 8: Гидрирование экзоциклического метилимина
Эта реакция является ключевым этапом синтеза ингибитора интегразы ВИЧ, Криксиван. Эта реакция дала 97% ее с TON и TOF 1000 и 480 ч.−1, соответственно. Это одна из немногих известных реакций гидрирования гомогенного гетероарена. Объемные группы R увеличивают эффективность катализатора.[27][28]
5) Асимметричный синтез производных хроманоилпиридина
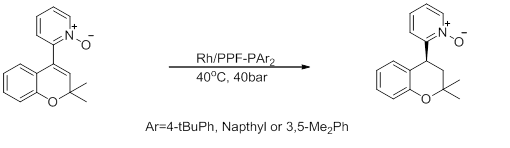
Рисунок 9: Асимметричный синтез производных хроманоилпиридина[29]
Эта реакция показывает промежуточное соединение для синтеза производного хроманоилпиридина, используемого для роста волос и в качестве антигипертензивного средства. Эта реакция протекает с высокой энантиоселективностью, но низкой активностью.
Другие реакции, в которых могут быть использованы лиганды Josiphos: гидрирование связей C == C, гидрирование C == N, C == C и C == O, катализируемое аллильное замещение, гидрокбоксилирование, присоединение Михаэля, аллильное алкилирование, реакция Хека, раскрытие цикла оксабициклов, изомеризация аллиламинов и аллильное замещение.
Рекомендации
- ^ а б c [3] H-U. Blaser, W. Brieden, B. Pugin, F. Spindler, M. Studer и A. Togni, Top. Катал., 2002, 19, 3.
- ^ Привилегированные хиральные лиганды и катализаторы Ци-Линь Чжоу 2011
- ^ [3] H-U. Blaser, W. Brieden, B. Pugin, F. Spindler, M. Studer и A. Togni, Top. Катал., 2002, 19, 3.
- ^ [1] Спессард, Гэри и Мисслер, Гэри (2010). Металлоорганическая химия: второе издание. С. 378-379.
- ^ [2] Эльшенбройх, Кристофер (2006). Металлоорганические соединения: Третье издание. стр.518-519
- ^ [Togni, Chimia., 1996, 50, 86.
- ^ Ито, М. Савамура и Т. Хаяси, J. Am. Chem. Soc. 1986, 108, 6405.
- ^ Спессард, Гэри и Мисслер, Гэри (2010). Металлоорганическая химия: второе издание. С. 378-379.
- ^ H-U. Blaser, W. Brieden, B. Pugin, F. Spindler, M. Studer и A. Togni, Top. Катал., 2002, 19, 3.
- ^ [20]http://www2.chemistry.msu.edu/faculty/wulff/myweb26/Literature_pdf/2009-04-10%20Aman.pdf
- ^ Littke, A.F и Fu, GG, Angew. Chem. Int. Изд., 2002, 41, 4176.
- ^ [17] Цай, К., Ривера, Н.Р., Бальселлс, Дж., Сидлер, Р.С., М.К. Уильямс, Дж. К., Шульц, К.С. и Сан Y, Org. Письма, 2006, 8, 5161
- ^ [18] Лиммерт, М.Е., Рой., А.Дж., Хартвиг Дж. Ф., J. Org. Chem., 2005, 70, 9364
- ^ [19] Альваро, Э. и Хартвиг, Дж. Ф., J. Am. Chem. Soc., 2009, 131, 7858
- ^ а б c Чжоу Q.L, (2011). Привилегированные хиральные лиганды и катализатор. стр.93-127
- ^ Томмен, М. и Бласр, H.U Pharma Chem, 2002, 33-34.
- ^ Blaser, H.U., Malan, C., Pugin, B., Spindler, F., Steiner, H., and Studer, M, 2003. Adv. Synth. Катал, 345, 103–152
- ^ [11] Whitesell, J.K Chem. Rev ,. 1989, 89, 1581
- ^ Иногути К., Сакураба С. и Ачива К. Синлетт, 1992, стр. 169
- ^ [13] Чен, В. и Блазер, Х.У., 2008 в трехвалентных соединениях фосфора в Asymmetric Catalyst: Synthesis and applications. (e.d. A. Borner) стр. 359-393.
- ^ [10] Чжоу Q.L, (2011). Привилегированные хиральные лиганды и катализатор. стр.93-127
- ^ [4] A.Togni, Chimia., 1996, 50, 86.
- ^ [5] Т. Хаяси, Комплексный асимметричный катализатор, ред. E.N. Якобсен, А. Пфальц и Х. Ямамото, 1999, стр. 247
- ^ H.U. Блазер, Х. Базза, Х. Jalett, B. Pugin и F. Spindler, Synlett. 1999, 867
- ^ [21] Godard, C., Ruiz, A., and Claver C. Helv. Чим. Акта, 2006, 89, 1610
- ^ [6] Х.У. Блазер, Х. Базза, Х. Jalett, B. Pugin и F. Spindler, Synlett. 1999, 867
- ^ [22] R.Fuchs, EP 803502 (1996) передан Lonza A.G.
- ^ [23] M.Studer, C. Wedemeyer-Exl, F.Spindler, H.U Blaser, Monatsh. Chem, 2000, 131, 1335
- ^ [7] Э. Broger, Y. Crameri and P. Jones, WO 99/01 453. (1997), передано Hoffman-La Roche
