Правила Грина – Дэвиса – Минго - Green–Davies–Mingos rules
В металлоорганическая химия, то Правила Грина – Дэвиса – Минго предсказывать региохимия за нуклеофильное присоединение к 18 электронам металлические комплексы содержащие несколько ненасыщенных лиганды.[1] Правила были опубликованы в 1978 году химиками-металлоорганиками. Стивен Дж. Дэвис, Малькольм Грин, и Майкл Мингос. Они описывают, как и где ненасыщенные углеводороды обычно становятся более восприимчивыми к нуклеофильная атака при комплексообразовании.[1]
Правило 1
Нуклеофильная атака предпочтительна для полиенов с четными номерами (даже осязание ).[1]

Правило 2
Нуклеофилы предпочтительно присоединяются к ациклическим полиенам, а не к циклическим полиенам.[1]

Правило 3
Нуклеофилы предпочтительно присоединяются к полиеновым лигандам с равномерной тактильностью на конце.[1]Нуклеофилы добавляют к ациклическим полиеновым лигандам с нечетной тактильностью в концевом положении, если металл является высоко электрофильным, в противном случае они добавляют во внутреннем сайте.
Упрощенное: четное перед нечетным и открытие перед закрытым
На следующей диаграмме показаны тенденции реактивности четных / нечетных тактильных ощущений и открытых / закрытых π-лигандов.
Металлический центр - электроноакцепторный. Этот эффект усиливается, если металл также присоединен к карбонилу. Металлы с низким содержанием электронов плохо связываются с карбонилом. Чем больше электронов акцептирует металл, тем более тройной характер связи имеет лиганд CO. Это дает лиганду более высокую константу силы. Результирующая силовая константа, найденная для лигированного карбонила, представляет собой такую же силовую константу для π-лигандов, если они заменяют CO-лиганд в том же комплексе.
Нуклеофильное добавление не происходит, если kCO * (эффективная силовая константа для лиганда CO) ниже порогового значения. [2]
На следующем рисунке показан лигированный металл, присоединенный к карбонильной группе. Эта группа имеет частичный положительный заряд и, следовательно, подвержена нуклеофильной атаке. Если лиганд, представленный Lп были π-лигандом, он также был бы активирован в направлении нуклеофильной атаки.
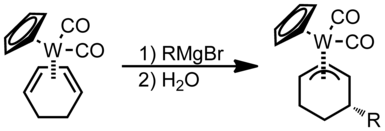
Входящая нуклеофильная атака происходит на одном из концов π-системы на рисунке ниже:
В этом примере кольцевую систему можно рассматривать как аналог 1,3-бутадиена. Следуя правилам Грина-Дэвиса-Мингоса, поскольку бутадиен является открытым π-лигандом с равномерной тактильностью, нуклеофильная атака будет происходить в одном из концевых положений π-системы. Это происходит потому, что НСМО бутадиена имеет большие доли на концах, а не на внутренних позициях.
Примеры комплексов
Ниже приводится пример комплекса, содержащего три типа π-лигандов, демонстрирующий преимущественную атаку нуклеофила на одну из π-систем.

Вышеупомянутый комплекс содержит три типа π-лигандов. Циклооктановое кольцо содержит бутадиеновый фрагмент слева и аллильный фрагмент справа. Циклопентадиеновый лиганд на кобальтовом центре дает третий тип.
Атака цианидного нуклеофила происходит преимущественно на конце бутадиенового фрагмента. (На рисунке выше показан неправильный продукт)
Следуя правилам, приведенным выше, бутадиеновый фрагмент является открытым лигандом с четной тактильностью, который имеет большую реактивность, чем аллильный фрагмент, открытый лиганд с нечетной тактильностью или циклопентадиен, закрытый лиганд с нечетной тактильностью.
Атака происходит на конце, что приводит к показанному конъюгированному продукту.
Внутренняя атака
Здесь лиганд, который уже прикреплен к металлу, действует как нуклеофил и атакует центр металла изнутри.[3][4]

Влияние типов лигандов на региохимию атаки
Нуклеофильная атака в терминальном положении аллил лиганды, когда π принимающий лиганд настоящее.[5]
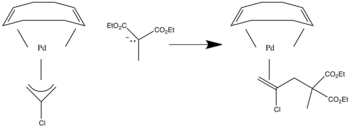
Если присутствуют сигма-донорные лиганды, они перекачивают электроны в лиганд, и атака происходит во внутренней позиции.

Эффекты асимметричных лигандов
Когда присутствуют асимметричные аллильные лиганды, атака происходит в более замещенном положении.[6]

В этом случае атака будет происходить на углероде с присоединенными к нему обеими группами R, поскольку это более замещенное положение.
Эффекты больших π-лигандов
Когда большие π-лиганды [7] присутствуют, они могут подвергаться различным видам нуклеофильных атак. На следующем рисунке нуклеофильная атака может происходить либо сверху, либо снизу и приводить к уменьшению двойной связи и добавлению нуклеофила.

Эта нуклеофильная атака может происходить либо сверху, либо снизу, и добавлять нуклеофил.
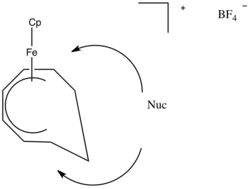
Использование в синтезе
Нуклеофильное присоединение к π-лигандам можно использовать в синтезе. Одним из примеров этого является получение циклических соединений металлов.[8] Нуклеофилы присоединяются к центру π-лиганда и образуют металлобутан.


Рекомендации
- ^ а б c d е Дэвис, Степен Г.; Грин, Малькольм Л. Х.; Минго, Д. Майкл П. (1978). «Нуклеофильное присоединение к катионам переходных металлов, содержащим ненасыщенные углеводородные лиганды: обзор и интерпретация». Тетраэдр. 34 (20): 3047–3077. Дои:10.1016 / 0040-4020 (78) 87001-X.
- ^ Буш Рассел С .; Анджеличи Роберт Дж. (1986). «Карбонил металла νCO силовые константы как предикторы реакционной способности комплексов π-этилена и π-бензола с нуклеофилами ». Журнал Американского химического общества. 108 (10): 2735–2742. Дои:10.1021 / ja00270a037.
- ^ Периана Рой А .; Бергман Роберт Г. (1984). «Быстрая внутримолекулярная перегруппировка комплекса гидридо (циклопропил) родия в родациклобутан. Независимый синтез металлацикла путем присоединения гидрида к центральному атому углерода катионного π-аллильного комплекса родия». Журнал Американского химического общества. 106 (23): 7272–7273. Дои:10.1021 / ja00335a084.
- ^ Судзуки, Томохиро; Окада, Горо; Хиоки, Ясунори; Фудзимото, Хироши (2003). «Теоретическое исследование реакционной способности комплексов (π-Аллил) молибдена». Металлоорганические соединения. 22 (18): 3649–3658. Дои:10.1021 / om0207459.
- ^ Араньос, Аттила; Szabó, Kálmán J .; Castaño, Ana M .; Бэквалль, Ян-Э. (1997). «Центральная и терминальная атака в нуклеофильном добавлении к комплексам (π-аллил) палладия. Эффекты лиганда и механизм». Металлоорганические соединения. 16 (5): 1058–1064. Дои:10.1021 / om960950m.
- ^ Delbecq, F .; Лапуж, К. (2000). «Региоселективность нуклеофильного добавления к (η3-аллил) Комплексы палладия. Теоретическое исследование ». Металлоорганические соединения. 19 (14): 2716–2723. Дои:10.1021 / om0003032.
- ^ Шёршузен, Соня; Хек, Юрген (2007). «Металл-опосредованные превращения циклооктатетраена в новые бициклические соединения с мостиковым метиленом». Металлоорганические соединения. 26 (22): 5386–5394. Дои:10.1021 / om700539e.
- ^ Периана, Рой А. (1986). «Углерод-углеродная активация органических соединений с малым кольцом путем расположения циклоалкилгидридородиевых комплексов в родациклоалканы. Синтез металлоциклобутанов, в том числе со связью третичный металл-углерод, путем нуклеофильного присоединения к π-аллильным комплексам». Журнал Американского химического общества. 108 (23): 7346–7355. Дои:10.1021 / ja00283a033.