Глиоксаль - Glyoxal
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Ethanedial | |||
| Другие имена Глиоксаль Оксальдегид Оксалальдегид | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.160 | ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C2ЧАС2О2 | |||
| Молярная масса | 58.036 г · моль−1 | ||
| Плотность | 1,27 г / см3 | ||
| Температура плавления | 15 ° С (59 ° F, 288 К) | ||
| Точка кипения | 51 ° С (124 ° F, 324 К) | ||
| Термохимия | |||
Теплоемкость (C) | 1,044 Дж / (К · г) | ||
| Опасности | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | -4 ° С (25 ° F, 269 К) | ||
| 285 ° С (545 ° F, 558 К) | |||
| Родственные соединения | |||
Связанный альдегиды | ацетальдегид гликолевый альдегид пропандиальный метилглиоксаль | ||
Родственные соединения | глиоксиловая кислота гликолевая кислота Щавелевая кислота пировиноградная кислота диацетил ацетилацетон | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Глиоксаль является органическое соединение с химическая формула ОЧЧО. Это самый маленький диальдегид (соединение с двумя альдегид группы). Это кристаллическое твердое вещество, белое при низких температурах и желтое около температура плавления (15 ° С). Жидкость желтая, а пар зеленый.[1]
Чистый глиоксаль обычно не встречается, поскольку он образует гидраты, который олигомеризовать. Для многих целей эти гидратированные олигомеры ведут себя аналогично глиоксалю. Он производится в промышленных масштабах как предшественник многих продуктов.[2]
Производство
Глиоксаль был впервые получен и назван немецко-британским химиком. Генрих Дебус (1824–1915), реагируя этиловый спирт с азотная кислота.[3][4]
Промышленный глиоксаль получают либо в газовой фазе. окисление из этиленгликоль в присутствии серебро или же медь катализатор (процесс Лапорта) или жидкофазным окислением ацетальдегид с азотная кислота.[2]
Первый коммерческий источник глиоксаля был в Ламот, Франция, начат в 1960 году. Самым крупным коммерческим источником является BASF в Людвигсхафен, Германия, около 60 000 тонн в год. Другие производственные площадки существуют также в США и Китае. Коммерческий массовый глиоксаль производится и описывается как раствор в воде с концентрацией 40%.
Лабораторные методы
Глиоксаль можно синтезировать в лаборатории путем окисления ацетальдегид с селеновая кислота.[5]
Безводный глиоксаль получают нагреванием твердого гидрата (ов) глиоксаля с пятиокись фосфора и конденсация паров в холодная ловушка.[6]
Характеристики
Экспериментально определенная Закон Генри константа глиоксаля составляет:
Биохимия

Конечные продукты с улучшенным гликированием (AGE) - это белки или липиды, которые становятся гликированный в результате диеты с высоким содержанием сахара.[8] Они являются биомаркером, участвующим в старении и развитии или ухудшении многих дегенеративные заболевания, Такие как сахарный диабет, атеросклероз, хроническая болезнь почек, и Болезнь Альцгеймера.[9]
Приложения
Бумага с покрытием и текстильная отделка использовать большое количество глиоксаля в качестве сшивающий агент за крахмал составы на основе. Он конденсируется с мочевина с получением 4,5-дигидрокси-2-имидазолидинона, который далее реагирует с формальдегид для получения бис (гидроксиметил) производного диметилол этиленмочевина, который используется для химической обработки одежды, устойчивой к появлению морщин, то есть постоянной печати.
Глиоксаль используется как солюбилизатор и сшивание агент в химия полимеров.
Глиоксаль - ценный строительный блок в органический синтез, особенно в синтезе гетероциклы Такие как имидазолы.[10] Удобной формой реагента для использования в лаборатории является его бис (полуацеталь) с этиленгликоль, 1,4-диоксан-2,3-диол. Это соединение коммерчески доступно.
Растворы глиоксаля также могут использоваться в качестве фиксатор за гистология, то есть метод сохранения клеток для изучения их под микроскопом.
Глиоксаль и его производные также используются в химическое зондирование структуры РНК, поскольку они реагируют со свободными гуанинами в РНК.[11]
Видообразование в растворе
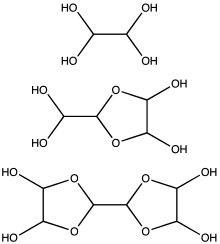
Глиоксаль обычно поставляется в виде 40% водного раствора.[2] Как и другие маленькие альдегиды, глиоксаль образует гидраты. Кроме того, гидраты конденсируются с образованием ряда олигомеров, структура некоторых из которых остается неопределенной. Для большинства приложений точная природа частиц в растворе не имеет значения. По крайней мере, один гидрат глиоксаля продается на рынке, дигидрат тримера глиоксаля: [(CHO)2]3(ЧАС2O)2 (CAS 4405-13-4). Доступны и другие эквиваленты глиоксаля, такие как полуацеталь этиленгликоля 1,4-диоксан-транс-2,3-диол (CAS 4845-50-5, m.p. 91–95 ° С),
По оценкам, при концентрациях менее 1M, глиоксаль существует преимущественно в виде мономера или его гидратов, то есть OCHCHO, OCHCH (OH)2, или (HO)2CHCH (ОН)2. При концентрациях выше 1 М преобладают димеры. Эти димеры, вероятно, диоксоланы, по формуле [(HO) CH]2О2ЧЧО.[12] Димеры и тримеры осаждаются в виде твердых веществ из холодных растворов.
Другие случаи
Глиоксаль наблюдался как след газа в атмосфере, например как продукт окисления углеводородов.[13] Тропосферный концентрации 0–200ppt по объему, в загрязненных регионах до 1 ppb по объему.[14]
Безопасность
В LD50 (перорально, крысы) составляет 3300 мг / кг, что очень много.[2]
Рекомендации
- ^ О'Нил, М.Дж. (2001): Индекс Merck, 13-е издание, стр. 803.
- ^ а б c d Маттиода, Жорж; Блан, Ален. «Глиоксаль». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a12_491.pub2.
- ^ Видеть:
- Х. Дебус (1857) «О действии азотной кислоты на спирт при обычных температурах». Философский журнал, 4-я серия, 13 : 39–49. С п. 40: «Этот остаток почти полностью состоял из альдегида глиоксиловой кислоты; я предложил назвать его Глиоксаль, С2ЧАС4О3."
- Х. Дебус (1857) «На глиоксале», Философский журнал, 4-я серия, 13 : 66.
- ^ Генри Энфилд Роско и Карл Шорлеммер, Трактат по химии, т. 3 (Нью-Йорк, Нью-Йорк: Д. Эпплтон и Ко, 1890), С. 101-102.
- ^ Ronzio, A.R .; Во, Т. Д. (1944). «Глиоксаль бисульфит». Органический синтез. 24: 61.; Коллективный объем, 3, п. 438
- ^ Harries, C .; Темме, Ф. (1907). "Убер мономолекуларес унд тримолекуларес глиоксаль" [О мономолекулярном и тримоэкулярном глиоксале]. Берихте. 40 (1): 165–172. Дои:10.1002 / cber.19070400124.
Man erhitzt nun das Glyoxal-Phosphorpentoxyd-Gemisch mit freier Flamme und beobachtet bald, dass sich unter Schwarzfärbung des Kolbeninhalte ein flüchtiges grünes Gas bildet, welches sich in der gekühltenöövölnde kölnder zu sch. [Нагревают смесь (сырого) глиоксаля и P4О10 с открытым пламенем и вскоре после почернения содержимого наблюдает подвижный зеленый газ, который конденсируется в охлажденной колбе в виде красивых желтых кристаллов.]
- ^ Ip, H. S .; Хуанг, X. H .; Ю., Дж. З. (2009). «Эффективные константы закона Генри для глиоксаля, глиоксиловой кислоты и гликолевой кислоты» (PDF). Geophys. Res. Латыш. 36 (1): L01802. Bibcode:2009GeoRL..36.1802I. Дои:10.1029 / 2008GL036212.
- ^ Голдин, Элисон; Бекман, Джошуа А .; Шмидт, Энн Мари; Крегер, Марк А. (2006). "Американская Ассоциация Сердца". Тираж. 114 (6): 597–605. Дои:10.1161 / CIRCULATIONAHA.106.621854. PMID 16894049.
- ^ Вистоли, G; Де Маддис, Д; Ципак, А; Жаркович, Н; Карини, М; Альдини, G (август 2013 г.). «Конечные продукты продвинутого гликоксидирования и липоксидирования (AGE и ALE): обзор механизмов их образования» (PDF). Свободный Радич. Res. 47: Дополнение 1: 3–27. Дои:10.3109/10715762.2013.815348. PMID 23767955. S2CID 207517855.
- ^ Snyder, H.R .; Handrick, R.G .; Брукс, Л. А. (1942). «Имидазол». Органический синтез. 22: 65.; Коллективный объем, 3, п. 471
- ^ Mitchell, D; Ричи, L; Парк, H; Бабицке, П; Ассманн, S; Бевилаква, П. (2017). "Глиоксали как структурные зонды РНК in vivo пары гуаниновых оснований". РНК. 24 (1): 114–124. Дои:10.1261 / rna.064014.117. ЧВК 5733565. PMID 29030489.
- ^ Уиппл, Э. Б. (1970). «Структура глиоксаля в воде». Варенье. Chem. Soc. 92 (24): 7183–7186. Дои:10.1021 / ja00727a027.
- ^ Врекоусси, М .; Wittrock, F .; Richter, A .; Берроуз, Дж. П. (2009). «Временная и пространственная изменчивость глиоксаля, наблюдаемая из космоса». Атмос. Chem. Phys. 9 (13): 4485–4504. Дои:10.5194 / acp-9-4485-2009.
- ^ Волкамер, Райнер; и другие. (2007). «Отсутствующий сток для газофазного глиоксаля в Мехико: образование вторичного органического аэрозоля». Geophys. Res. Латыш. 34 (19): 19. Bibcode:2007GeoRL..3419807V. Дои:10.1029 / 2007gl030752.



![{ displaystyle K _ { text {H}} = 4,19 times 10 ^ {5} times exp left [{ frac {6.22 times 10 ^ {4} , { text {kJ}} , { text {mol}} ^ {- 1}} {R}} times left ({ frac {1} {T}} - { frac {1} {298 , { text {K}}) }} right) right] , { text {M}} , { text {atm}} ^ {- 1}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/889cc6b8a3cb98f718253ccab840f434f2809fd5)