Криста - Crista
| Клеточная биология | |
|---|---|
| В митохондрия | |
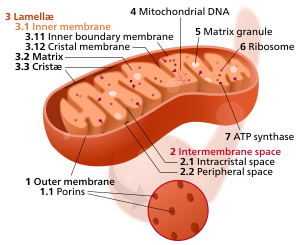 Компоненты типичной митохондрии
3 Ламели
4 Митохондриальная ДНК |
А Криста (/ˈkрɪsтə/; множественное число кристы) является складкой в внутренняя мембрана из митохондрия. Название происходит от латинского для гребень или шлейф, и он придает внутренней мембране характерную морщинистую форму, обеспечивая большое количество площадь поверхности за химические реакции происходить дальше. Это помогает аэробное клеточное дыхание, потому что митохондрии требуется кислород. Кристы усыпаны белки, в том числе АТФ-синтаза и множество цитохромы.
Фон
С открытием двоякой мембраны митохондрий пионеры митохондриальной ультраструктурный исследования предложили различные модели организации внутренней митохондриальной мембраны.[1] Были предложены три модели:
- Модель перегородки - Согласно с Palade (1953), внутренняя мембрана митохондрий извилистая, как перегородка, с широкими отверстиями во внутрикристальное пространство. Эта модель вошла в большинство учебников и долгое время считалась широко распространенной.
- Модель септы – Sjöstrand (1953) предположили, что листы внутренней мембраны натянуты как перегородки (множественное число от перегородка ) через матрицу, разделив ее на несколько отдельных отсеков.[2]
- Модель соединения Криста - Daems и Wisse (1966) предположили, что кристы соединяются с внутренней пограничной мембраной через трубчатые структуры, характеризующиеся довольно маленьким диаметром, называемые соединениями крист (CJ). Эти структуры были недавно открыты заново (2008 г.) с помощью ЭМ-томографии, что привело к созданию этой широко распространенной в настоящее время модели.[3]
Более недавнее исследование (2019 г.) обнаруживает ряды АТФ-синтаза димеры (ранее известные как «элементарные частицы» или «оксисомы»), образующиеся в кристах. Эти изгибающие мембраны димеры имеют изогнутую форму и могут быть первой ступенью к образованию крист.[4] Они расположены у основания кристы. Белковый комплекс системы организации крист (MICOS) в месте контакта митохондрий занимает соединение крист. Белки вроде OPA1 участвуют в ремоделировании крист.[5]
Криста традиционно разделяют по форме на пластинчатые, трубчатые и везикулярные кристы.[6] Они появляются в разных типах клеток. Обсуждается, возникают ли эти формы разными путями.[7]
Электронно-транспортная цепь крист

НАДН окисляется в НАД+, H+ ионы, и электроны по фермент. FADH2 также окисляется до H+ ионы, электроны и FAD. Как те электроны путешествовать дальше через электронная транспортная цепь во внутренней мембране энергия постепенно высвобождается и используется для перекачивания ионов водорода от расщепления НАДН и ФАДН.2 в пространство между внутренней и внешней мембраной (называемое межмембранное пространство ), создавая электрохимический градиент.
Этот электрохимический градиент создает потенциальную энергию (см. потенциальная энергия § химическая потенциальная энергия ) через внутреннюю митохондриальную мембрану, известную как протонодвижущая сила. Как результат, хемиосмос происходит, и фермент АТФ-синтаза производит АТФ из ADP и фосфатная группа. Это использует потенциальная энергия от градиента концентрации, образованного количеством H+ ионы. ЧАС+ ионы пассивно переходят в митохондриальную матрица с помощью АТФ-синтазы, а позже помогает реформировать H2О (вода).
В электронная транспортная цепь требует переменного количества электронов для правильного функционирования и выработки АТФ. Однако электроны, вошедшие в цепь переноса электронов, в конечном итоге будут накапливаться, как автомобили, едущие по заблокированной улице с односторонним движением. Эти электроны наконец принимаются кислород (O2). В результате они образуют две молекулы воды (ЧАС2О). Принимая электроны, кислород позволяет цепи переноса электронов продолжать функционировать. Цепь организована в мембране просвета крист, то есть мембране внутри соединения.[5]
Электроны от каждой молекулы НАДН могут образовывать в общей сложности 3 АТФ из АДФ и фосфатных групп через цепь переноса электронов, в то время как каждый ФАДН2 молекула может производить в общей сложности 2 АТФ.
В результате 10 молекул НАДН (от гликолиз и Цикл Кребса ), вместе с 2 FADH2 молекул, могут образовывать в общей сложности 34 АТФ во время аэробного дыхания (от одной цепи переноса электронов). Это означает, что в сочетании с циклом Кребса и гликолиз, эффективность цепи переноса электронов составляет около 65% по сравнению с эффективностью только 3,5% для одного гликолиза.
Функция
Кристы значительно увеличивают площадь поверхности внутренняя мембрана на котором могут иметь место вышеупомянутые реакции. Широко принятая гипотеза о функции крист заключается в том, что большая площадь поверхности позволяет увеличить способность к генерации АТФ. Однако текущая модель такова, что АТФ-синтаза Комплексы локализуются преимущественно в димерах на узких краях крист. Таким образом, площадь поверхности митохондриальных мембран, отнесенная к АТФ-синтазам, на самом деле довольно скромна.
Математическое моделирование показало, что оптические свойства крист в нитчатых митохондриях могут влиять на генерацию и распространение света в ткани.[8]
Рекомендации
- ^ Griparic, L; ван дер Блик, AM (август 2003 г.). «Множество форм митохондриальных мембран». Движение. 2 (4): 235–44. Дои:10.1034 / j.1600-0854.2001.1r008.x. PMID 11285133. S2CID 9500863.
- ^ Sjostrand, F (3 января 1953 г.). «Системы двойных мембран в цитоплазме некоторых тканевых клеток». Природа. 171 (4340): 31–32. Дои:10.1038 / 171031a0.
- ^ Зик, М; Rabl, R; Райхерт, AS (январь 2009 г.). «Ультраструктура и функция митохондрий, соединяющая образование крист». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1793 (1): 5–19. Дои:10.1016 / j.bbamcr.2008.06.013. PMID 18620004.
- ^ Блюм Т. Б., Хан А., Мейер Т., Дэвис К. М., Кюльбрандт В. (март 2019 г.). «Димеры митохондриальной АТФ-синтазы вызывают искривление мембраны и самоорганизуются в ряды». Труды Национальной академии наук Соединенных Штатов Америки. 116 (10): 4250–4255. Дои:10.1073 / pnas.1816556116. ЧВК 6410833. PMID 30760595.
- ^ а б Бейкер, Николь; Патель, Джил; Хачо, Мирей (ноябрь 2019). «Связь митохондриальной динамики, ремоделирования крист и образования суперкомплексов: как структура митохондрий может регулировать биоэнергетику». Митохондрия. 49: 259–268. Дои:10.1016 / j.mito.2019.06.003. PMID 31207408.
- ^ Ханаки М., Танака К., Кашима Ю. (1985). «Сканирующее электронно-микроскопическое исследование митохондриальных крист в коре надпочечников крыс». Журнал электронной микроскопии. 34 (4): 373–380. PMID 3837809.
- ^ Стефан, Тилль; Рош, Аксель; Ридель, Дитмар; Якобс, Стефан (27 августа 2019 г.). "STED-наноскопия живых клеток митохондриальных крист". Научные отчеты. 9 (1): 12419. Дои:10.1038 / s41598-019-48838-2. ЧВК 6712041. PMID 31455826.
- ^ Тар, Р. и М. Кюль (2004). «Распространение электромагнитного излучения в митохондриях?». J. Теоретическая биология, 230(2), 261-270. [1]
