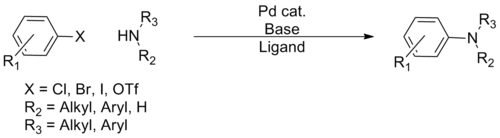Аминирование Бухвальда – Хартвига - Buchwald–Hartwig amination
Эта статья слишком полагается на Рекомендации к основные источники. (Август 2016 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Аминирование Бухвальда-Хартвига | |
|---|---|
| Названный в честь | Стивен Л. Бухвальд Джон Ф. Хартвиг |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | Бухвальд-Хартвиг-реакция |
| RSC ID онтологии | RXNO: 0000192 |
В Аминирование Бухвальда – Хартвига это химическая реакция используется в органическая химия для синтеза углеродно-азотные связи через реакции сочетания, катализируемые палладием аминов с арилгалогениды.[1] Хотя о соединениях C-N, катализируемых Pd, сообщалось еще в 1983 году, Стивен Л. Бухвальд и Джон Ф. Хартвиг были указаны, чьи публикации в период с 1994 г. по конец 2000-х гг. установили масштабы преобразований. Синтетическая полезность реакции в первую очередь связана с недостатками типичных методов (нуклеофильное замещение, восстановительное аминирование и т.д.) для синтеза ароматических связей C – N, причем большинство методов страдают от ограниченного объема субстрата и толерантности к функциональным группам.[2] Развитие реакции Бухвальда-Хартвига позволило легко синтезировать ариламины, заменив в некоторой степени более жесткие методы ( Реакция Гольдберга, нуклеофильное ароматическое замещение и т. д.), значительно расширяя репертуар возможных образований связи C – N.[нужна цитата ]
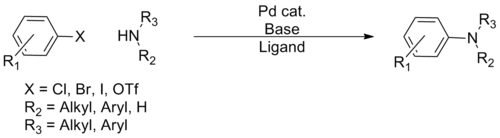
(Уравнение 1)
В ходе его разработки было разработано несколько «поколений» каталитических систем, каждая из которых допускает больший диапазон с точки зрения партнеров для связывания и более мягких условий, позволяя связывать практически любой амин с широким спектром арильных партнеров для связывания.[нужна цитата ] Из-за повсеместного распространения арил-C-N-связей в фармацевтических препаратах и натуральные продукты, реакция получила широкое применение в синтетической органической химии, с применением во многих общий синтез и промышленное изготовление множества фармацевтических препаратов.
История
Первый пример катализируемой палладием реакции кросс-сочетания C – N был опубликован в 1983 году Migita и соавторами и описал реакцию между несколькими арилбромидами и N, N-диэтиламино-трибутилом.банка с использованием 1 мол.% PdCl2[П (о-толил)3]2. Хотя было протестировано несколько арилбромидов, только электронно нейтральный, стерически необремененный субстраты давали урожай от хорошего до отличного.[3]

(Уравнение 2)
В 1984 г. Дейл Л. Богер и Джеймс С. Панек сообщили о примере образования связи C – N, опосредованного Pd (0), в контексте своей работы по синтезу лавендамицина, в котором используются стехиометрические Pd (PPh3)4. Попытки сделать реакцию каталитической не увенчались успехом.[4]

(Уравнение 3)
Эти отчеты практически не цитировались в течение десяти лет. В феврале 1994 года Хартвиг сообщил о систематическом исследовании соединений палладия, включенных в оригинальную статью Migita, заключив, что d10 комплекс Pd [P (o-Tolyl)3]2 был активным катализатором. Предложен каталитический цикл с участием окислительная добавка бромистого арил.[5]
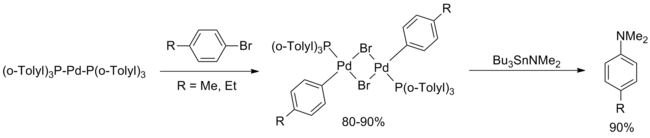
(Уравнение 4)
В мае 1994 года Бухвальд опубликовал расширение статьи Migita, предлагающее два основных улучшения по сравнению с исходной статьей. Первый, трансаминирование Бу3SnNEt2 с последующим аргон очистить, чтобы удалить летучие диэтиламин позволили распространить методологию на множество вторичные амины (как циклические, так и ациклические) и первичные анилины. Во-вторых, выход аренов с высоким и низким содержанием электронов был улучшен за счет незначительных модификаций процедуры реакции (более высокая загрузка катализатора, более высокая температура, более длительное время реакции), хотя орто -замещенные арильные группы были включены в эту публикацию.[6]

(Уравнение 5)
В 1995 году непрерывные исследования в каждой лаборатории показали, что связывание можно проводить со свободными аминами в присутствии объемного основание (NaOtBu в публикации Бухвальда, LiHMDS в публикации Хартвига), что позволяет оловоорганическое вещество -без муфта. Хотя эти улучшенные условия протекали быстрее, объем субстрата был почти полностью ограничен вторичными аминами из-за конкуренции гидродегалогенирование бромаренов.[7][8] (Видеть Механизм ниже)

(Уравнение 6)
Эти результаты позволили создать так называемое «первое поколение» каталитических систем Бухвальда – Хартвига. В последующие годы были разработаны более сложные фосфин лиганды это позволило расширить спектр аминов и арильных групп до большего количества. Арил йодиды, хлориды, и трифлаты в конечном итоге стали подходящими субстратами, и были разработаны реакции, протекающие с более слабыми основаниями при комнатной температуре. Эти достижения подробно описаны в Объем раздел ниже, и распространение на более сложные системы остается активной областью исследований.
Механизм
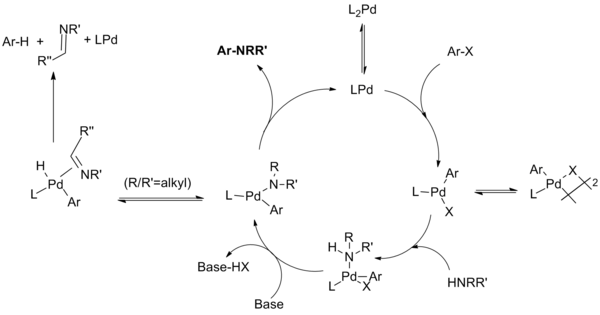
В механизм реакции поскольку эта реакция, как было показано, протекает через стадии, аналогичные тем, которые известны для катализируемых палладием реакций сочетания C-C. Этапы включают окислительное добавление арилгалогенида к разновидностям Pd (0), добавление амина к окислительному аддитивному комплексу, депротонирование с последующим восстановительное устранение. Непродуктивная побочная реакция может конкурировать с восстановительным отщеплением, когда амид подвергается отщеплению бета-гидрида с образованием гидродегалогенированного арена и я добываю товар.[9]
На протяжении всего развития реакции группа стремилась идентифицировать промежуточные продукты реакции посредством фундаментальных механистических исследований. Эти исследования выявили различные пути реакции в зависимости от того, монодентатный или же хелатирующий в реакции используются фосфиновые лиганды, и был выявлен ряд нюансов (особенно в отношении диалкилбиарилфосфиновые лиганды разработан Бухвальдом).
Каталитический цикл протекает следующим образом:[10][11][12][13]
(Уравнение 7)
Для монодентатных лигандных систем частицы монофосфин-палладия (0), как полагают, образуют частицы палладия (II), которые находятся в равновесие с димером μ-галогена. Стабильность этого димера снижается в порядке X = I> Br> Cl, и считается, что он ответственен за медленную реакцию арилиодидов с каталитической системой первого поколения. Лигирование амина с последующим депротонированием основанием дает амид палладия. (Было показано, что хелатирующие системы проходят эти две стадии в обратном порядке, при этом образование комплекса с основанием предшествует образованию амида.) Этот ключевой промежуточный продукт восстанавливается с образованием продукта и регенерацией катализатора. Однако может происходить побочная реакция, при которой отщепление β-гидрида с последующим восстановительным отщеплением дает гидродегалогенированный арен и соответствующий имин. Не показаны дополнительные равновесия, в которых различные промежуточные соединения координируются с дополнительными фосфиновыми лигандами на различных стадиях каталитического цикла.
Для хелатирующих лигандов разновидности монофосфин-палладия не образуются; окислительное присоединение, образование амида и восстановительное отщепление происходят из L2Комплексы Pd. Группа Хартвига обнаружила, что «восстановительное отщепление может происходить либо из четырехкоординированного бисфосфинового, либо из трехкоординированного амидокомплекса монофосфина арилпалладий. Удаление из трехкоординированных соединений происходит быстрее. Во-вторых, отщепление β-водорода происходит из трехкоординированного промежуточного соединения. Следовательно, отщепление β-водорода происходит медленно из комплексов арилпалладия, содержащих хелатирующие фосфины, в то время как восстановительное отщепление все еще может происходить из этих четырехкоординированных частиц ».[14]
Заявление
Из-за повсеместного распространения арил-C-N-связей в фармацевтических препаратах и натуральные продукты, реакция получила широкое применение в синтетической органической химии, с применением во многих общий синтез и промышленное изготовление множества фармацевтических препаратов.[22]Промышленное применение включает α-арилирование карбонильных соединений (таких как кетоны, сложные эфиры, амиды, альдегиды) и нитрилов.[23]
Объем
Хотя объем аминирования Бухвальда-Хартвига был расширен за счет включения широкого спектра арильных и аминных партнеров связывания, условия, необходимые для любых конкретных реагентов, все еще в значительной степени зависят от субстрата. Были разработаны различные системы лигандов, каждая с различными возможностями и ограничениями, и выбор условий требует учета стерических и электронных свойств обоих партнеров. Ниже подробно описаны субстраты и условия для основных поколений лигандных систем. (Здесь не включены N-гетероциклический карбен лиганды и лиганды с широким углы прикуса Такие как Ксантфос и Спанфос которые также были значительно развиты.)[9]
Каталитическая система первого поколения
Первое поколение (Pd [P (o-Tolyl)3]2) каталитическая система оказалась эффективной для сочетания как циклических, так и ациклических вторичных аминов, несущих как алкильную, так и арильную функциональность (но не диариламинов), с различными арилбромидами. Как правило, эти условия не позволяли связывать первичные амины из-за конкурентного гидродегалогенирования арена.[7][8]
Арилиодиды оказались подходящими субстратами для внутримолекулярный вариант этой реакции,[8] и, что немаловажно, можно было соединить межмолекулярно только если диоксан использовался вместо толуола в качестве растворителя, хотя и со скромными выходами.[24]

Бидентатные фосфиновые лиганды
Развитие дифенилфосфинобинафтил (БИНАП) и дифенилфосфиноферроцен (DPPF) в качестве лигандов для аминирования Бухвальда-Хартвига обеспечили первое надежное расширение первичных аминов и позволили эффективно связывать арилиодиды и трифлаты. (Считается, что бидентатные лиганды предотвращают образование димера иодида палладия после окислительного добавления, ускоряя реакцию.) Эти лиганды обычно производят связанные продукты с более высокими скоростями и лучшими выходами, чем катализаторы первого поколения. Первоначальные сообщения об этих лигандах как катализаторах были несколько неожиданными, учитывая механистические доказательства монолигированных комплексов, служащих активными катализаторами в системе первого поколения. Фактически, первые образцы из обеих лабораторий были опубликованы в одном номере журнала. JACS.[25][26][27]

(Уравнение 8)
В хелатирование из этих лигандов, как полагают, подавляет отщепление β-гидрида за счет предотвращения открытого координационного сайта. Фактически, было обнаружено, что α-хиральные амины не рацемизируются при использовании хелатирующих лигандов, в отличие от каталитической системы первого поколения.[28]

(Уравнение 9)
Стерически затрудненные лиганды
Было показано, что объемные три- и диалкилфосфиновые лиганды являются чрезвычайно активными катализаторами, позволяющими сочетать широкий спектр аминов (первичных, вторичных, электроноакцепторных, гетероциклических и т. Д.) С арилхлоридами, бромидами, йодидами и трифлатами. . Кроме того, реакции с использованием гидроксид, карбонат, и фосфат вместо традиционных оснований алкоксида и силиламида были разработаны основания. Группа Buchwald разработала широкий спектр диалкилбиарилфосфиновые лиганды, а группа Хартвига сосредоточила свое внимание на ферроцен -производные и триалкилфосфиновые лиганды.[29][30][31][32][33][34]

(Уравнение 10)
Резкое увеличение активности, наблюдаемое с этими лигандами, объясняется их склонностью стерически отдавать предпочтение монолигированным частицам палладия на всех стадиях каталитического цикла, резко увеличивая скорость окислительного добавления, образования амида и восстановительного удаления. Некоторые из этих лигандов также, по-видимому, увеличивают скорость восстановительного элиминирования по сравнению с элиминированием β-гидрида посредством электронодонорного взаимодействия арен-палладий.[19][20]
Даже электроноакцепторные амины и гетероциклические субстраты могут быть связаны в этих условиях, несмотря на их тенденцию дезактивировать палладиевый катализатор.[35][36]

(Уравнение 11)
Аммиачные эквиваленты
Аммиак остается одним из наиболее сложных партнеров для реакций аминирования Бухвальда – Хартвига, проблема связана с его прочным связыванием с комплексами палладия. Для решения этой проблемы было разработано несколько стратегий на основе реагентов, которые служат эквивалентами аммиака. Использование бензофенон имин или силиламид может преодолеть это ограничение с последующим гидролизом с получением первичного анилин.[37][38][39]
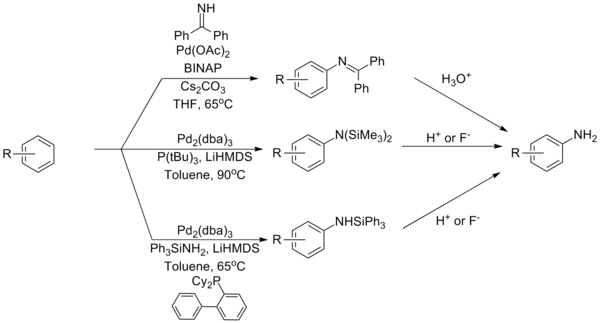
(Уравнение 12)
Каталитическая система, которая может напрямую связывать аммиак с использованием лиганда типа Josiphos.[40]
Варианты муфт C-N: муфты C-O, C-S и C-C
В условиях, аналогичных тем, которые используются для аминирования, спирты и может быть соединен с арилгалогенидами с получением соответствующих арил эфиры. Это служит удобной заменой более жестким аналогам этого процесса, таким как Конденсация Ульмана.[41][42]

(Уравнение 13)
Тиолы и тиофенолы могут быть связаны с арилгалогенидами в условиях типа Бухвальда-Хартвига с получением соответствующих арилтиоэфиров. Кроме того, меркаптоэфиры использовались как H2S-эквиваленты для получения тиофенола из соответствующего арилгалогенида.[43]
Енолаты и другие подобные углеродные нуклеофилы также могут быть связаны с образованием α-арилкетонов, малонатов, нитрилов и т. Д. Масштабы этой трансформации также зависят от лиганда, и был разработан ряд систем.[44] Для этого процесса было разработано несколько энантиоселективных методов.[45][46]

(Уравнение 14)
Несколько вариантов реакции с использованием комплексов медь и никель а не палладий.[18]
Рекомендации
- ^ Forero-Cortés, Paola A .; Гайдл, Александр М. (2 июля 2019 г.). «25-летие Аминации Бухвальда – Хартвига: разработка, приложения и перспективы». Исследования и разработки в области органических процессов. 23 (8): 1478–1483. Дои:10.1021 / acs.oprd.9b00161.
- ^ Вейганд, Конрад (1972). Hilgetag, G .; Мартини, А. (ред.). Препаративная органическая химия Weygand / Hilgetag (4-е изд.). Нью-Йорк: John Wiley & Sons, Inc., стр. 461. ISBN 0471937495.
- ^ Kosugi, M .; Камеяма, М .; Мигита, Т. (1983), "Катализируемое палладием ароматическое аминирование арилбромидов с помощью н-ди-этиламино-трибутилолова", Письма по химии, 12 (6): 927–928, Дои:10.1246 / cl.1983.927
- ^ Boger, D.L .; Панек, Дж. (1984), «Палладий (0) - опосредованный синтез β-карболина: получение кольцевой системы CDE лавендамицина», Буквы Тетраэдра, 25 (30): 3175–3178, Дои:10.1016 / S0040-4039 (01) 91001-9
- ^ Paul, F .; Patt, J .; Хартвиг, Дж. Ф. (1994), "Катализируемое палладием образование связей углерод-азот. Промежуточные продукты реакции и усовершенствования катализатора при гетероперекрестном взаимодействии арилгалогенидов и амидов олова", Варенье. Chem. Soc., 116 (13): 5969–5970, Дои:10.1021 / ja00092a058
- ^ Гурам, A.S .; Бухвальд, С. (1994), "Катализируемые палладием ароматические амины с аминостаннанами, полученными in situ", Варенье. Chem. Soc., 116 (17): 7901–7902, Дои:10.1021 / ja00096a059
- ^ а б Луи, Дж .; Хартвиг, Дж. Ф. (1995), "Катализируемый палладием синтез ариламинов из арилгалогенидов. Механические исследования приводят к сочетанию в отсутствие реагентов олова", Буквы Тетраэдра, 36 (21): 3609–3612, Дои:10.1016 / 0040-4039 (95) 00605-C
- ^ а б c Гурам, A.S .; Rennels, R.A .; Бухвальд, С. (1995), "Простой каталитический метод превращения арилбромидов в ариламины", Angewandte Chemie International Edition, 34 (12): 1348–1350, Дои:10.1002 / anie.199513481
- ^ а б c Muci, A.R .; Бухвальд, С. (2002), "Практические палладиевые катализаторы для образования связей C-N и C-O", Темы в Curr. Chem., Темы современной химии, 219: 131–209, Дои:10.1007 / 3-540-45313-x_5, ISBN 978-3-540-42175-7
- ^ Водитель, M.S .; Хартвиг, Дж. Ф. (1997), "Восстановительное удаление ариламинов из фосфиновых комплексов палладия (II), образующих углерод-азотные связи", Варенье. Chem. Soc., 119 (35): 8232–8245, Дои:10.1021 / ja971057x
- ^ Hartwig, J.F .; Richards, S .; Barañano, D .; Пол, Ф. (1996), «Влияние на относительные скорости восстановительного удаления амидов, образующих C − N-связь, и удаления амидов с β-водородом. Тематическое исследование происхождения конкурирующего восстановления при катализируемом палладием аминировании арилгалогенидов» , Варенье. Chem. Soc., 118 (15): 3626–3633, Дои:10.1021 / ja954121o
- ^ Водитель, M.S .; Хартвиг, Дж. Ф. (1995), "Редкий низковалентный алкиламидный комплекс, дифениламидный комплекс и их восстановительное отщепление аминов трехкоординатными промежуточными соединениями", Варенье. Chem. Soc., 117 (16): 4708–4709, Дои:10.1021 / ja00121a030
- ^ Widenhoefer, R.A .; Бухвальд, С. (1996), "Влияние галогенидов и амина на равновесное образование трис (о-толил) фосфинмоно (амин) комплексов палладия из димеров арилгалогенида палладия", Металлоорганические соединения, 15 (12): 2755–2763, Дои:10.1021 / om9509608
- ^ а б Хартвиг, Дж. Ф. (1999), "Подходы к открытию катализатора. Образование новых углерод-гетероатомов и углерод-углеродных связей", Pure Appl. Chem., 71 (8): 1416–1423, Дои:10.1351 / pac199971081417, S2CID 34700080
- ^ Хартвиг, Дж. Ф. (1997), "Катализируемое палладием аминирование арилгалогенидов: механизм и рациональный дизайн катализатора", Synlett, 1997 (4): 329–340, Дои:10.1055 / с-1997-789
- ^ Хартвиг, Дж. Ф. (1998), "Восстановительное удаление аминов, простых эфиров и сульфидов, образующих связь углерод-гетероатом", Соотв. Chem. Res., 31: 852–860, Дои:10.1021 / ar970282g
- ^ Wolfe, J.P .; Wagaw, S .; Marcoux, J.F .; Бухвальд, С. (1998), "Рациональная разработка практических катализаторов образования ароматических углерод-азотных связей", Соотв. Chem. Res., 31: 805–818, Дои:10.1021 / ar9600650
- ^ а б Хартвиг, Дж. Ф. (1998), "Катализируемый переходными металлами синтез ариламинов и ариловых эфиров из арилгалогенидов и трифлатов: объем и механизм", Энгью. Chem. Int. Эд., 37 (15): 2046–2067, Дои:10.1002 / (sici) 1521-3773 (19980817) 37:15 <2046 :: aid-anie2046> 3.0.co; 2-l
- ^ а б Хартвиг, Дж. Ф. (2008), "Развитие катализатора четвертого поколения для аминирования и тиоэтерификации арилгалогенидов", Соотв. Chem. Res., 41 (11): 1534–1544, Дои:10.1021 / ar800098p, ЧВК 2819174, PMID 18681463
- ^ а б Surry, D.S .; Бухвальд, С. (2008), "Биарилфосфановые лиганды в аминировании, катализируемом палладием", Энгью. Chem. Int. Эд., 47 (34): 6338–6361, Дои:10.1002 / anie.200800497, ЧВК 3517088, PMID 18663711
- ^ Surry, D.S .; Бухвальд, С. (2011), «Диалкилбиарилфосфины в Pd-катализируемом аминировании: руководство пользователя», Chem. Sci., 2 (1): 27–50, Дои:10.1039 / c0sc00331j, ЧВК 3306613, PMID 22432049
- ^ [15][16][14][9][17][18][19][20][21]
- ^ Томас Дж. Колакот. Нобелевская премия по химии 2010 года: перекрестное взаимодействие, катализируемое палладием. Платиновые металлы Ред., 2011, 55, (2) doi: 10.1595 / 147106711X558301
- ^ Wolfe, J. P .; Бухвальд, С. Л. (1996), "Катализируемое палладием аминирование арил йодидов", J. Org. Chem., 61 (3): 1133–1135, Дои:10.1021 / jo951844h
- ^ Водитель, M.S .; Хартвиг, Дж. Ф. (1996), «Катализатор второго поколения для аминирования арилгалогенидов: смешанные вторичные амины из арилгалогенидов и первичных аминов, катализируемые (DPPF) PdCl2», Варенье. Chem. Soc., 118 (30): 7217–7218, Дои:10.1021 / ja960937t
- ^ Wolfe, J.P .; Wagaw, S .; Бухвальд, С. (1996), «Улучшенная каталитическая система для образования ароматических углерод-азотных связей: возможное участие бис (фосфин) палладиевых комплексов в качестве ключевых промежуточных продуктов», Варенье. Chem. Soc., 118: 7215–7216, Дои:10.1021 / ja9608306
- ^ Луи, Дж .; Водитель, M.S .; Hamann, B.C .; Хартвиг, Дж. Ф. (1997), "Катализированное палладием аминирование арилтрифлатов и важность скорости добавления трифлата", J. Org. Chem., 62 (5): 1268–1273, Дои:10.1021 / jo961930x
- ^ Wagaw, S .; Rennels, R.A .; Бухвальд, С. (1997), "Катализируемое палладием связывание оптически активных аминов с арилбромидами", Варенье. Chem. Soc., 119 (36): 8451–8458, Дои:10.1021 / ja971583o
- ^ Old, D.W .; Wolfe, J.P .; Бухвальд, С. (1998), "Высокоактивный катализатор реакций перекрестного связывания, катализируемых палладием: муфты Сузуки при комнатной температуре и аминирование неактивированных арилхлоридов", Варенье. Chem. Soc., 120: 9722–9723, Дои:10.1021 / ja982250 +
- ^ Wolfe, J.P .; Бухвальд, С. (1999), "Высокоактивный катализатор для аминирования при комнатной температуре и связывания по Сузуки арилхлоридов", Энгью. Chem. Int. Эд., 38 (16): 2413–2416, Дои:10.1002 / (sici) 1521-3773 (19990816) 38:16 <2413 :: aid-anie2413> 3.0.co; 2 часа, PMID 10458806
- ^ Hamann, B.C .; Хартвиг, Дж. Ф. (1998), "Стерически затрудненные хелатирующие алкилфосфины обеспечивают большие ускорения скорости катализируемого палладием аминирования арилйодидов, бромидов и хлоридов и первого аминирования арилтозилатов", Варенье. Chem. Soc., 120 (29): 7369–7370, Дои:10.1021 / ja981318i
- ^ Wolfe, J.P .; Tomori, H .; Sadighi, J.P .; Инь, Дж .; Бухвальд, С. (2000), «Простая и эффективная система катализаторов для катализируемого палладием аминирования арилхлоридов, бромидов и трифлатов» (PDF), J. Org. Chem., 65 (4): 1158–1174, Дои:10.1021 / jo991699y, PMID 10814067
- ^ Stambuli, J.P .; Kuwano, R .; Хартвиг, Дж. Ф. (2002), "Беспрецедентная скорость активации арилхлоридов и бромидов: связывание с аминами и бороновыми кислотами за считанные минуты при комнатной температуре", Энгью. Chem. Int. Эд., 41 (24): 4746–4748, Дои:10.1002 / anie.200290036, PMID 12481346
- ^ Хуанг, X .; Anderson, K.W .; Zim, D .; Jiang, L .; Клапарс, А .; Бухвальд, С. (2003), "Расширение процессов образования связи C-N, катализируемых палладием: первое амидирование арилсульфонатов, водное аминирование и комплементарность реакциям, катализируемым медью", Варенье. Chem. Soc., 125 (22): 6653–6655, Дои:10.1021 / ja035483w, PMID 12769573
- ^ Anderson, K.W .; Tundel, R.E .; Икава, Т .; Altman, R.A .; Бухвальд, С. (2006), "Монодентатные фосфины обеспечивают высокоактивные катализаторы для катализируемых палладием реакций образования связей CN гетероароматических галогенидов / аминов и (H) N-гетероциклов", Энгью. Chem. Int. Эд., 45 (39): 6523–6527, Дои:10.1002 / anie.200601612, PMID 16955526
- ^ Икава, Т .; Barder, T.E .; Biscoe, M.R .; Бухвальд, С. (2007), «Катализируемые Pd амидии арилхлоридов с использованием монодентатных биарилфосфиновых лигандов: кинетические, вычислительные и синтетические исследования», Варенье. Chem. Soc., 129 (43): 13001–13007, Дои:10.1021 / ja0717414, PMID 17918833
- ^ Wolfe, J.P .; Ahman, J .; Sadighi, J.P .; Singer, R.A .; Бухвальд, С. (1997), «Аммиачный эквивалент для катализируемого палладием аминирования арилгалогенидов и трифлатов», Tetrahedron Lett., 38 (36): 6367–6370, Дои:10.1016 / S0040-4039 (97) 01465-2
- ^ Lee, S .; Jorgensen, M .; Хартвиг, Дж. Ф. (2001), «Катализируемый палладием синтез ариламинов из арилгалогенидов и бис (триметилсилил) амида лития в качестве аммиачного эквивалента», Орг. Lett., 3 (17): 2729–2732, Дои:10.1021 / ol016333y, PMID 11506620
- ^ Хуанг, X .; Бухвальд, С. (2001), "Новые эквиваленты аммиака для катализируемого Pd аминирования арилгалогенидов", Орг. Lett., 3 (21): 3417–3419, Дои:10.1021 / ol0166808, PMID 11594848
- ^ Vo, G.D .; Хартвиг, Дж. Ф. (2009), "Катализируемое палладием связывание аммиака с арилхлоридами, бромидами, йодидами и сульфонатами: общий метод получения первичных ариламинов", Варенье. Chem. Soc., 131 (31): 11049–11061, Дои:10.1021 / ja903049z, ЧВК 2823124, PMID 19591470
- ^ Mann, G .; Incarvito, C .; Rheingold, A.L .; Хартвиг, Дж. Ф. (1999), "Катализируемое палладием соединение C-O с участием неактивированных арилгалогенидов. Простерически индуцированное восстановительное удаление с образованием связи C-O в диариловых эфирах", Варенье. Chem. Soc., 121: 3224–3225, Дои:10.1021 / ja984321a
- ^ Torraca, K.E .; Хуанг, X .; Parrish, CA; Бухвальд, С. (2001), "Эффективный межмолекулярный катализируемый палладием синтез ариловых эфиров", Варенье. Chem. Soc., 123 (43): 10770–10771, Дои:10.1021 / ja016863p, PMID 11674023
- ^ Heesgaard Jepsen Вт (2011). «Синтез функционализированных дибензотиофенов - эффективный трехэтапный подход, основанный на катализируемых Pd образованиях связей C-C и C-S». Европейский журнал органической химии. 2011: 53–57. Дои:10.1002 / ejoc.201001393.
- ^ Калкин, Д.А.; Хартвиг, Дж. Ф. (2003), "Катализируемое палладием r-арилирование карбонильных соединений и нитрилов", Соотв. Chem. Res., 36 (4): 234–245, Дои:10.1021 / ar0201106, PMID 12693921
- ^ Hamada, T .; Chieffi, A .; Ahman, J .; Бухвальд, С. (2002), «Улучшенный катализатор асимметричного арилирования енолатов кетонов», Варенье. Chem. Soc., 124 (7): 1261–1268, Дои:10.1021 / ja011122 +, PMID 11841295
- ^ Ляо, X .; Weng, Z .; Хартвиг, Дж. Ф. (2008), «Энантиоселективное р-арилирование кетонов с арилтрифлатами, катализируемое дифторфосными комплексами палладия и никеля», Варенье. Chem. Soc., 130 (1): 195–200, Дои:10.1021 / ja074453g, ЧВК 2551326, PMID 18076166
внешняя ссылка
- Связка Бухвальда – Хартвига - Недавняя литература
- Аминирование Бухвальда – Хартвига - Синтетические протоколы из organic-reaction.com
- Buchwald – Hartwig Chemistry Встреча группы Иэна Мэнджиона Макмиллана 30 июля 2002 г. Связь
- Реакция Бухвальда – Хартвига Катализаторы на основе драгоценных металлов от Acros Organics для реакций сочетания в органическом синтезе Связь