Атропоизомер - Atropisomer

Атропоизомеры находятся стереоизомеры возникающий из-за затрудненного вращения вокруг одинарная облигация, куда энергия различия из-за стерическое напряжение или другие участники создают барьер для вращения это достаточно высоко, чтобы изолировать отдельные конформеры.[1][2]
Этимология и история
Слово атропоизомер (Греч., Άτροπος, atropos, что означает «без поворота») был придуман в применении к теоретической концепции немецким биохимиком Ричардом Куном для Карл Фройденберг основополагающий Стереохимия том 1933 г.[3] Атропоизомерия впервые была экспериментально обнаружена в тетразамещенном бифенил, а двухосновная кислота Джорджа Кристи и Джеймса Кеннера в 1922 году.[4] Мичинори Оки дополнительно уточнил определение атропоизомеров с учетом температурной зависимости, связанной с взаимопревращением конформеров, указав, что атропоизомеры взаимно превращаются период полураспада не менее 1000 секунд при данной температуре, что соответствует энергетическому барьеру 93 кДж моль−1 (22 ккал моль −1) при 300 К (27 ° С).[5][6]
Энергетика
Стабильность индивидуальных атропоизомеров обеспечивается отталкивающими взаимодействиями, которые ингибируют вращение. Свой вклад вносят как стерический объем, так и, в принципе, длина и жесткость связи, соединяющей две субъединицы.[1][6] Обычно атропоизомерию исследуют динамическим методом. ядерный магнитный резонанс спектроскопии, поскольку атропоизомерия - это форма текучесть.[6]Выводы из теория и результаты реакции, исходы и урожайность также вносят свой вклад.[7]
Атропоизомеры проявляют осевая хиральность (плоская хиральность ). Когда барьер для рацемизации высок, как показано БИНАП лигандов, явление приобретает практическое значение при асимметричном синтезе.
Стереохимическое присвоение

Определение аксиальной стереохимии биарилатропоизомеров может быть выполнено с использованием Проекция Ньюмана вдоль оси затрудненного вращения. В орто, а в некоторых случаях мета заместителям в первую очередь назначается приоритет на основе Правила приоритета Кана – Ингольда – Прелога. Одна схема номенклатуры основана на представлении о спиральности, определяемой этими группами.[8] Начиная с заместителя с наивысшим приоритетом в ближайшем кольце и двигаясь по кратчайшему пути к заместителю с наивысшим приоритетом в другом кольце, назначается абсолютная конфигурация п или Δ для часовой стрелки и M или Λ против часовой стрелки.[1] С другой стороны, все четыре группы могут быть ранжированы по правилам приоритета Кана – Ингольда – Прелога, при этом общий приоритет предоставляется группам на «переднем» атоме проекции Ньюмана. Две конфигурации называются ра и Sа по аналогии с традиционным р/S для традиционного тетраэдрического стереоцентра.[9]
Синтез
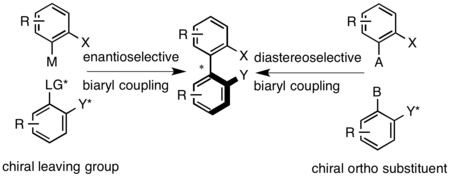
Аксиально хиральные биарильные соединения получают реакциями сочетания, например, Муфта Ульмана, Реакция Сузуки – Мияуры или катализируемое палладием арилирование аренов.[10] После синтеза рацемический биарил разделяется классическими методами. Диастереоселективное сцепление может быть достигнуто за счет использования хирального мостика, который связывает две арильные группы, или использования хирального вспомогательного соединения в одном из положений, проксимальных к осевому мостику. Энантиоселективное связывание может быть достигнуто за счет использования хиральной уходящей группы на одном из биарилов или в окислительных условиях, в которых используются хиральные амины для задания осевой конфигурации.[1]
Индивидуальные атропоизомеры могут быть выделены кристаллизацией рацематов с затравкой. Таким образом, 1,1'-бинафтил кристаллизуется из расплава в виде индивидуальных энантиомеров.[11][12][13]
Объем
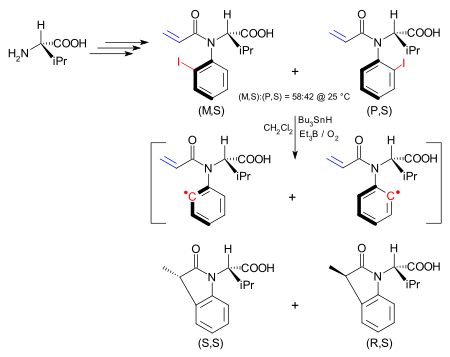


В одном приложении асимметрия в атропоизомере передается в результате химической реакции на новый стереоцентр.[14] Атропоизомер представляет собой йодарильное соединение, синтезируемое, исходя из (S) -валин и существует как изомер (M, S) и изомер (P, S). Барьер между ними составляет 24,3. ккал /моль (101.7 кДж / моль). Изомер (M, S) можно получить исключительно из этой смеси путем перекристаллизация из гексаны. Группа йода гомолитически удален, чтобы сформировать арильный радикал по гидрид трибутилолова / триэтилбор / кислород, как в Реакция Бартона – Маккомби. Хотя теперь в арильном радикале устранено затрудненное вращение, внутримолекулярная реакция с алкен намного быстрее, чем вращение связь углерод-азот что стереохимия сохраняется. Таким образом, изомер (M, S) дает (S, S) дигидроиндолон.
Наиболее важным классом атропоизомеров являются биарилы Такие как дифеновая кислота, которая является производной от бифенил с полным набором орто заместители. Также существуют гетероароматические аналоги бифенильных соединений, в которых вращение затруднено вокруг связи углерод-азот или азот-азот.[6] Остальные - димеры нафталин производные, такие как 1,1'-би-2-нафтол. Аналогичным образом алифатические кольцевые системы, такие как циклогексаны связанные одинарной связью могут проявлять атропоизомерию при условии, что объемные заместители присутствуют. Использование аксиально хиральных биарильных соединений, таких как БИНАП, QUINAP и БИНОЛ, было обнаружено, что они полезны в области асимметричного катализа в качестве хиральных лигандов.
Их способность обеспечивать стереоиндукцию привела к использованию в реакциях гидрирования, эпоксидирования, присоединения и аллильного алкилирования, катализируемых металлами.[1] Другими реакциями, которые можно катализировать с помощью хиральных биарильных соединений, являются: Реакция Гриньяра, Реакция Ульмана, а Сузуки реакция.[15] В недавнем примере в области хирального биарилсимметричного катализа используется пятичленный имидазол как часть атропоизомерного каркаса. Было показано, что этот специфический фосфорный азот-лиганд выполняет энантиоселективную активность A3-связь.[16]
Натуральные продукты, дизайн лекарств
- Атропоизомерный Натуральные продукты

Мастигофорена А

(–)-N-Ацетилаллоколхинол
Многие атропоизомеры встречаются в природе, а некоторые применяются при разработке лекарственных препаратов. Было обнаружено, что натуральный продукт мастигофорен А способствует росту нервов.[1][17]Другие примеры встречающихся в природе атропоизомеров включают: ванкомицин изолированы от Actinobacterium, и книфолон, который находится в корнях Книфофия фолиоза семьи Asphodelaceae. Сложность структуры ванкомицина значительна, поскольку он может связываться с пептидами из-за сложности его стереохимии, которая включает в себя несколько стереоцентров, две хиральные плоскости в его стереогенной биарильной оси. Книфолон с его аксиальной хиральностью встречается в природе и, как было показано, обладает хорошими противомалярийными и противоопухолевыми свойствами, особенно в М-форме.[1]
Использование атропоизомерных препаратов дает лекарствам дополнительный способ иметь стереохимические вариации и специфичность в дизайне.[18] Один из примеров: (-) -N-ацетилаллоколхинол, лекарство, которое было обнаружено для помощи в химиотерапевтическом лечении рака.[18][19]
Телензепин атропоизомерен в конформации своего центрального тиенобензодиазепин звенеть. Два энантиомера были разделены, и было обнаружено, что (+) - изомер, который примерно в 500 раз более активен, чем (-) - изомер в отношении мускариновых рецепторов в коре головного мозга крысы.[20] Однако дизайну лекарств не всегда помогает атропоизомерия. В некоторых случаях изготовление лекарств из атропоизомеров является сложной задачей, поскольку изомеры могут преобразовываться быстрее, чем ожидалось. Атропоизомеры также могут по-разному взаимодействовать в организме, как и другие типы стереоизомеры, важно изучить эти свойства перед введением лекарств пациентам.[20]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм Брингманн G, Мортимер AJ, Келлер PA, Gresser MJ, Garner J, Breuning M (2005). «Атропоселективный синтез аксиально хиральных биарильных соединений». Angewandte Chemie International Edition. 44 (34): 5384–5427. Дои:10.1002 / anie.200462661. PMID 16116589.
- ^ Анслин и Догерти, Современная физико-органическая химия, University Science Books, 2006 г., ISBN 978-1-891389-31-3
- ^ Кун Ричард (1933). «Молекуларе асимметрия». Стереохимия (Карк Фройденберг, Ред.). Лейпциг-Вена: Franz-Deutike. С. 803–824.
- ^ Кристи, Джордж Халлатт; Кеннер, Джеймс (1 января 1922 г.). "LXXI. Молекулярные конфигурации полиядерных ароматических соединений. Часть I. Разделение 6: 6'-динитро- и 4: 6: 4 ': 6'-тетранитро-дифеновых кислот на оптически активные компоненты". Журнал химического общества, Сделки. 121: 614–620. Дои:10.1039 / CT9222100614.
- ^ Ki, Michinori (1983) Последние достижения в области атропоизомерии, в Темы стереохимии, Vol. 14 (Н. Л. Аллинджер, Э. Л. Элиэль и С. Х. Вилен, ред.), Хобокен, штат Нью-Джерси: John Wiley & Sons, стр. 1-82; опубликовано в Интернете в 2007 г., Дои:10.1002 / 9780470147238.ch1, видеть [1] и [2][постоянная мертвая ссылка ], по состоянию на 12 июня 2014 г.
- ^ а б c d Алькорта, Ибон; Хосе Эльгеро; Кристиан Руссель; Николас Вантуйн; Патрик Пирас (2012). Атропоизомерия и аксиальная хиральность в гетероароматических соединениях. Достижения в химии гетероциклов. 105. С. 1–188. Дои:10.1016 / B978-0-12-396530-1.00001-2. HDL:10261/62060. ISBN 9780123965301.
- ^ LaPlante, Стивен Р .; Эдвардс, Пол Дж .; Фейдер, Ли Д .; Джакалиан, Араз; Хак, Оливер (7 марта 2011 г.). «Выявление аксиальной хиральности атропизомера в открытии лекарств». ChemMedChem. 6 (3): 505–513. Дои:10.1002 / cmdc.201000485. PMID 21360821.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "спиральность ". Дои:10.1351 / goldbook.H02763
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "осевая хиральность ". Дои:10.1351 / goldbook.A00547
- ^ Чепанец, Ивица (2004). Синтез биарилов (1-е изд.). Амстердам: Эльзевир. ISBN 978-0080444123.
- ^ Wilson, Keith R .; Пинкок, Ричард Э. (март 1975). «Термоиндуцированное разделение рацемического 1,1'-бинафтила в твердом состоянии». Журнал Американского химического общества. 97 (6): 1474–1478. Дои:10.1021 / ja00839a033.
- ^ Эйнхорн, Кэти; Дуриф, Андре; Авербух, Мария-Тереза; Эйнхорн, Жак (18 мая 2001 г.). «Твердотельная изомеризация атроподиастереомеров: эффективный диастереоселекция посредством полиморфных превращений». Angewandte Chemie International Edition. 40 (10): 1926–1929. Дои:10.1002 / 1521-3773 (20010518) 40:10 <1926 :: AID-ANIE1926> 3.0.CO; 2-3.
- ^ Пу, Лин (1998). «1,1'-Бинафтилдимеры, олигомеры и полимеры: молекулярное распознавание, асимметричный катализ и новые материалы». Химические обзоры. 98 (7): 2405–2494. Дои:10.1021 / cr970463w. PMID 11848968.
- ^ Пети, Марк (2005). "Ретрансляция асимметрии переходных атропоизомеров о-йоданилидов радикальными циклизациями". Журнал Американского химического общества. 127: 14994–14995. Дои:10.1021 / ja055666d.
- ^ Коцци, Пьер Джорджио; Энрико Эмер; Андреа Гуаланди (2011). «Атропоселективный органокатализ». Энгью. Chem. Int. Эд. 50 (17): 3847–3849. Дои:10.1002 / anie.201008031. PMID 21448867.
- ^ Cardoso, Flavio S.P .; Abboud, Khalil A .; Апоник, Аарон (2 октября 2013 г.). «Разработка, приготовление и реализация хирального биарил-P, N-лиганда на основе имидазола для асимметричного катализа». Журнал Американского химического общества. 135 (39): 14548–14551. Дои:10.1021 / ja407689a. PMID 24044433.
- ^ Фукуяма, Ёсиясу; Асакава, Ёсинори (1991). «Новые нейротрофные димеры сесквитерпена изокупаранового типа, мастигофорены A, B, C и D, выделенные из печеночника Mastigophora diclados». Журнал химического общества, Perkin Transactions 1 (11): 2737. Дои:10.1039 / p19910002737.
- ^ а б Заск, Арье; Джон Мерфи; Джордж Эллестад (2013). «Биологическая стереоселективность атропоизомерных натуральных продуктов и лекарств». Хиральность. 25 (5): 265–274. Дои:10.1002 / chir.22145. PMID 23620262.
- ^ Жонкур, А; Декор А; Торет S; Кьярони А; Баудуан О. (2006). «Биарильная ось как стереохимическое реле для энантиоселективного синтеза антимикротрубочковых агентов». Энгью. Chem. Int. Эд. 45 (25): 4149–4152. Дои:10.1002 / anie.200600451. PMID 16688690.
- ^ а б Clayden, J .; Moran, W. J .; Эдвардс, П. Дж .; ЛаПанте, С. Р. (2009). «Проблема атропоизомерии в открытии лекарств». Энгью. Chem. Int. Эд. 48 (35): 6398–6401. Дои:10.1002 / anie.200901719. PMID 19637174.
дальнейшее чтение
- Аллен К. (14 ноября 2005 г.). «Атропоизомерия: аксиальная хиральность в природе и синтезе» (PDF). Литературный семинар, Исследовательская группа Штольца. Калифорнийский технологический институт. Архивировано из оригинал (PDF) 3 марта 2016 г.



