Двухгибридный скрининг - Two-hybrid screening
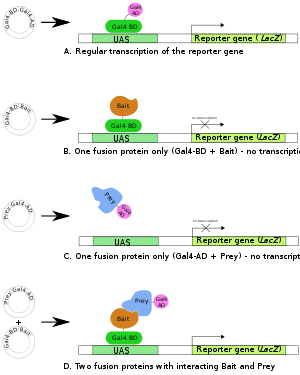
А. В Gal4 Ген фактора транскрипции производит двухдоменный белок (BD и ОБЪЯВЛЕНИЕ) необходим для транскрипции репортерного гена (LacZ).
B,C. Готовят два гибридных белка: Gal4BD + Приманка и Gal4AD + Prey. Ни одного из них обычно недостаточно для инициации транскрипции (репортерного гена) в одиночку.
D. Когда производятся оба слитых белка и Приманочная часть первого слитого белка взаимодействует с Prey-частью второго, происходит транскрипция репортерного гена.
Двухгибридный скрининг (первоначально известный как дрожжевая двугибридная система или же Y2H) это молекулярная биология техника, используемая для открытия белок-белковые взаимодействия (ИЦП)[1] и белок-ДНК взаимодействия[2][3] путем тестирования физического взаимодействия (например, связывания) между двумя белки или один белок и ДНК молекула соответственно.
Предпосылка теста - активация вниз по течению репортерный ген (s) путем привязки фактор транскрипции на последовательность активации вверх по потоку (БПЛА). Для двухгибридного скрининга фактор транскрипции разделяется на два отдельных фрагмента, называемых ДНК-связывающим доменом (DBD или часто также сокращенно BD) и активирующим доменом (AD). BD - это домен ответственный за привязка к UAS, а AD - это домен, ответственный за активацию транскрипция.[1][2] Y2H, таким образом, анализ комплементации белок-фрагмент.
История
Первопроходец Стэнли Филдс и Ok-Kyu Song в 1989 г., метод был первоначально разработан для обнаружения белок-белковых взаимодействий с использованием Gal4 активатор транскрипции дрожжей Saccharomyces cerevisiae. В Gal4 белок активировал транскрипцию гена, участвующего в утилизации галактозы, что легло в основу отбора.[4] С тех пор тот же принцип был адаптирован для описания многих альтернативных методов, в том числе тех, которые обнаруживают белок-ДНК взаимодействия или же ДНК-ДНК взаимодействия, а также методы, использующие разные организмы-хозяева Такие как кишечная палочка или клетки млекопитающих вместо дрожжей.[3][5]
Основное помещение
Ключ к двухгибридному экрану заключается в том, что в большинстве эукариотический Факторы транскрипции, активирующий и связывающий домены являются модульными и могут функционировать в непосредственной близости друг от друга без прямого связывания.[6] Это означает, что даже если фактор транскрипции разделен на два фрагмента, он все еще может активировать транскрипцию, когда эти два фрагмента косвенно связаны.
Наиболее распространенным методом скрининга является двухгибридный анализ дрожжей. При таком подходе исследователь знает, где находится каждая жертва на используемой среде (чашках с агаром). Миллионы потенциальных взаимодействий в нескольких организмах были проверены за последнее десятилетие с использованием высокопроизводительный скрининг системы (часто с использованием роботов) и более тысячи взаимодействий были обнаружены и классифицированы в базах данных как BioGRID.[7][8] В этой системе часто используется генно-инженерный штамм дрожжей, в которых биосинтез определенных питательных веществ (обычно аминокислоты или же нуклеиновые кислоты ) отсутствует. При выращивании на среде, в которой отсутствуют эти питательные вещества, дрожжи не выживают. Этот мутантный штамм дрожжей можно заставить включать чужеродную ДНК в виде плазмиды. При двухгибридном скрининге дрожжей отдельные плазмиды-приманки и жертвы одновременно вводятся в мутантный штамм дрожжей или используется стратегия скрещивания для получения обеих плазмид в одной клетке-хозяине.[9]
Второй подход с высокой пропускной способностью - это метод проверки библиотек. В этом случае клетки наживки и жертвы спариваются в случайном порядке. После скрещивания и отбора выживших клеток на селективной среде ученый секвенирует изолированные плазмиды, чтобы увидеть, какая жертва (последовательность ДНК) взаимодействует с использованной приманкой. Этот подход имеет более низкий уровень воспроизводимости и имеет тенденцию давать большее количество ложных срабатываний по сравнению с матричным подходом.[9]
Плазмиды конструируются для производства белкового продукта, в котором фрагмент ДНК-связывающего домена (BD) слит с белком, в то время как другая плазмида конструируется для получения белкового продукта, в котором фрагмент домена активации (AD) слит с другим белком. Белок, слитый с BD, может называться белком-приманкой, и обычно это известный белок, который исследователь использует для идентификации новых партнеров по связыванию. Белок, слитый с AD, может упоминаться как белок жертвы и может быть либо отдельным известным белком, либо библиотека известных или неизвестных белков. В этом контексте библиотека может состоять из набора последовательностей, кодирующих белок, которые представляют все белки, экспрессируемые в конкретном организме или ткани, или может быть создана путем синтеза случайных последовательностей ДНК.[3] Независимо от источника они впоследствии включаются в кодирующую белок последовательность плазмиды, которая затем трансфицируется в клетки, выбранные для метода скрининга.[3] Этот метод при использовании библиотеки предполагает, что каждая клетка трансфецирована не более чем одной плазмидой и, следовательно, каждая клетка в конечном итоге экспрессирует не более одного члена из белковой библиотеки.
Если белки приманки и жертвы взаимодействуют (т. Е. Связываются), то AD и BD фактора транскрипции косвенно связаны, в результате чего AD приближается к сайту начала транскрипции и может происходить транскрипция репортерного гена (ов). Если два белка не взаимодействуют, транскрипция репортерного гена отсутствует. Таким образом, успешное взаимодействие между слитым белком связано с изменением фенотипа клетки.[1]
Проблема отделения клеток, которые экспрессируют белки, которые взаимодействуют со своими слитными белками, от тех, которые этого не делают, рассматривается в следующем разделе.
Фиксированные домены
В любом исследовании некоторые из исследуемых белковых доменов будут варьироваться в соответствии с целями исследования, тогда как другие домены, которые сами не исследуются, будут оставаться постоянными. Например, в двухгибридном исследовании для выбора ДНК-связывающих доменов ДНК-связывающий домен, BD, будет варьироваться, в то время как два взаимодействующих белка, приманка и жертва, должны оставаться постоянными, чтобы поддерживать прочное связывание между BD. и AD. Есть несколько доменов, из которых можно выбрать BD, приманку, добычу и AD, если они должны оставаться постоянными. В исследованиях белок-белкового взаимодействия BD может быть выбран из любого из многих сильных ДНК-связывающих доменов, таких как Zif268.[2] Частым выбором доменов приманки и жертвы являются остатки 263–352 дрожжевого Gal11P с мутацией N342V.[2] и остатки 58–97 дрожжевого Gal4,[2] соответственно. Эти домены могут использоваться как в методах селекции на основе дрожжей, так и бактерий, и, как известно, они прочно связываются друг с другом.[1][2]
Выбранный AD должен быть в состоянии активировать транскрипцию репортерного гена с использованием собственного транскрипционного аппарата клетки. Таким образом, разнообразие AD, доступных для использования в методиках на основе дрожжей, может не подходить для использования в их аналогах на основе бактерий. AD, VP16 и дрожжевой Gal4 AD, полученные из вируса простого герпеса, успешно применялись в дрожжах.[1] в то время как часть α-субъединицы Кишечная палочка РНК-полимераза была использована в Кишечная палочка-основанные методы.[2][3]
В то время как сильно активирующие домены могут обеспечить большую чувствительность к более слабым взаимодействиям, наоборот, более слабая AD может обеспечить большую строгость.
Конструирование экспрессионных плазмид
Ряд сконструированных генетических последовательностей должен быть включен в клетку-хозяин для выполнения двухгибридного анализа или одного из его производных методов. Соображения и методы, используемые при конструировании и доставке этих последовательностей, различаются в зависимости от потребностей анализа и организма, выбранного в качестве экспериментального фона.
Есть две широкие категории гибридных библиотек: случайные библиотеки и библиотеки на основе кДНК. А библиотека кДНК состоит из кДНК, полученной через обратная транскрипция мРНК, собранной из определенных типов клеток. Эта библиотека может быть лигирована в конструкцию, чтобы она была прикреплена к BD или AD, используемым в анализе.[1] Случайная библиотека использует длины ДНК случайной последовательности вместо этих участков кДНК. Существует ряд методов для создания этих случайных последовательностей, включая кассетный мутагенез.[2] Независимо от источника библиотеки ДНК, она перевязанный в соответствующее место в соответствующей плазмиде / фагмиде, используя соответствующий эндонуклеазы рестрикции.[2]
Кишечная палочка-конкретные соображения
Поместив гибридные белки под контроль IPTG -индуцибельный лак промоутеры, они выражаются только на носителях, дополненных IPTG. Кроме того, путем включения различных генов устойчивости к антибиотикам в каждую генетическую конструкцию рост нетрансформированных клеток легко предотвращается путем культивирования на средах, содержащих соответствующие антибиотики. Это особенно важно для методов выбора счетчика, в которых недостаток взаимодействия необходимо для выживания клеток.[2]
Репортерный ген может быть вставлен в Кишечная палочка геном, сначала вставив его в эписома, тип плазмиды со способностью встраиваться в геном бактериальной клетки[2] с количеством копий примерно по одной на ячейку.[10]
Гибридные экспрессионные фагмиды могут быть электропорированы в Кишечная палочка XL-1 Синие клетки, которые после амплификации и заражения VCS-M13 фаг-помощник, даст запас библиотечного фага. Каждый из этих фагов будет содержать по одному одноцепочечному члену библиотеки фагмид.[2]
Восстановление информации о белках
После того, как выбор сделан, первичная структура белков, которые обладают соответствующими характеристиками, необходимо определить. Это достигается путем извлечения кодирующих белок последовательностей (как изначально вставленных) из клеток, демонстрирующих соответствующий фенотип.
Кишечная палочка
Фагмида, используемая для трансформации Кишечная палочка клетки можно «спасти» от выбранных клеток, инфицировав их фагом-помощником VCS-M13. Полученные в результате фаговые частицы содержат одноцепочечные фагмиды и используются для заражения клеток XL-1 Blue.[2] Двухцепочечные фагмиды впоследствии собирают из этих клеток XL-1 Blue, по существу обращая процесс, использованный для получения исходного библиотечного фага. Наконец, последовательности ДНК определяются с помощью дидезокси-секвенирование.[2]
Контроль чувствительности
В кишечная палочка-полученный Тет-Р Репрессор может использоваться вместе с обычным репортерным геном и может контролироваться тетрациклином или доксициклином (ингибиторы Tet-R). Таким образом, экспрессия Tet-R контролируется стандартной двухгибридной системой, но Tet-R, в свою очередь, контролирует (репрессирует) экспрессию ранее упомянутого репортера, такого как HIS3через промотор Tet-R. Затем тетрациклин или его производные можно использовать для регулирования чувствительности системы, использующей Tet-R.[1]
Чувствительность также можно контролировать, варьируя зависимость клеток от их репортерных генов. Например, на это может повлиять изменение концентрации гистидина в питательной среде для его3-зависимые клетки и изменение концентрации стрептомицина для aadA зависимые клетки.[2][3] Зависимость от селекционного гена также можно контролировать, применяя ингибитор селекционного гена в подходящей концентрации. 3-амино-1,2,4-триазол (3-AT), например, является конкурентным ингибитором HIS3-генный продукт и может использоваться для титрования минимального уровня HIS3 экспрессия, необходимая для роста на среде с дефицитом гистидина.[2]
Чувствительность также можно модулировать, варьируя количество операторных последовательностей в репортерной ДНК.
Неслитые белки
Третий, не слитый белок может коэкспрессироваться с двумя слитыми белками. В зависимости от исследования третий белок может модифицировать один из гибридных белков или опосредовать или препятствовать их взаимодействию.[1]
Совместная экспрессия третьего белка может быть необходима для модификации или активации одного или обоих слитых белков. Например, С. cerevisiae не обладает эндогенной тирозинкиназой. Если в исследовании участвует белок, который требует фосфорилирования тирозина, киназа должна поставляться в форме гена тирозинкиназы.[1]
Неслитый белок может опосредовать взаимодействие путем одновременного связывания обоих слитых белков, как в случае лиганд-зависимой димеризации рецептора.[1]
Для белка с взаимодействующим партнером его функциональную гомологию с другими белками можно оценить, предоставив третий белок в неслитой форме, который затем может или не может конкурировать со слитым белком за своего связывающего партнера. Связывание между третьим белком и другим слитым белком будет прерывать образование комплекса активации экспрессии репортера и, таким образом, уменьшать экспрессию репортера, приводя к различимому изменению фенотипа.[1]
Сплит-убиквитиновые дрожжи двугибридные
Одним из ограничений классических двугибридных дрожжевых скринингов является то, что они ограничиваются растворимыми белками. Следовательно, их невозможно использовать для изучения белок-белковых взаимодействий между нерастворимыми интегральные мембранные белки. Система сплит-убиквитин обеспечивает способ преодоления этого ограничения.[11] В системе сплит-убиквитин два интегральных мембранных белка, которые необходимо изучить, сливаются с двумя разными убиквитин фрагменты: C-концевой фрагмент убиквитина («Cub», остатки 35–76) и N-концевой фрагмент убиквитина («Nub», остатки 1–34). Эти слитые белки называются приманкой и добычей соответственно. Помимо слияния с интегральным мембранным белком, фрагмент Cub также слит с фактор транскрипции (TF), которые могут быть отщеплены убиквитин-специфическим протеазы. При взаимодействии приманка-жертва Nub и Cub-фрагменты собираются, восстанавливая расщепленный убиквитин. Восстановленная молекула расщепленного убиквитина распознается убиквитин-специфическими протеазами, которые отщепляют фактор транскрипции, позволяя ему индуцировать транскрипцию репортерные гены.[12]
Флуоресцентный двухгибридный анализ
Золгадр и его сотрудники представили флуоресцентную двухгибридную систему, в которой используются два гибридных белка, которые слиты с разными флуоресцентными белками, а также LacI, лак репрессор. Структура гибридных белков выглядит следующим образом: FP2-LacI-приманка и FP1-жертва, где белки приманки и жертвы взаимодействуют и переносят флуоресцентные белки (FP1 = GFP, FP2 =мЧерри ) в непосредственной близости от сайта связывания белка LacI в геноме клетки-хозяина.[13] Система также может использоваться для скрининга ингибиторов белок-белковых взаимодействий.[14]
Ферментативные двухгибридные системы: KISS
В то время как исходная система Y2H использовала восстановленный фактор транскрипции, другие системы создают ферментативные активности для обнаружения ИПП. Например, датчик субстрата киназы («KISS») представляет собой двухгибридный подход млекопитающих, который был разработан для картирования внутриклеточных ИПП. Здесь белок приманки сливается с киназа -содержащая часть TYK2 и добыча связана с gp130 цитокиновый рецептор фрагмент. При взаимодействии наживки и добычи TYK2 фосфорилирует STAT3 стыковка сайтов на химере-жертве, что в конечном итоге приводит к активации репортерный ген.[15]
Одно-, трех- и одно-двугибридные варианты
Одногибридный
Одногибридная вариация этого метода предназначена для исследования белок-ДНК взаимодействия и использует единственный слитый белок, в котором AD непосредственно связана со связывающим доменом. Однако связывающий домен в этом случае не обязательно имеет фиксированную последовательность, как в двухгибридном белок-белковом анализе, но может быть составлен из библиотеки. Эта библиотека может быть выбрана против желаемой целевой последовательности, которая вставлена в промоторную область конструкции репортерного гена. Таким образом, в системе положительного отбора выбирается связывающий домен, который успешно связывает UAS и обеспечивает транскрипцию.[1]
Обратите внимание, что отбор ДНК-связывающих доменов не обязательно выполняется с использованием одногибридной системы, но также может выполняться с использованием двухгибридной системы, в которой связывающий домен варьируется, а белки приманки и жертвы остаются постоянными.[2][3]
Трехгибридный

РНК-белковые взаимодействия были исследованы с помощью трехгибридного варианта двухгибридного метода. В этом случае гибридная молекула РНК служит для соединения вместе двух доменов слияния белков, которые предназначены не для взаимодействия друг с другом, а скорее с промежуточной молекулой РНК (через свои РНК-связывающие домены).[1] Методы с участием неслитых белков, которые выполняют аналогичную функцию, как описано выше в разделе «неслитые белки», также могут называться трехгибридными методами.
Один-двугибридный
Одновременное использование одно- и двухгибридных методов (то есть одновременного взаимодействия белок-белок и белок-ДНК) известно как одно-двухгибридный подход, и ожидается, что он повысит строгость проверки.[1]
Организм-хозяин
Хотя теоретически любая живая клетка может использоваться в качестве фона для двугибридного анализа, существуют практические соображения, которые определяют, какой из них выбрать. Выбранная линия клеток должна быть относительно дешевой, удобной для культивирования и достаточно прочной, чтобы выдерживать применение исследовательских методов и реагентов.[1] Последнее особенно важно для выполнения высокопроизводительные исследования. Поэтому дрожжи С. cerevisiae был основным организмом-хозяином для двухгибридных исследований. Однако это не всегда идеальная система для изучения взаимодействующих белков других организмов.[16] Дрожжевые клетки часто не имеют одинаковых посттрансляционных модификаций, имеют другое использование кодонов или не имеют определенных белков, которые важны для правильной экспрессии белков. Чтобы справиться с этими проблемами, было разработано несколько новых двухгибридных систем. В зависимости от используемой системы агаровые чашки или конкретная среда для выращивания используются для выращивания клеток и обеспечения отбора для взаимодействия. Чаще всего используется метод посева на агар, при котором клетки высевают на селективную среду, чтобы увидеть, как происходит взаимодействие. Клетки, не имеющие взаимодействующих белков, не должны выжить в этой селективной среде.[7][17]
С. cerevisiae (дрожжи)
Дрожжи С. cerevisiae был модельным организмом, использовавшимся во время создания двухгибридной техники. Это широко известно как система Y2H. Он имеет несколько характеристик, которые делают его надежным организмом для взаимодействия, в том числе способность образовывать третичные белковые структуры, нейтральный внутренний pH, повышенную способность образовывать дисульфидные связи и глутатион в восстановленном состоянии среди других цитозольных буферных факторов, чтобы поддерживать благоприятный внутренний среда.[1] Моделью дрожжей можно управлять с помощью немолекулярных методов, и ее полная последовательность генома известна.[1] Дрожжевые системы толерантны к различным условиям культивирования и агрессивным химическим веществам, которые нельзя применять к культурам тканей млекопитающих.[1]
Ряд штаммов дрожжей был создан специально для скрининга Y2H, например Y187[18] и AH109,[19] оба произведены Клонтех. Также использовались штаммы дрожжей R2HMet и BK100.[20]
грибковые микроорганизмы албиканс
C. albicans дрожжи с особой особенностью: они переводят кодон CUG в серин, а не лейцин. Из-за этого различного использования кодонов трудно использовать модельную систему. С. cerevisiae в качестве Y2H для проверки белок-белковых взаимодействий с использованием C. albicans гены. Чтобы обеспечить более естественную среду, C. albicans разработана двухгибридная (C2H) система. С помощью этой системы белок-белковые взаимодействия можно изучать в C. albicans сам.[21][22] Недавним дополнением стало создание высокопроизводительной системы.[23][24][25]
Кишечная палочка
Бактериальные двухгибридные методы (B2H или BTH) обычно проводят в Кишечная палочка и имеют некоторые преимущества перед системами на основе дрожжей. Например, более высокая эффективность трансформации и более высокие темпы роста дают кредиты. Кишечная палочка к использованию более крупных библиотек (более 108).[2] Отсутствие требований к сигнал ядерной локализации возможность включения в последовательность белка и способность изучать белки, которые могут быть токсичными для дрожжей, также могут быть основными факторами, которые следует учитывать при выборе экспериментального фонового организма.[2]
Активность метилирования некоторых Кишечная палочка ДНК-метилтрансфераза белки могут мешать отбору некоторых ДНК-связывающих белков. Если это ожидается, использование Кишечная палочка штамм, дефектный по определенной метилтрансферазе, может быть очевидным решением.[2] B2H может быть не идеальным при изучении эукариотических белок-белковых взаимодействий (например, человеческих белков), поскольку белки могут не складываться, как в эукариотических клетках, или могут не иметь другого процессинга.
Клетки млекопитающих
В последние годы была разработана двухгибридная система млекопитающих (M2H) для изучения белок-белковых взаимодействий млекопитающих в клеточной среде, которая близко имитирует среду нативного белка.[26] В этой системе используются временно трансфицированные клетки млекопитающих для обнаружения белок-белковых взаимодействий.[27][28]Использование клеточной линии млекопитающих для изучения белковых взаимодействий млекопитающих дает преимущество работы в более естественном контексте.[5]Посттрансляционные модификации, фосфорилирование, ацилирование и гликозилирование аналогичны. Внутриклеточная локализация белков также более правильна по сравнению с использованием дрожжевой двухгибридной системы.[29][30]С помощью двухгибридной системы млекопитающих также возможно изучать входные сигналы.[31]Еще одним большим преимуществом является то, что результаты можно получить в течение 48 часов после трансфекции.[5]
Arabidopsis thaliana
В 2005 году была разработана двугибридная система растений. Использование протопластов A. thaliana белок-белковые взаимодействия можно изучать на растениях. Таким образом взаимодействия можно изучать в их естественном контексте. В этой системе GAL4 AD и BD находятся под контролем сильного промотора 35S. Взаимодействие измеряется с помощью репортера GUS. Чтобы обеспечить высокую пропускную способность скрининга, векторы были сделаны шлюз-совместимыми. Система известна как система протопласт-два-гибрид (P2H).[32]
Аплизия калифорнийская
Морской заяц Калифорния является модельным организмом в нейробиологии для изучения, среди прочего, молекулярных механизмов долговременной памяти. Для изучения взаимодействий, важных для неврологии, в более естественной среде была разработана двухгибридная система. Калифорния нейроны. В этой системе используются GAL4 AD и BD.[33][34]
Bombyx mori
Двугибридная система насекомых (I2H) была разработана в клеточной линии тутового шелкопряда из личинки или гусеницы одомашненной шелковой моли, Bombyx mori (Клетки BmN4). Эта система использует GAL4 BD и домен активации NF-κB P65 мыши. Оба находятся под контролем промотора OpIE2.[35]
Приложения
Определение последовательностей, важных для взаимодействия
Изменяя конкретные аминокислоты путем мутации соответствующих пар оснований ДНК в используемых плазмидах, можно определить важность этих аминокислотных остатков для поддержания взаимодействия.[1]
После использования метода на основе бактериальных клеток для выбора ДНК-связывающих белков необходимо проверить специфичность этих доменов, поскольку существует предел того, в какой степени геном бактериальной клетки может действовать как приемник для доменов со сродством к другим последовательности (или, действительно, общее сродство к ДНК).[2]
Открытие наркотиков и ядов
Сигнальные взаимодействия белок-белок представляют подходящие терапевтические цели из-за их специфичности и распространенности. Подход к случайному открытию лекарств использует банки соединений, которые содержат случайные химические структуры, и требует высокопроизводительного метода для тестирования этих структур в их намеченной цели.[1][17]
Клетка, выбранная для исследования, может быть специально сконструирована так, чтобы отражать молекулярный аспект, который исследователь намеревается изучить, а затем использоваться для идентификации новых терапевтических средств для человека или животных или агентов против вредителей.[1][17]
Определение функции белка
Путем определения партнеров по взаимодействию неизвестных белков можно сделать вывод о возможных функциях этих новых белков.[1] Это может быть сделано с использованием одного известного белка против библиотеки неизвестных белков или, наоборот, путем выбора из библиотеки известных белков с использованием одного белка с неизвестной функцией.[1]
Выбор белка цинкового пальца
Выбирать белки цинковых пальцев (ZFP) для белковая инженерия, методы, адаптированные из метода двухгибридного скрининга, были успешно использованы.[2][3] ZFP сам по себе является ДНК-связывающим белком, используемым для создания заказных ДНК-связывающих доменов, которые связываются с желаемой последовательностью ДНК.[36]
Используя ген отбора с желаемой целевой последовательностью, включенной в UAS, и рандомизируя соответствующие аминокислотные последовательности для создания библиотеки ZFP, можно выбрать клетки, которые являются хозяевами взаимодействия ДНК-ZFP с требуемыми характеристиками. Каждый ZFP обычно распознает только 3–4 пары оснований, поэтому для предотвращения распознавания сайтов за пределами UAS рандомизированный ZFP конструируется в «каркас», состоящий из двух других ZFP с постоянной последовательностью. Таким образом, UAS предназначен для включения целевой последовательности постоянного каркаса в дополнение к последовательности, для которой выбран ZFP.[2][3]
С помощью этой системы можно также исследовать ряд других ДНК-связывающих доменов.[2]
Сильные стороны
- Двухгибридные экраны низкотехнологичны; их можно проводить в любой лаборатории без сложного оборудования.
- Двухгибридные экраны могут дать важную первую подсказку для идентификации партнеров по взаимодействию.
- Анализ масштабируемый, что позволяет проводить скрининг взаимодействий между многими белками. Кроме того, это можно автоматизировать, и с помощью роботов можно провести скрининг многих белков против тысяч потенциально взаимодействующих белков за относительно короткое время. Используются два типа больших экранов: библиотечный подход и матричный подход.
- Данные о двугибридных дрожжах могут иметь такое же качество, что и данные, полученные с помощью альтернативного подхода коаффинная очистка с последующим масс-спектрометрии (AP / MS).[37][9]
Недостатки
- Основная критика дрожжевого двугибридного скрининга белок-белковых взаимодействий связана с возможностью большого количества ложноположительных (и ложноотрицательных) идентификаций. Точная частота ложноположительных результатов неизвестна, но более ранние оценки доходили до 70%. Это также частично объясняет часто обнаруживаемое очень небольшое совпадение результатов при использовании (высокой пропускной способности) двухгибридного скрининга, особенно при использовании различных экспериментальных систем.[9][28]
Причина такого высокого количества ошибок кроется в характеристиках экрана:
- Некоторые варианты анализа сверхэкспрессируют слитые белки, что может вызывать неестественные концентрации белка, приводящие к неспецифическим (ложным) положительным результатам.
- Гибридные белки представляют собой гибридные белки; то есть слитые части могут ингибировать определенные взаимодействия, особенно если взаимодействие происходит на N-конце тестового белка (где обычно прикрепляется ДНК-связывающий или активирующий домен).
- Взаимодействие может не происходить в дрожжах, типичном организме-хозяине Y2H. Например, если бактериальный белок тестируется на дрожжах, ему может не хватать шаперона для правильной укладки, который присутствует только в его бактериальном хозяине. Более того, млекопитающее белок иногда неправильно модифицирован в дрожжах (например, отсутствует фосфорилирование ), что также может привести к ложным результатам.
- Y2H находится в ядре. Если тестовые белки не локализованы в ядре (потому что у них есть другие сигналы локализации), два взаимодействующих белка могут оказаться невзаимодействующими.
- Некоторые белки могут специфически взаимодействовать, когда они совместно экспрессируются в дрожжах, хотя на самом деле они никогда не присутствуют в одной и той же клетке в одно и то же время. Однако в большинстве случаев нельзя исключать, что такие белки действительно экспрессируются в определенных клетках или при определенных обстоятельствах.
Каждый из этих пунктов сам по себе может привести к ложным результатам. Из-за совокупного воздействия всех источников ошибок двугибридные дрожжи следует интерпретировать с осторожностью. Вероятность получения ложноположительных результатов означает, что все взаимодействия должны быть подтверждены методом высокой достоверности, например коиммунопреципитация эндогенных белков, что затруднительно для крупномасштабных данных белок-белкового взаимодействия. В качестве альтернативы данные Y2H могут быть проверены с использованием нескольких вариантов Y2H.[38] или методы биоинформатики. Последний тест, экспрессируются ли взаимодействующие белки одновременно, имеют ли общие черты (например, генная онтология аннотации или некоторые сетевые топологии ), имеют гомологичные взаимодействия с другими видами.[39]
Смотрите также
- Фаговый дисплей, альтернативный метод обнаружения взаимодействий белок-белок и белок-ДНК.
- Белковый массив, основанный на чипе метод обнаружения белок-белковых взаимодействий
- Синтетический генетический массив анализ, дрожжевой метод изучения взаимодействия генов
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Янг К.Х. (февраль 1998 г.). «Двугибридные дрожжи: так много взаимодействий, так мало времени». Биология размножения. 58 (2): 302–11. Дои:10.1095 / биолрепрод58.2.302. PMID 9475380.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс Joung JK, Ramm EI, Pabo CO (июнь 2000 г.). «Бактериальная двухгибридная селекционная система для изучения взаимодействий белок-ДНК и белок-белок». Труды Национальной академии наук Соединенных Штатов Америки. 97 (13): 7382–7. Bibcode:2000PNAS ... 97.7382J. Дои:10.1073 / pnas.110149297. ЧВК 16554. PMID 10852947.
- ^ а б c d е ж грамм час я Hurt JA, Thibodeau SA, Hirsh AS, Pabo CO, Joung JK (октябрь 2003 г.). «Высокоспецифичные белки цинковых пальцев, полученные путем направленной перетасовки доменов и селекции на основе клеток». Труды Национальной академии наук Соединенных Штатов Америки. 100 (21): 12271–6. Bibcode:2003PNAS..10012271H. Дои:10.1073 / pnas.2135381100. ЧВК 218748. PMID 14527993.
- ^ Поля С, Сонг О (июль 1989 г.). «Новая генетическая система для обнаружения белок-белковых взаимодействий». Природа. 340 (6230): 245–6. Bibcode:1989Натура.340..245F. Дои:10.1038 / 340245a0. PMID 2547163. S2CID 4320733. Аннотация бесплатна; Полнотекстовой статьи нет.
- ^ а б c Ло Й, Баталао А., Чжоу Х, Чжу Л. (февраль 1997 г.). «Двугибридная система млекопитающих: дополнительный подход к дрожжевой двугибридной системе» (PDF). Биотехнологии. 22 (2): 350–2. Дои:10.2144 / 97222pf02. PMID 9043710. Архивировано из оригинал (PDF) 27 апреля 2017 г.. Получено 26 апреля 2017.
- ^ Verschure PJ, Visser AE, Rots MG (2006). Выйти из канавки: эпигенетические системы контроля генов и сконструированные факторы транскрипции. Успехи в генетике. 56. С. 163–204. Дои:10.1016 / S0065-2660 (06) 56005-5. ISBN 9780120176564. PMID 16735158.[мертвая ссылка ]
- ^ а б Брюкнер А., Польге С., Ленце Н., Ауэрбах Д., Шлаттнер Ю. (июнь 2009 г.). «Двугибридные дрожжи - мощный инструмент системной биологии». Международный журнал молекулярных наук. 10 (6): 2763–88. Дои:10.3390 / ijms10062763. ЧВК 2705515. PMID 19582228.
- ^ Гитц Р.Д., Триггс-Рейн Б., Роббинс А., Грэм К.С., Вудс Р.А. (июль 1997 г.). «Идентификация белков, которые взаимодействуют с интересующим белком: приложения двухгибридной системы дрожжей». Молекулярная и клеточная биохимия. 172 (1–2): 67–79. Дои:10.1023 / А: 1006859319926. PMID 9278233. S2CID 32413316.
- ^ а б c d Auerbach D, Stagljar I (2005). "Дрожжевые сети двухгибридного белок-белкового взаимодействия". Протеомика и белок-белковые взаимодействия. Белковые обзоры. 3. С. 19–31. Дои:10.1007/0-387-24532-4_2. ISBN 978-0-387-24531-7.
- ^ Уиппл FW (август 1998 г.). «Генетический анализ прокариотических и эукариотических ДНК-связывающих белков в Escherichia coli». Исследования нуклеиновых кислот. 26 (16): 3700–6. Дои:10.1093 / nar / 26.16.3700. ЧВК 147751. PMID 9685485.
- ^ Stagljar I, Korostensky C, Johnsson N, te Heesen S (апрель 1998 г.). «Генетическая система на основе сплит-убиквитина для анализа взаимодействий между мембранными белками in vivo». Труды Национальной академии наук Соединенных Штатов Америки. 95 (9): 5187–92. Bibcode:1998PNAS ... 95.5187S. Дои:10.1073 / пнас.95.9.5187. ЧВК 20236. PMID 9560251.
- ^ Snider J, Kittanakom S, Curak J, Stagljar I (февраль 2010 г.). «Двухгибридная мембранная дрожжевая система (МИФ) на основе сплит-убиквитина: мощный инструмент для определения белок-белковых взаимодействий». Журнал визуализированных экспериментов (36). Дои:10.3791/1698. ЧВК 2818708. PMID 20125081.
- ^ Zolghadr K, Mortusewicz O, Rothbauer U, Kleinhans R, Goehler H, Wanker EE, Cardoso MC, Leonhardt H (ноябрь 2008 г.). «Флуоресцентный двухгибридный анализ для прямой визуализации белковых взаимодействий в живых клетках». Молекулярная и клеточная протеомика. 7 (11): 2279–87. Дои:10.1074 / mcp.M700548-MCP200. PMID 18622019.
- ^ Юрлова Л., Деркс М., Бухфеллнер А., Хиксон И., Янссен М., Моррисон Д., Стэнсфилд И., Браун С.Дж., Гадесси Ф.Дж., Лейн Д.П., Ротбауэр Ю., Золгадр К., Крауш Э. (апрель 2014 г.). «Флуоресцентный двухгибридный анализ для скрининга ингибиторов белок-белкового взаимодействия в живых клетках: определение взаимодействия p53 с Mdm2 и Mdm4». Журнал биомолекулярного скрининга. 19 (4): 516–25. Дои:10.1177/1087057113518067. PMID 24476585.
- ^ Ливенс С., Джерло С., Лемменс И., Де Клерк Д. Д., Риссееу М. Д., Вандеррост Н., Де Смет А. С., Рюссинк Е., Чевет Е., Ван Каленберг С., Тавернье Дж. (Декабрь 2014 г.). «Датчик субстрата киназы (KISS), датчик взаимодействия белков in situ у млекопитающих». Молекулярная и клеточная протеомика. 13 (12): 3332–42. Дои:10.1074 / mcp.M114.041087. ЧВК 4256487. PMID 25154561.
- ^ Stynen B, Tournu H, Tavernier J, Van Dijck P (июнь 2012 г.). «Разнообразие генетических методов in vivo для изучения взаимодействия белок-белок: от дрожжевой двугибридной системы до сплит-люциферазной системы млекопитающих». Обзоры микробиологии и молекулярной биологии. 76 (2): 331–82. Дои:10.1128 / MMBR.05021-11. ЧВК 3372256. PMID 22688816.
- ^ а б c Хамди А., Колас П. (февраль 2012 г.). «Дрожжевые двугибридные методы и их применение в открытии лекарств». Тенденции в фармакологических науках. 33 (2): 109–18. Дои:10.1016 / j.tips.2011.10.008. PMID 22130009.
- ^ Fromont-Racine M, Rain JC, Legrain P (июль 1997 г.). «К функциональному анализу генома дрожжей через исчерпывающий двухгибридный скрининг». Природа Генетика. 16 (3): 277–82. Дои:10.1038 / ng0797-277. PMID 9207794. S2CID 32591856.
- ^ Лу Л., Хорстманн Х, Нг С., Хонг В. (декабрь 2001 г.). «Регулирование структуры и функции Гольджи с помощью ARF-подобного белка 1 (Arl1)». Журнал клеточной науки. 114 (Пт 24): 4543–55. PMID 11792819.
- ^ Khadka S, Vangeloff AD, Zhang C, Siddavatam P, Heaton NS, Wang L, Sengupta R, Sahasrabudhe S, Randall G, Gribskov M, Kuhn RJ, Perera R, LaCount DJ (декабрь 2011 г.). «Сеть физического взаимодействия вируса денге и белков человека». Молекулярная и клеточная протеомика. 10 (12): M111.012187. Дои:10.1074 / mcp.M111.012187. ЧВК 3237087. PMID 21911577.
- ^ Скоутерс, Флорис; Ван Дейк, Патрик (7 августа 2019 г.). «Белково-белковые взаимодействия у Candida albicans». Границы микробиологии. 10: 1792. Дои:10.3389 / fmicb.2019.01792. ЧВК 6693483. PMID 31440220.
- ^ Стайнен Б., Ван Дейк П., Турну Г. (октябрь 2010 г.). «Двухгибридная система, адаптированная к кодонам CUG для патогенного гриба Candida albicans». Исследования нуклеиновых кислот. 38 (19): e184. Дои:10.1093 / nar / gkq725. ЧВК 2965261. PMID 20719741.
- ^ Скоутерс, Флорис; Манро, Кэрол А .; d’Enfert, Кристоф; Ван Дейк, Патрик; Митчелл, Аарон П. (22 августа 2018 г.). «Двухгибридная система с высокой пропускной способностью». мСфера. 3 (4). Дои:10.1128 / мСфера.00391-18. ЧВК 6106057. PMID 30135223.
- ^ Легран, Мелани; Башелье-Басси, Софи; Ли, Кинсук К.; Чаудхари, Йогеш; Турну, Элен; Арбогаст, Лоуренс; Бойер, Элен; Шовель, Мюриэль; Кабрал, Витор; Мофре, Коринн; Нессейр, Одри; Масланка, Ирена; Пермаль, Эммануэль; Россиньол, Тристан; Уокер, Луиза А; Зейдлер, Юте; Знаиди, Садри; Скоутерс, Флорис; Маджье, Шарлотта; Жюльен, Рено А; Ма, Лоуренс; Тичит, Магали; Бушье, Кристиан; Ван Дейк, Патрик; Манро, Кэрол А; d’Enfert, Кристоф (10 августа 2018 г.). «Создание геномных платформ для изучения патогенеза Candida albicans» (PDF). Исследования нуклеиновых кислот. 46 (16): 8664. Дои:10.1093 / нар / gky747. ЧВК 6144791. PMID 30107554.
- ^ Скоутерс, Флорис; Ван Дейк, Патрик (2019). «Белково-белковые взаимодействия у Candida albicans». Границы микробиологии. 10: 1792. Дои:10.3389 / fmicb.2019.01792. ISSN 1664-302X. ЧВК 6693483. PMID 31440220.
- ^ https://www.promega.com/-/media/files/resources/promega-notes/66/the-checkmatetm-mammalian-two-hybrid-system.pdf?la=en
- ^ Фэн XH, Деринк Р. (2001). «Двухгибридные анализы млекопитающих: анализ белок-белковых взаимодействий в сигнальном пути трансформирующего фактора роста β». Двухгибридные системы. 177. С. 221–239. Дои:10.1385/1-59259-210-4:221. ISBN 978-1-59259-210-4. PMID 11530609.
- ^ а б Дин К.М., Сальвински X, Ксенариос I, Айзенберг Д. (май 2002 г.). «Белковые взаимодействия: два метода оценки надежности высокопроизводительных наблюдений». Молекулярная и клеточная протеомика. 1 (5): 349–56. Дои:10.1074 / mcp.M100037-MCP200. PMID 12118076.
- ^ Бакхольц Р.Г., Глисон М.А. (ноябрь 1991 г.). «Дрожжевые системы для промышленного производства гетерологичных белков». Био / Технологии. 9 (11): 1067–72. Дои:10.1038 / nbt1191-1067. PMID 1367623. S2CID 31597609.
- ^ Фаган Р., Флинт К.Дж., Джонс Н. (сентябрь 1994 г.). «Фосфорилирование E2F-1 модулирует его взаимодействие с продуктом гена ретинобластомы и аденовирусным белком E4 19 кДа». Клетка. 78 (5): 799–811. Дои:10.1016 / s0092-8674 (94) 90522-3. PMID 8087847. S2CID 22888513.
- ^ Лю, Цзюнь О. (1998). «Все, что вам нужно знать о дрожжевой двугибридной системе». Структурная биология природы. 5 (7): 535–536. Дои:10.1038/788. S2CID 37127696.
- ^ Ehlert A, Weltmeier F, Wang X, Mayer CS, Smeekens S, Vicente-Carbajosa J, Dröge-Laser W. (июнь 2006 г.). «Анализ двухгибридного белок-белкового взаимодействия в протопластах Arabidopsis: создание карты гетеродимеризации факторов транскрипции bZIP группы C и группы S». Журнал растений. 46 (5): 890–900. Дои:10.1111 / j.1365-313X.2006.02731.x. PMID 16709202.
- ^ Чхве Дж. Х., Ли Дж. А., Йим С. В., Лим С. С., Ли СН, Ли Ю. Д., Барч Д., Кандел Э. Р., Каанг Б. К. (2003). «Использование двухгибридной системы аплизии для изучения взаимодействия между факторами транскрипции, участвующими в долгосрочном облегчении нервной системы аплизии». Обучение и память. 10 (1): 40–3. Дои:10,1101 / лм. 55303. ЧВК 196654. PMID 12551962.
- ^ Lee JA, Lee SH, Lee C, Chang DJ, Lee Y, Kim H, Cheang YH, Ko HG, Lee YS, Jun H, Bartsch D, Kandel ER, Kaang BK (сентябрь 2006 г.). «PKA-активированный гетеродимер ApAF-ApC / EBP является ключевым последующим эффектором ApCREB и необходим и достаточен для консолидации долгосрочного содействия». Журнал клеточной биологии. 174 (6): 827–38. Дои:10.1083 / jcb.200512066. ЧВК 2064337. PMID 16966424.
- ^ Mon H, Sugahara R, Hong SM, Lee JM, Kamachi Y, Kawaguchi Y, Kusakabe T. (сентябрь 2009 г.). «Анализ взаимодействия белков с двугибридной системой в культивируемых клетках насекомых». Аналитическая биохимия. 392 (2): 180–2. Дои:10.1016 / j.ab.2009.05.033. PMID 19481053.
- ^ Гомманс WM, Haisma HJ, Rots MG (декабрь 2005 г.). «Разработка факторов транскрипции белка цинкового пальца: терапевтическая значимость включения или выключения экспрессии эндогенных генов по команде». Журнал молекулярной биологии. 354 (3): 507–19. Дои:10.1016 / j.jmb.2005.06.082. PMID 16253273.[постоянная мертвая ссылка ]
- ^ Ю Х, Браун П., Йилдирим М. А., Лемменс И., Венкатесан К., Сахали Дж., Хирозане-Кишикава Т., Гебреаб Ф., Ли Н., Симонис Н., Хао Т., Руал Дж. Ф., Дрикот А., Васкес А., Мюррей Р. Р., Саймон С., Тардиво Л., Там С., Сврзикапа Н., Фан С, де Смет А.С., Мотил А., Хадсон М.Э., Парк Дж., Синь Х, Кусик М.Э., Мур Т., Бун С., Снайдер М., Рот Ф.П., Барабаши А.Л., Тавернье Дж., Хилл DE, Vidal M (октябрь 2008 г.). «Качественная бинарная карта взаимодействия белков дрожжевой интерактомной сети». Наука. 322 (5898): 104–10. Bibcode:2008Sci ... 322..104Y. Дои:10.1126 / science.1158684. ЧВК 2746753. PMID 18719252.
- ^ Чен Ю.К., Раджагопала С.В., Стеллбергер Т., Уетц П. (сентябрь 2010 г.). «Исчерпывающий сравнительный анализ дрожжевой двухгибридной системы». Природные методы. 7 (9): 667–8, ответ автора 668. Дои:10.1038 / nmeth0910-667. PMID 20805792. S2CID 35834541.
- ^ Koegl M, Uetz P (декабрь 2007 г.). «Улучшение двугибридных систем скрининга дрожжей». Брифинги по функциональной геномике и протеомике. 6 (4): 302–12. Дои:10.1093 / bfgp / elm035. PMID 18218650.
внешняя ссылка
| Библиотечные ресурсы о Двухгибридный скрининг |
- Подробная информация о двухгибридной системе родственной техники
- Обзор дрожжевой двухгибридной системы от Science Creative Quarterly
- Совместимые со шлюзом дрожжевые грохоты One-Hybrid
- Видео анимация Дрожжевой двухгибридной системы
- Два-гибрид + система + методы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Двугибридные дрожжи
- База данных BioGrid с белок-белковым взаимодействием
