Триметилолпропан - Trimethylolpropane
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2- (гидроксиметил) -2-этилпропан-1,3-диол | |
| Другие имена ТМП, 2-этил-2-гидроксиметил-1,3-пропандиол | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.000.978 |
| Номер ЕС |
|
| MeSH | C018163 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C6ЧАС14О3 | |
| Молярная масса | 134,17 г / моль |
| Внешность | Белое твердое вещество |
| Запах | Слабый запах |
| Плотность | 1,084 г / мл |
| Температура плавления | 58 ° С (136 ° F, 331 К) |
| Точка кипения | 289 ° С (552 ° F, 562 К) |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 172 ° С (342 ° F, 445 К) |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
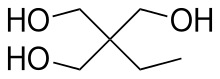
Триметилолпропан (TMP) - это органическое соединение с формулой CH3CH2C (CH2ОЙ)3. Это твердое вещество от бесцветного до белого со слабым запахом триол. Содержит три гидрокси функциональные группы, ТМП является широко используемым строительным материалом в полимерной промышленности.
Производство
TMP производится в два этапа, начиная с конденсация из бутанал с формальдегид:
- CH3CH2CH2CHO + 2 CH2O → CH3CH2C (CH2ОЙ)2CHO
Второй шаг влечет за собой Каннизаро реакция:
- CH3CH2C (CH2ОЙ)2CHO + CH2О + NaOH → СН3CH2C (CH2ОЙ)3 + NaO2CH
Таким образом ежегодно производится около 200 000 000 кг.[1]
Приложения
ТМП в основном потребляется как предшественник алкид смолы. В противном случае акрилированные и алкоксилированные ТМФ используются в качестве многофункциональных мономеров для получения различных покрытий, этоксилированных и пропоксилированных ТМП, полученных конденсацией ТМП и эпоксиды, используются для производства гибких полиуретаны. Производные аллилового эфира ТМП, с формулой CH3CH2C (CH2ОСН2CH = CH2)3-х(CH2ОЙ)Икс являются предшественниками глянцевых покрытий и ионообменные смолы. В оксетан «ТМПО» - фотоиндуцируемый инициатор полимеризации.[1]

