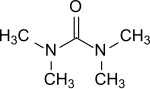
Тетраметилмочевина - Tetramethylurea
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC N,N,N ',N '-Тетраметилмочевина | |
| Другие имена 1,1,3,3-тетраметилмочевина * TMU | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.010.159 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C5ЧАС12N2О | |
| Молярная масса | 116.164 г · моль−1 |
| Внешность | Бесцветная жидкость |
| Плотность | 0,968 г / мл |
| Температура плавления | -1,2 ° С (29,8 ° F, 271,9 К) |
| Точка кипения | 176,5 ° С (349,7 ° F, 449,6 К) |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H302, H360, H361 | |
| P201, P202, P264, P270, P281, P301 + 312, P308 + 313, P330, P405, P501 | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Тетраметилмочевина это органическое соединение с формулой (Me2N)2CO. Это замещенный мочевина. Эта бесцветная жидкость используется как апротический -полярный растворитель, особенно для ароматические соединения и используется e. грамм. для реактивов Гриньяра.[1]
Производство
Подробно описаны синтез и свойства тетраметилмочевины.[1]
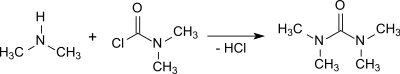
Реакция диметиламин с фосген при наличии эл. грамм. 50% едкий натр раствор и последующая экстракция 1,2-дихлорэтан дает тетраметилмочевину с выходом 95%.[2]

Реакции с диметилкарбамоилхлорид или фосген очень экзотермический и удаление образовавшихся диметиламина гидрохлорид требует некоторых усилий.[1]
Реакция дифенилкарбонат с диметиламином в автоклав также эффективен.

Тетраметилмочевина образуется при реакции диметилкарбамоилхлорида с безводный карбонат натрия с доходностью 96,5%.[3]
Диметилкарбамоилхлорид также реагирует с избытком диметиламина с образованием тетраметилмочевины. Даже если продукт загрязнен и имеет неприятный запах, его можно очистить, добавив оксид кальция и последующие фракционная перегонка.[4]
Тетраметилмочевина также образуется при окислении тетракис (диметиламино) этилен (TDAE), очень богатый электронами алкен[5] и сильный восстановитель, доступный от трис (диметиламино) метан пиролизом[6] или из хлортрифторэтен и диметиламин.[7]

Тетракис (диметиламино) этилен (TDAE) реагирует с кислородом в (2 + 2) реакция циклоприсоединения к 1,2-диоксетан который разлагается до электронно-возбужденной тетраметилмочевины. Он возвращается в основное состояние, излучая зеленый свет с максимумом излучения при 515 нм.[8][9]

Характеристики
Тетраметилмочевина - это прозрачная бесцветная жидкость со слабым ароматическим запахом, которая смешивается с водой и многими органическими растворителями.[10] Необычным для мочевины является жидкое состояние тетраметилмочевины в диапазоне> 170 ° C.
Приложения
Тетраметилмочевина смешивается с различными органическими соединениями, включая кислоты, такие как уксусная кислота или базы, такие как пиридин и отличный растворитель для органических веществ, таких как ε-капролактам или же бензойная кислота и растворяет даже некоторые неорганические соли, такие как нитрат серебра или же йодид натрия.[11][12] Благодаря отличным свойствам растворителя тетраметилмочевина часто используется в качестве замены канцерогенным веществам. гексаметилфосфорамид (HMPT).[13]
Тетраметилмочевина подходит в качестве реакционной среды для полимеризации хлоридов ароматических двухосновных кислот (таких как изофталевая кислота ) и ароматный диамины (такие как 1,3-диаминобензол (м-фенилендиамин)) в арамиды Такие как поли (м-фениленизофталамид) (Номекс®)[14][15]
Полимеризация 4-аминобензойная кислота хлорид гидрохлорид в тетраметилмочевине дает изотропные вязкие растворы поли (п-бензамид) (PPB), которые можно напрямую прядить в волокна.[16]

В тетраметилмочевинеLiCl Смеси стабильные изотропные растворы могут быть получены до концентрации полимера PPB 14%.[17]
Тетраметилмочевина также растворяет эфир целлюлозы и набухает другие полимеры, такие как поликарбонаты, поливинил хлорид или алифатические полиамиды, обычно при повышенной температуре.[1]
Сильный и затрудненный ненуклеофильный гуанидин основания доступны из тетраметилмочевины простым способом,[18][19] которые в отличие от конденсированных амидиновых оснований DBN или же DBU не алкилирован.

Модификация Реакция Кенигса-Кнорра для строительства гликозиды из 2,3,4,6-тетра-O-ацетил-α-D-глюкопиранозил бромида (ацетобромоглюкоза ) происходит от С. Ханессиана, который использовал серебряную соль трифторметансульфонат серебра (TfOAg) и в качестве акцептора протонов тетраметилмочевина.[20] Этот вариант процесса отличается упрощенным управлением процессом, высоким аномерная чистота и высокие выходы продукции. Если реакцию проводят с ацетобромоглюкоза и трифлат серебра / тетраметилмочевины при комнатной температуре, тогда тетраметилмочевина вступает в реакцию не только как основание, но также и с гликозилом с образованием хорошо выделяемых трифлатов урония с выходом 56%.[21]

Безопасность
Острая токсичность тетраметилмочевины умеренная. Однако он эмбриотоксичен и тератоген по отношению к нескольким видам животных.[22]
Рекомендации
- ^ а б c d А. Люттрингхаус; Х.-В. Дирксен (1963), "Tetramethylharnstoff als Lösungsmittel und Reaktionspartner", Энгью. Chem. (на немецком), 75 (22), стр. 1059–1068, Дои:10.1002 / ange.19630752204
- ^ США 3681457, «Способ получения тетраметилмочевины»
- ^ J.K. Лоусон-младший; J.A.T. Крум (1963), "Диметиламиды из карбоксилатов щелочных металлов и диметилкарбамоилхлорид", J. Org. Chem. (на немецком), 28 (1), стр. 232–235, Дои:10.1021 / jo01036a513
- ^ США 3597478, «Получение тетраметилмочевины»
- ^ Х. Бок; Х. Боррманн; З. Гавлас; Х. Оберхаммер; К. Рупперт; А. Саймон (1991), "Tetrakis (dimethylamino) ethen: Ein extrem elektronenreiches Molekül mit ungewöhnlicher Struktur sowohl im Festkörper als auch in der Gasphase", Энгью. Chem. (на немецком), 103 (12), стр. 1733–1735, Дои:10.1002 / ange.19911031246
- ^ Х. Вайнгартен; W.A. White (1966), "Синтез тетракис (диметиламино) этилена", J. Org. Chem. (на немецком), 31 (10), стр. 3427–3428, Дои:10.1021 / jo01348a520
- ^ США 3293299, «Способ получения тетракис (диметиламино) этилена»
- ^ ОН. Винберг; Дж. Р. Даунинг; Д.Д. Коффман (1965), «Хемилюминесценция тетракис (диметиламино) этилена», Варенье. Chem. Soc. (на немецком), 87 (9), стр. 2054–2055, Дои:10.1021 / ja01087a039
- ^ "Chemilumineszenz von TDAE" (на немецком). illumina-chemie.de. 2014-08-08. Получено 2016-08-22.
- ^ Р.М. Джулиано (2004). «Тетраметилмочевина». Энциклопедия реагентов для органического синтеза. Дои:10.1002 / 047084289X.rn00399. ISBN 978-0471936237.
- ^ Б.Дж. Баркер; J.A. Карузо (1976), Химия неводных растворителей, IV. Явления в растворах и апротонные растворители (на немецком языке), Нью-Йорк: Academic Press, стр.110–127, ISBN 978-0-12-433804-3
- ^ Б.Дж. Баркер; Дж. Розенфарб; J.A. Карузо (1979), "Harnstoffe als Lösungsmittel in der chemischen Forschung", Энгью. Chem. (на немецком), 91 (7), стр. 560–564, Дои:10.1002 / ange.19790910707
- ^ А.Дж. Chalk (1970), «Использование гидрида натрия в качестве восстановителя в азотсодержащих растворителях I. Восстановление хлорсиланов в гексаалкилфосфорных триамидах и тетраалкилмочевинах», J. Organomet. Chem. (на немецком), 21 (1), стр. 95–101, Дои:10.1016 / S0022-328X (00) 90598-9
- ^ Г. Одиан (2004), Принципы полимеризации, 4-е издание (на немецком языке), Хобокен, Нью-Джерси: Wiley-Interscience, стр. 100, ISBN 978-0-471-27400-1
- ^ Х. Г. Роджерс; Р.А. Гаудиана; ТУАЛЕТ. Холлинсед; P.S. Кальянараман; J.S. Манелло; К. Макговерн; Р.А. Миннс; Р. Сахатджян (1985), «Сильноаморфные, двупреломляющие, пара-связанные ароматические полиамиды», Макромолекулы (на немецком), 18 (6), стр. 1058–1068, Bibcode:1985MaMol..18.1058R, Дои:10.1021 / ma00148a003
- ^ Дж. Престон (1978), А. Блюмштейн (ред.), Синтез и свойства стержневидных конденсационных полимеров в жидкокристаллическом порядке в полимерах (на немецком языке), Нью-Йорк: Academic Press, стр.141–166, ISBN 978-0-12-108650-3
- ^ S.L. Кволек; П.В. Морган; J.R. Schaefgen; Л.В. Гулрих (1977), «Синтез, анизотропные растворы и волокна поли (1,4-бензамида)», Макромолекулы (на немецком), 10 (6), стр. 1390–1396, Bibcode:1977MaMol..10,1390K, Дои:10.1021 / ma60060a041
- ^ D.H.R. Бартон, М. Чен, Я.С. Ясбереньи, Д.К. Тейлор (1997). «Получение и реакции 2-трет-бутил-1,1,3,3-тетраметилгуанидина: 2,2,6-триметилциклогексен-1-иодид». Органический синтез. 74: 101. Дои:10.15227 / orgsyn.074.0101.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ D.H.R. Бартон; Дж. Д. Эллиотт; S.D. Géro (1981), "Синтез и свойства ряда сильных, но затрудненных органических оснований", J. Chem. Soc., Chem. Commun. (на немецком языке) (21), стр. 1136–1137, Дои:10.1039 / C39810001136
- ^ С. Ханессиан; Дж. Бануб (1977), «Химия гликозидной связи. Эффективный синтез 1,2-транс-дисахаридов», Carbohydr. Res. (на немецком), 53, стр. C13 – C16, Дои:10.1016 / S0008-6215 (00) 85468-3
- ^ К. Бок; Х. Фернандес-Боланос Гусман; С. Рефн (1992), «Синтез и свойства 1,1,3,3-тетраметил-2- (2,3,4,6-тетра-О-ацетил-α-D-глюкопиранозил) трифлат урония », Carbohydr. Res. (на немецком), 232 (2), стр. 353–357, Дои:10.1016 / 0008-6215 (92) 80067-Б
- ^ Коллекция MAK по охране труда и технике безопасности (2012), «Tetramethylharnstoff [Документация о ценностях MAK на немецком языке, 1979]», Tetramethylharnstoff [Документация о ценностях MAK на немецком языке, 1979], Документация и методы (на немецком языке), Weinheim: Wiley-VCH, pp. 1–6, Дои:10.1002 / 3527600418.mb63222d0007, ISBN 978-3527600410
