Руссен красная соль - Roussins red salt - Wikipedia
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК тетранитрозил-ди-μ-сульфидодиирон калия (Fe–Fe)(2–) | |
| Другие имена Феррат (2-), тетранитрозилди-мю-тиоксоди, (Fe-Fe), дикалий | |
| Идентификаторы | |
3D модель (JSmol ) | |
| |
| Характеристики | |
| Fe2N4K2О4S2 | |
| Молярная масса | 374,04 г / моль |
| Внешность | Темно-красные кристаллы |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Красная соль Руссена это неорганическое соединение с формулой K2[Fe2S2(НЕТ)4]. Этот нитрозил металла был впервые описан Захари Руссеном в 1858 году, что сделало его одним из первых синтетических железо-серные кластеры.[1][2]
Структура и склеивание
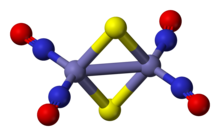
Анион красной соли Руссена представляет собой битетраэдр с общими ребрами, в котором пара Fe (NO)2 блоки соединены парой сульфид лиганды. Fe-НЕТ Связи являются линейными, что указывает на то, что NO действует как трехэлектронный донор.[3] В диамагнитный соединение подчиняется 18-электронное правило. Темно-красный цвет комплекса относится к ряду передача заряда взаимодействия железного ядра с нитрозильными лигандами.[4]
Синтез
Французский химик З. Руссен[5] впервые приготовили эту соль, исследуя реакции между нитропруссид ион ([Fe (CN)5НЕТ]2−) и сера.[6] Соль может быть получена реакцией сульфидных солей с нитрозилгалогенидами железа:[7]
- Fe2я2(НЕТ)4 + 2Li2S → Ли2Fe2S2(НЕТ)4 + 2LiI
Для получения «сложных эфиров» соль алкилируют:
- Ли2Fe2S2(НЕТ)4 + 2 RX → Fe2(SR)2(НЕТ)4 + 2 LiX
Сложные эфиры также легко можно получить реакцией Fe2я2(НЕТ)4 с тиол.
Возникновение и потенциальные применения
Он встречается в природе в виде «сложных эфиров» с формулой Fe.2(SR)2(НЕТ)4, где «R» представляет собой любую алкильную группу [1]. Кроме того, красная соль Руссена обсуждается в области микробиологии и пищевой науки из-за ее мутагенных свойств.[8]
Сложноэфирные производные исследуются как оксид азота доноры в биологии и медицине. Из-за относительно низкой токсичности и хорошей стабильности красная соль Руссена. Фотолиз соединения вызывает высвобождение NO, тем самым повышая чувствительность клеток-мишеней к воздействию радиации [2].
Смотрите также
Рекомендации
- ^ Батлер, Энтони Р. (июль 1982 г.). "Химик З. Руссен (1827-94)". Журнал химического образования. 59 (7): 549. Дои:10.1021 / ed059p549.
- ^ Руссен, М. Л. (1858). "Recherches sur les nitrosulfures doubles de fer (nouvelle classe de sels)". Анна. Чим. Phys. 52: 285–303.
- ^ Thomas, J. T .; Робертсон, Дж. Х .; Кокс, Э. Г. (1 сентября 1958 г.). «Кристаллическая структура красного этилового эфира Руссена». Acta Crystallographica. 11 (9): 599–604. Дои:10.1107 / S0365110X58001602.
- ^ Яворска, Мария; Стасицкая, Зофия (2005). "Структура и УФ-видимая спектроскопия биядерных нитрозильных комплексов железо-сера [Fe2S2(НЕТ)4]2− и [Fe2(SR)2(НЕТ)4]". Новый журнал химии. 29 (4): 604. Дои:10.1039 / B409519G.
- ^ Батлер, Энтони Р. (июль 1982 г.). "Химик З. Руссен (1827-94)". Журнал химического образования. 59 (7): 549. Дои:10.1021 / ed059p549.
- ^ Ханс Рейлен, Адольф против Фридолсхайма (1927 г.). "Über komplexe Stickoxydverbindungen und das sogenannte einwertige Eisen". Юстус Либигс Аннален дер Хеми. 457: 71. Дои:10.1002 / jlac.19274570103.
- ^ ТБ Раухфус; Т. Д. Уэзерилл (1982). «Еще раз о красной соли Руссена: реакционная способность Fe2 (μ-E) 2 (NO) 42- (E = S, Se, Te) и родственных». Неорганическая химия. 21 (2): 827–830. Дои:10.1021 / ic00132a071.
- ^ Greenwood, N. N .; И Эрншоу, А. (1997). Химия элементов (2-е изд.), Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
