Синтез маделунга - Madelung synthesis
| Синтез индола Маделунга | |
|---|---|
| Названный в честь | Вальтер Маделунг |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC ID онтологии | RXNO: 0000511 |
В Синтез маделунга это химическая реакция который производит (замещенный или незамещенный) индолы посредством внутримолекулярный циклизация N-фениламидов с использованием сильного основания при высокой температуре. Синтез Маделунга был описан в 1912 году Вальтером Маделунгом, когда он заметил, что 2-фенилиндол был синтезирован с использованием N-бензоил-о-толуидин и два эквивалента этоксид натрия в горячей, безвоздушной реакции. Общие условия реакции включают использование натрий или калий алкоксид в качестве базы в гексан или тетрагидрофуран растворители при температуре 200–400 ° C. А гидролиз Этап также требуется при синтезе. Синтез Маделунга важен, потому что это одна из немногих известных реакций, которые производят индолы в результате катализируемой основанием термической циклизации N-ацил-о-толуидинов. Общая реакция синтеза Маделунга приводится ниже.
Общая реакция

Этот метод по существу ограничивается получением 2-алкинилиндолов (труднодоступных через электрофильное ароматическое замещение ) из-за жестких условий реакции. Подробный механизм реакции синтеза Маделунга следует ниже.
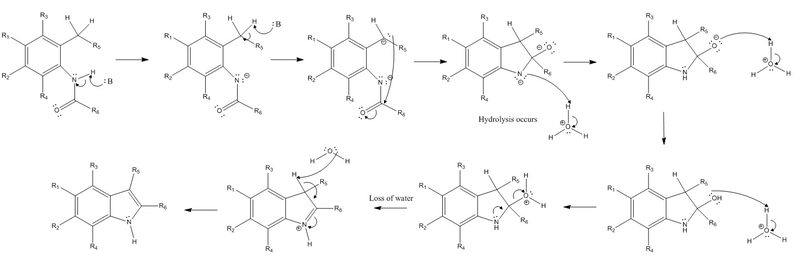
Механизм реакции
Реакция начинается с извлечения водород от азот из амид заместитель и извлечение бензиловый водород из заместителя орто к амидному заместителю сильным основанием. Далее карбанион в результате экстракции бензилового водорода выполняет нуклеофильная атака на электрофильный карбонил углерод амидной группы. Когда это происходит, пи-связь амида превращается в одинокая пара, создавая отрицательно заряженный кислород. После этих начальных этапов сильное основание больше не требуется, и должен происходить гидролиз. Отрицательно заряженный азот протонируется, чтобы восстановить свой нейтральный заряд, а кислород протонируется дважды, чтобы иметь положительный заряд, чтобы стать хорошим. уходящая группа. Неподеленная пара от азота образует пи-связь, чтобы удалить положительно заряженную уходящую группу, а также заставляет азот нести положительный заряд. Заключительный этап реакции - это реакция элиминации (в частности E2 реакция ), который включает извлечение другого водорода, который когда-то был бензиловым, до бициклическое соединение образовалась, электроны которой превращаются в новую пи-связь в кольцевой системе. Это позволяет пи-связи, образованной азотом на предыдущем этапе, превратиться обратно в неподеленную пару на азоте, чтобы восстановить нейтральный заряд азота.
Достижения в улучшении условий реакции
Были применены различные методы для увеличения урожайности желаемого индол товар. Когда ароматическое кольцо имеет электронодонорный заместителей получают более высокие выходы, и наоборот, когда ароматическое кольцо имеет электроноакцепторный заместители.[1] Однако, когда заместитель R5 является электроноакцепторным заместителем, выход увеличивается, а не уменьшается. Кроме того, эффективность реакции также сильно зависит от объема заместителя R6. Чем больше эта группа, тем менее эффективна реакция. Условия, необходимые для синтеза Маделунга, довольно жесткие. К счастью, вышеупомянутые модификации были с тех пор применены для повышения его практичности, работая над снижением требуемой температуры, при которой проводится реакция, и повышением желаемого выхода продукта. Например, когда электронодонорные компоненты размещены на ароматическом кольце N-фениламид и электроноакцепторный заместитель замещен у R5, требуемая температура для реакции снижается примерно до 25 ° C.[1] Еще более впечатляюще то, что исследователи обнаружили, что требуемая температура для синтеза Маделунга снижается до диапазона температур от -20 до 25 ° C, когда бутиллитий (BuLi) и диизопропиламид лития (LDA) основания, и когда тетрагидрофуран используется в качестве растворителя.[2] Эта конкретная модификация, использование любого из этих опосредованных металлом оснований, называется вариацией Маделунга-Хулихана.[3]
Синтетические приложения
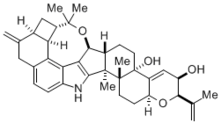
Синтез Маделунга имеет много важных приложений в химия, биохимия, и промышленная химия. Эта реакция использовалась для синтеза с выходом 81% архитектурно сложного треморгенного индольного алкалоида (-) - пенитрем D, молекулы, естественно производимой грибок спорыньи что вызывает различные мышечные и неврологические заболевания у домашний скот.[4] Поскольку этот токсин в конечном итоге вызывает серьезные экономические проблемы в животноводстве, понимание того, как синтезировать и легко разлагать алкалоид (-) - пенитрем D, имеет большое значение. Тем не менее, синтез такой сложной молекулы сам по себе был невероятным достижением.
Другой аспект, благодаря которому синтез Маделунга оказался полезным, - это синтез 2,6-дифенил-1,5-диаза-1,5-дигидро-s-Indacene, из 2,5-диметил-1,4-фенилендиамина.[5]
Этот синтез был выполнен без модификации синтеза Маделунга с использованием основания этилата натрия при температуре 320 - 330 ° C. Этот индасен оказался органический светоизлучающий диод которые могут иметь важное применение для недорогих световых дисплеев в коммерческой промышленности.
Модифицированный Смитом синтез Маделунга
Модифицированный Смитом синтез Маделунга, также называемый синтезом индола Смита, был открыт в 1986 году Амосом Смитом и его исследовательской группой. В этом синтезе используется реакция конденсации литийорганических реагентов, полученных из 2-алкил-N-триметилсилил анилины от сложные эфиры или карбоновые кислоты с образованием замещенных индолов.[6] Этот синтез оказался применимым к широкому спектру замещенных анилинов, в том числе с алкил, метокси, и галогенид групп, и может реагировать с не подлежащий енолизации сложные эфиры или лактоны с получением промежуточных соединений N-литиокетамина. Эти промежуточные продукты затем подвергаются внутримолекулярной гетероатом Олефинирование Петерсона чтобы получить индолинины, которые затем таутомеризовать к 2-замещенным индолам. Синтез индола Смита - одна из наиболее важных модификаций синтеза Маделунга.
Механизм реакции синтеза индола Смита
Синтез индола Смита начинается с использования двух эквивалентов литийорганический реагент (поскольку литийорганические реагенты являются очень сильными основаниями) для извлечения водорода как из алкильного заместителя, так и из азота, что приводит к отрицательному заряду на обоих. Синтез протекает с нуклеофильной атакой карбаниона на электрофильный карбонильный углерод сложного эфира или карбоновой кислоты. Когда это происходит, пи-связь электрофил превращается в неподеленную пару на кислороде. Эти неподеленные пары затем снова превращаются в пи-связь, что приводит к вытеснению группы -OR. Затем отрицательно заряженный азот выполняет нуклеофильную атаку на соседний электрофильный карбонильный углерод, снова заставляя пи-связь электрофила превращаться в неподеленную пару на кислороде. Этот отрицательно заряженный кислород затем выполняет нуклеофильную атаку на кремний атом триметилсилильной (TMS) группы, в результате чего получается трициклическое соединение, а также положительно заряженный атом кремния и нейтральный атом кислорода. Синтез происходит через внутримолекулярный гетероатом Олефинирование по Петерсону, в конечном итоге приводящее к реакции элиминирования, которая удаляет группу ТМСО и образует пи-связь в пятичленном кольце у атома азота. Затем происходит кето-енольная таутомерия, приводящая к желаемому продукту.

использованная литература
- ^ а б Курти, Ласло; Чако, Барбара (2005). Стратегические применения названных реакций в органическом синтезе. Берлингтон, Массачусетс: Elsevier Academic Press. п. 270. ISBN 0-12-429785-4.
- ^ Хулихан, Уильям; Паррино, Уике (7 мая 1981 г.). «Литирование N- (2-алкилфенил) алканамидов и родственных соединений. Модифицированный синтез индола Маделунга». Журнал органической химии. 46 (22): 4511–4515. Дои:10.1021 / jo00335a038.
- ^ Гриббл, Гордон (23 марта 2000 г.). «Последние достижения в синтезе индольных колец - методология и приложения». Журнал химического общества, Perkin Transactions 1. Транзакции Перкина 1 (7): 5. Дои:10.1039 / A909834H.
- ^ Смит, Амос; Канох, Исияма; Минакава, Ренье; Харц, Чо; Цуй, Мозер (9 июля 2003 г.). «Треморгенные индольные алкалоиды. Полный синтез (-) - Penitrem D». Журнал Американского химического общества. 125 (7): 8828–8837. Дои:10.1021 / ja034842k. PMID 12837093.
- ^ Чен; Сюй Цзинь; Пэн, Дессейн; Янссенс, Херманс; Боргс, Гейз (2 сентября 2003 г.). «Синтез, оптические и электролюминесцентные свойства нового индацена». Синтетические металлы. 139 (2): 529–534. Дои:10.1016 / S0379-6779 (03) 00338-2.
- ^ Смит, Амос; Висник; Haseltine; Спренгелер (1986). "Металлоорганические реагенты в синтезе: новый протокол построения индольного ядра". Тетраэдр. 42 (11): 2957–2969. Дои:10.1016 / S0040-4020 (01) 90586-1.
