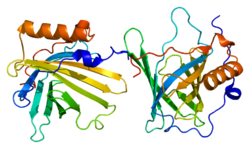Липокалин-2 - Lipocalin-2
Липокалин-2 (LCN2), также известный как онкоген 24p3 или же липокалин, связанный с желатиназой нейтрофилов (NGAL), является белок что в люди кодируется LCN2 ген.[5][6][7] NGAL участвует в врожденный иммунитет путем секвестирования утюг и предотвращение его использования бактерии, что ограничивает их рост.[8] Это выражается в нейтрофилы и на низких уровнях в почка, предстательная железа, и эпителий из респираторный и пищеварительные тракты.[7][9] NGAL используется как биомаркер травмы почек.[10]
Функция
Привязка NGAL к бактериальный сидерофоры важно в врожденный иммунный ответ к бактериальной инфекции. При столкновении с вторгающимися бактериями толл-подобные рецепторы на иммунные клетки стимулируют синтез и секрецию NGAL. Затем секретируемый NGAL ограничивает рост бактерий, секвестрируя железосодержащие сидерофоры.[11][12][13] Липокалин-2 связывается, наряду с сидерофорами бактерий, также с сидерофором млекопитающих 2,5-дигидроксибензойной кислотой (2,5-DHBA). Этот комплекс гарантирует, что избыток свободного железа не накапливается в цитоплазме. Клетки млекопитающих, лишенные 2,5-DHBA, накапливают аномальные внутриклеточные уровни железа, что приводит к высоким уровням активных форм кислорода.[14] Липокалин-2 также действует как фактор роста[12] и участвует в синаптическая пластичность.[15]Привязка NGAL к бактериальный сидерофоры важно в врожденный иммунный ответ к бактериальной инфекции. При столкновении с вторгающимися бактериями толл-подобные рецепторы на иммунные клетки стимулируют синтез и секрецию NGAL. Затем секретируемый NGAL ограничивает рост бактерий, секвестрируя железосодержащие сидерофоры.[11][12][16] Липокалин-2 связывается, наряду с сидерофорами бактерий, также с сидерофором млекопитающих 2,5-дигидроксибензойной кислотой (2,5-DHBA). Этот комплекс гарантирует, что избыток свободного железа не накапливается в цитоплазме. Клетки млекопитающих, лишенные 2,5-DHBA, накапливают аномальные внутриклеточные уровни железа, что приводит к высоким уровням активных форм кислорода.[14] Липокалин-2 также действует как фактор роста[12] и участвует в синаптическая пластичность.[15]
Клиническое значение
В случае острая травма почек (AKI), NGAL секретируется в больших количествах в кровь и мочу в течение 2 часов после травмы.[17] Потому что NGAL - это протеаза устойчивый и небольшой, белок легко выводится и обнаруживается с мочой.[18] Уровни NGAL у пациентов с ОПН были связаны с серьезностью их прогноза и могут использоваться в качестве биомаркера ОПН.[17] NGAL также можно использовать в качестве ранней диагностики для таких процедур, как хроническая болезнь почек, контрастно индуцированная нефропатия, и трансплантацияпочки.[19]
Здоровье почек чаще всего измеряется креатинин сыворотки. Креатинин сыворотки является маркером функции почек, тогда как NGAL является маркером повреждения почек.[20] Уровни NGAL являются более точным и чувствительным маркером для диагностики ОПП, чем креатинин сыворотки уровни. Следовательно, мониторинг уровней NGAL сокращает отсроченную диагностику и лечение ОПП.[21] Использование более чувствительного и специфического маркера позволяет более раннюю диагностику, правильную реакцию на ОПН и снизить риск заболеваемости и смертности.[22]
Уровень NGAL, измеренный у человека, пропорционален тяжести ОПП.[22] Лица с положительным результатом на NGAL, как правило, чаще получают заместительную почечную терапию и имеют более высокие показатели госпитальной смертности как в присутствии, так и в отсутствие креатинина сыворотки.[22] Следовательно, у человека может быть ОПН без креатинина сыворотки.
Возможность диагностировать ОПН до острой почечной недостаточности является финансово выгодной и благоприятной для профилактических мер.[23] Более чем у 10% людей в США разовьется какая-то хроническая болезнь почек (ХБП), с более высокой заболеваемостью у лиц, страдающих ожирением, повышенным холестерином и семейным анамнезом ХБП. Когда почка серьезно повреждена, точки возврата нет; поэтому ранняя диагностика повреждения почек важна для предотвращения ОПП. Использование NGAL в качестве биомаркера может снизить расходы на больницу, поскольку меньшее количество пациентов достигает критической стадии повреждения почек. В конечном счете, диагностика ОПН с помощью NGAL может сократить время пребывания пациента в больнице. Например, ранняя диагностика ОПН с использованием NGAL в качестве биомаркера может помочь пациенту избежать диализ почек.
Лабораторные измерения
Почечная экспрессия NGAL увеличивается в почках после травмы по разным причинам. Уровень NGAL в моче и плазме увеличивается в течение 2 часов после повреждения почек. Текущие лабораторные тесты позволяют измерить NGAL в сыворотке или моче в диапазоне от 25 до 5000 нг / мл.[24] Считается, что низкими уровнями NGAL являются 20 нг / мл, средними уровнями - 200 нг / мл и высокими уровнями - 1200 нг / мл.[24]
Исследование детей с педиатрическими сердечно-легочный обход Операции показали, что концентрация NGAL в моче выше 50 нг / мл через 2 часа после операции указывает на уровень креатинина в сыворотке на 50% выше базовых значений. Как правило, у детей уровень NGAL практически не определяется.[25] Поэтому исследования с участием детей считаются «чистыми». Взрослые пациенты, поступающие на операцию по поводу искусственного кровообращения, не считаются «чистыми» в исследованиях NGAL, потому что у взрослых часто есть другие расстройства, такие как воспалительные состояния, которые могут вызвать небольшое увеличение NGAL.[нужна цитата ]
Исследования AKI, посвященные использованию NGAL в качестве биомаркера, часто сравнивают сывороточный креатинин и продукцию NGAL. К сожалению, продукция креатинина в сыворотке непостоянна и может отражать гемодинамические вариации скорости клубочковой фильтрации, ранее известной как преренальная азотемия; поэтому сравнение не всегда надежно, поскольку креатинин и NGAL измеряют различные компоненты почечной (дис) функции.[18] Демонстрация того, что NGAL не увеличивается в условиях преходящих изменений креатинина, может помочь клиницистам определить, отражают ли изменения креатинина повреждение почек или, скорее, только неспецифические или легкие функциональные изменения функции почек.
Липокалин-2 (NGAL) обычно оценивается в клинических или исследовательских целях с использованием ELISA или же иммунотурбидиметрические анализы.
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000148346 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000026822 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Kjeldsen L, Johnsen AH, Sengeløv H, Borregaard N (май 1993 г.). «Выделение и первичная структура NGAL, нового белка, связанного с желатиназой нейтрофилов человека». J. Biol. Chem. 268 (14): 10425–32. PMID 7683678.
- ^ Чан П., Симон-Шазотт Д., Маттей М.Г., Генет Дж. Л., Салье Дж. П. (сентябрь 1994 г.). «Сравнительное картирование генов липокалина у человека и мыши: четыре гена для гамма-цепи C8 комплемента, простагландин-D-синтазы, онкогена-24p3 и связанного с прогестагеном белка эндометрия отображаются на HSA9 и MMU2». Геномика. 23 (1): 145–50. Дои:10.1006 / geno.1994.1470. PMID 7829063.
- ^ а б Cowland JB, Borregaard N (октябрь 1997 г.). «Молекулярная характеристика и образец тканевой экспрессии гена липокалина, связанного с желатиназой нейтрофилов, от человека». Геномика. 45 (1): 17–23. Дои:10.1006 / geno.1997.4896. PMID 9339356.
- ^ Ян Дж., Гетц Д., Ли Дж. Й., Ван В., Мори К., Сетлик Д., Ду Т, Эрдджумент-Бромаж Х, Темпст П., Стронг Р., Бараш Дж. (Ноябрь 2002 г.). «Путь доставки железа, опосредованный липокалином». Мол. Клетка. 10 (5): 1045–56. Дои:10.1016 / S1097-2765 (02) 00710-4. PMID 12453413.
- ^ Фридл А., Стоес С.П., Бакли П., Гулд М.Н. (июль 1999 г.). «Липокалин, связанный с желатиназой нейтрофилов в нормальных и неопластических тканях человека. Специфический тип клеток для экспрессии». Histochem. J. 31 (7): 433–41. Дои:10.1023 / А: 1003708808934. PMID 10475571. S2CID 19448533.
- ^ Девараджан П. (июнь 2010 г.). «Обзор: липокалин, связанный с желатиназой нейтрофилов: тропониноподобный биомаркер острого повреждения почек у человека». Нефрология (Карлтон). 15 (4): 419–28. Дои:10.1111 / j.1440-1797.2010.01317.x. PMID 20609093. S2CID 24061863.
- ^ а б Flo TH, Smith KD, Sato S, Rodriguez DJ, Holmes MA, Strong RK, Akira S, Aderem A (декабрь 2004 г.). «Липокалин 2 опосредует врожденный иммунный ответ на бактериальную инфекцию путем связывания железа». Природа. 432 (7019): 917–21. Дои:10.1038 / природа03104. PMID 15531878. S2CID 4422697.
- ^ а б c d Шмидт-Отт К.М., Мори К., Ли Дж.Й., Каландадзе А., Коэн Д.Д., Девараджан П., Бараш Дж. (Февраль 2007 г.). «Двойное действие липокалина, связанного с желатиназой нейтрофилов». Варенье. Soc. Нефрол. 18 (2): 407–13. Дои:10.1681 / ASN.2006080882. PMID 17229907.
- ^ Бергер, Торстен; Тогава, Ацуши; Дункан, Гордон С .; Элия, Эндрю Дж .; Ты-десять, Анник; Уэйкхэм, Эндрю; Fong, Hannah E.H .; Cheung, Кэрол С .; Мак, Так В. (07.02.2006). «Мыши с дефицитом липокалина 2 проявляют повышенную чувствительность к инфекции Escherichia coli, но не к ишемии-реперфузии». Труды Национальной академии наук Соединенных Штатов Америки. 103 (6): 1834–1839. Дои:10.1073 / pnas.0510847103. ISSN 0027-8424. ЧВК 1413671. PMID 16446425.
- ^ а б Девиредди Л. Р., Харт Д. О., Гетц Д. Н., Грин М. Р. (июнь 2010 г.). «Сидерофор млекопитающих, синтезированный ферментом с бактериальным гомологом, участвующим в производстве энтеробактина». Клетка. 141 (6): 1006–17. Дои:10.1016 / j.cell.2010.04.040. ЧВК 2910436. PMID 20550936.
- ^ а б McEwen, B.S .; Bowles, N.P .; Gray, J.D .; Hill, M.N .; Хантер, Р.Г .; Karatsoreos, I.N .; Наска, С (октябрь 2015 г.). «Механизмы стресса в головном мозге». Природа Неврологии. 18 (10): 1353–1363. Дои:10.1038 / № 4086. ЧВК 4933289. PMID 26404710.
- ^ Бергер, Торстен; Тогава, Ацуши; Дункан, Гордон С .; Элия, Эндрю Дж .; Ты-десять, Анник; Уэйкхэм, Эндрю; Fong, Hannah E.H .; Cheung, Кэрол С .; Мак, Так В. (07.02.2006). «Мыши с дефицитом липокалина 2 проявляют повышенную чувствительность к инфекции Escherichia coli, но не к ишемии-реперфузии». Труды Национальной академии наук Соединенных Штатов Америки. 103 (6): 1834–1839. Дои:10.1073 / pnas.0510847103. ISSN 0027-8424. ЧВК 1413671. PMID 16446425.
- ^ а б Беннетт М., Дент С.Л., Ма К., Дастрала С., Гренье Ф., Уоркман Р., Сайед Х., Али С., Бараш Дж., Девараджан П. (май 2008 г.). «NGAL в моче предсказывает тяжесть острого повреждения почек после кардиохирургии: проспективное исследование». Clin J Am Soc Nephrol. 3 (3): 665–73. Дои:10.2215 / CJN.04010907. ЧВК 2386703. PMID 18337554.
- ^ а б Уттенталь LO (апрель 2007 г.). "NGAL: Насколько полезен новый маркер повреждения почек?" (PDF). CLI.
- ^ Гольдштейн С.Л. (2011). «Биомаркеры острого повреждения почек: почечная стенокардия и потребность в почечном тропонине I». BMC Med. 9: 135. Дои:10.1186/1741-7015-9-135. ЧВК 3287120. PMID 22189039.
- ^ Хан В.К., Вагенер Г., Чжу Й., Ван С., Ли Х.Т. (май 2009 г.). «Биомаркеры в моче в раннем выявлении острого повреждения почек после кардиохирургических операций». Clin J Am Soc Nephrol. 4 (5): 873–82. Дои:10.2215 / CJN.04810908. ЧВК 2676184. PMID 19406962.
- ^ Лерма Э.В. (2012). «Новые биомаркеры почечной функции». Medscape.
- ^ а б c Хаасе М., Девараджан П., Хаасе-Фелиц А., Белломо Р., Круз Д. Н., Вагенер Г., Кравчески К. Д., Койнер Дж. Л., Мюррей П., Заппителли М., Голдштейн С. Л., Макрис К., Ронко С., Мартенсон Дж., Марлинг К. Р., Венге П., Siew E, Ware LB, Ikizler TA, Mertens PR (апрель 2011 г.). «Результат нейтрофилов, связанных с желатиназой, липокалин-положительных субклинических острых повреждений почек: многоцентровый объединенный анализ проспективных исследований». Варенье. Coll. Кардиол. 57 (17): 1752–61. Дои:10.1016 / j.jacc.2010.11.051. ЧВК 4866647. PMID 21511111.
- ^ Коллистер Д., Панну Н., Йе Ф, Джеймс М., Хеммельгарн Б., Чуй Б. и др. (Ноябрь 2017 г.). «Расходы на здравоохранение, связанные с ОПП» (PDF). Клинический журнал Американского общества нефрологов. 12 (11): 1733–1743. Дои:10.2215 / CJN.00950117. ЧВК 5672961. PMID 29051143.
- ^ а б Липпи Г., Алоэ Р., Сторелли А., Сервеллин Г., Тренти Т. (2012). «Оценка NGAL Test ™, полностью автоматизированного иммуноанализа липокалина, связанного с желатиназой нейтрофилов (NGAL), на Beckman Coulter AU 5822». Clin. Chem. Лаборатория. Med. 50 (9): 1581–4. Дои:10.1515 / cclm.2011.839. PMID 22962213. S2CID 39364947.
- ^ Krawczeski CD, Woo JG, Wang Y, Bennett MR, Ma Q, Devarajan P (июнь 2011 г.). «Концентрации липокалина, связанного с желатиназой нейтрофилов, позволяют прогнозировать развитие острого повреждения почек у новорожденных и детей после искусственного кровообращения». J. Pediatr. 158 (6): 1009–1015.e1. Дои:10.1016 / j.jpeds.2010.12.057. PMID 21300375.