Дифениловый эфир - Diphenyl ether
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 1,1'-оксидибензол[1] | |
| Другие имена | |
| Идентификаторы | |
3D модель (JSmol ) | |
| 1364620 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.002.711 |
| Номер ЕС |
|
| 165477 | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 3077 |
| |
| |
| Характеристики | |
| C12ЧАС10О | |
| Молярная масса | 170.211 г · моль−1 |
| Внешность | Бесцветное твердое вещество или жидкость |
| Запах | герань -подобно |
| Плотность | 1,08 г / см3 (20 ° С)[2] |
| Температура плавления | От 25 до 26 ° C (от 77 до 79 ° F, от 298 до 299 K) |
| Точка кипения | 121 ° С (250 ° F, 394 К)[3] при 1,34 кПа (10,05 мм рт. ст.), 258,55 ° C при 100 кПа (1 бар) |
| Нерастворимый | |
| Давление газа | 0,02 мм рт. Ст. (25 ° C)[2] |
| -108.1·10−6 см3/ моль | |
| Опасности | |
| Паспорт безопасности | Паспорт безопасности материалов Aldrich |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Предупреждение |
| H319, H400, H411 | |
| P264, P273, P280, P305 + 351 + 338, P337 + 313, P391, P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 115 ° С (239 ° F, 388 К) |
| Пределы взрываемости | 0.7%-6.0%[2] |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 3370 мг / кг (крыса, перорально) 4000 мг / кг (крыса, перорально) 4000 мг / кг (морская свинка, перорально)[4] |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | TWA 1 ppm (7 мг / м3)[2] |
REL (Рекомендуемые) | TWA 1 ppm (7 мг / м3)[2] |
IDLH (Непосредственная опасность) | 100 частей на миллион[2] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
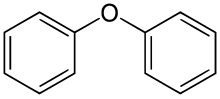
Дифениловый эфир это органическое соединение с формулой (C6ЧАС5)2О. Это бесцветное твердое вещество. Это самый простой дневник эфир, имеет множество нишевых приложений.[5]
Синтез и реакции
Дифениловый эфир и многие его свойства были впервые описаны еще в 1901 году.[6] Он синтезируется модификацией Синтез эфира Вильямсона, здесь реакция фенол и бромбензол в присутствии основание и каталитический количество медь:
- PhONa + PhBr → PhOPh + NaBr
Участвуя в аналогичных реакциях, дифениловый эфир является важным побочным продуктом в системах высокого давления. гидролиз из хлорбензол при производстве фенола.[7]
Родственные соединения получают Реакции Ульмана.[8]
Соединение претерпевает реакции, типичные для других фенил кольца, в том числе гидроксилирование, нитрование, галогенирование, сульфирование, и Алкилирование или ацилирование по Фриделю – Крафтсу.[5]
Использует
Основное применение дифенилового эфира в качестве эвтектика смесь с бифенил, используется как теплопередача средний. Такая смесь хорошо подходит для теплообмена из-за относительно большого диапазона температур ее жидкого состояния. Эвтектическая смесь [коммерчески Dowtherm A] состоит из 73,5% дифенилового эфира (дифенилоксид) и 26,5% бифенила (дифенила).[9][10]
Дифениловый эфир является исходным материалом при производстве феноксатиин через Феррарио реакция.[11] Феноксатиин используется в полиамид и полиимид производство.[12]
Из-за своего запаха напоминает душистая герань Благодаря своей стабильности и невысокой цене, дифениловый эфир широко используется в мыльной парфюмерии. Дифениловый эфир также используется в качестве технологической добавки при производстве полиэфиры.[5]
Родственные соединения
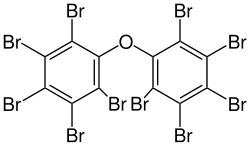
Несколько полибромированные дифениловые эфиры (ПБДЭ) являются полезными антипиренами. Из пента-, окта- и декаБДЭ, трех наиболее распространенных ПБДЭ, только декаБДЭ все еще широко используется с момента его запрета в Европейском союзе в 2003 году.[13] ДекаБДЭ, также известный как декабромдифенилоксид,[14] - это крупносерийный промышленный химикат, ежегодно производимый в США более 450 000 кг. Оксид декабромдифенила продается под торговым названием Saytex 102 как антипирен при производстве красок и армированных пластиков.
Рекомендации
- ^ а б c «ГЛАВА P-6. Приложения к определенным классам соединений». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 705. Дои:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ а б c d е ж Карманный справочник NIOSH по химической опасности. "#0496". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Байерс, Чарльз Х .; Уильямс, Дэвид Ф. (июль 1987 г.). «Вязкости чистых полиароматических углеводородов». Журнал химических и технических данных. 32 (3): 344–348. Дои:10.1021 / je00049a018. ISSN 0021-9568.
- ^ «Фениловый эфир». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c Fiege, H .; Voges, H.-M .; Хамамото, Т; Умемура, С .; Iwata, T .; Miki, H .; Fujita, Y .; Buysch, H.-J .; Гарбе, Д. (2000). «Производные фенола». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a19_313.
- ^ Кук, А. Н. (1901). «Производные фенилового эфира». Журнал Американского химического общества. 23 (10): 806–813. Дои:10.1021 / ja02037a005.
- ^ Fahlbusch, K.-G .; Hammerschmidt, F.-J .; Panten, J .; Pickenhagen, W .; Schatkowski, D .; Bauer, K .; Garbe, D .; Сурбург, Х. (2003). Ароматизаторы и ароматизаторы. Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a11_141. ISBN 978-3-527-30673-2.
- ^ Ungnade, H.E .; Орволл, Э. Ф. (1946). «2-Метокси дифениловый эфир». Орг. Синтезатор. 26: 50. Дои:10.15227 / orgsyn.026.0050.
- ^ Апелляционная жалоба на патент № 7555 Таможенный и патентный апелляционный суд США, 7 апреля 1966 г. http://openjurist.org/358/f2d/750/application-of-edward-s-blake-and-william-c-hammann
- ^ "Даутерм"® A 44570 ".
- ^ Suter, C.M .; Максвелл, К. Э. (1943). «Фенокстин». Органический синтез.; Коллективный объем, 2, п. 485
- ^ Мицуру Уэода; Тацуо Айзава; Ёсио Имаи (1977). «Получение и свойства полиамидов и полиимидов, содержащих звенья феноксатиина». Журнал науки о полимерах: издание по химии полимеров. 15 (11): 2739–2747. Дои:10.1002 / pol.1977.170151119.
- ^ ДИРЕКТИВА 2003/11 / EC Европейского парламента и Совета
- ^ Суткер, Б. Дж. (2005). Антипирены. Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a11_123. ISBN 978-3-527-30673-2.

