Диметилглиоксим - Dimethylglyoxime
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК N,N ′-Дигидрокси-2,3-бутандиимин | |
Другие имена
| |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.002.201 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| C4ЧАС8N2О2 | |
| Молярная масса | 116.120 г · моль−1 |
| Внешность | Белый / не совсем белый порошок |
| Плотность | 1,37 г / см3 |
| Температура плавления | От 240 до 241 ° C (от 464 до 466 ° F, от 513 до 514 K) |
| Точка кипения | разлагается |
| низкий | |
| Структура | |
| 0 | |
| Опасности | |
| Главный опасности | Токсично, раздражает кожу / глаза |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H228, H301 | |
| P210, P240, P241, P264, P270, P280, P301 + 310, P321, P330, P370 + 378, P405, P501 | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Родственные соединения | Гидроксиламин салицилальдоксим |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
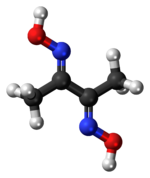
Диметилглиоксим это химическое соединение описывается формулой CH3C (NOH) C (NOH) CH3. Его сокращение: dmgH2 для нейтральной формы и dmgH для анионной формы, где H означает водород. Это бесцветное твердое вещество - диоксим производное дикетона бутан-2,3-диона (также известного как диацетил ). DmgH2 используется при анализе палладий или же никель. Его координационные комплексы представляют теоретический интерес как модели для ферментов и как катализаторы. Многие родственные лиганды можно получить из других дикетонов, например бензил.
Подготовка
Диметилглиоксим можно получить из бутанон сначала по реакции с этилнитрит давать биацетилмоноксим. Второй оксим устанавливается с использованием натрия гидроксиламин моносульфонат:[1]

Комплексы
Диметилглиоксим образует комплексы с металлами, в том числе Никель,[2] Палладий, и Кобальт.[3] Эти комплексы используются для отделения этих комплексов от растворов солей металлов. Он также используется в аффинаж драгоценных металлов осаждать палладий из решений хлорид палладия.
- Комплексы диметилглиоксима
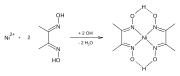
Реакция образования Ni-dmg

Образец Ni (dmgH)2

Строение хлор (пиридин) кобалоксима
Рекомендации
- ^ Semon, W. L .; Дамерелл, В. Р. (1930). «Диметилглиоксим». Органический синтез. 10: 22. Дои:10.15227 / orgsyn.010.0022.
- ^ Лев Чугаев (1905). "Über ein neues, empfindliches Reagens auf Nickel". Berichte der Deutschen Chemischen Gesellschaft. 38 (3): 2520–2522. Дои:10.1002 / cber.19050380317.
- ^ Girolami, G.S .; Rauchfuss, T.B .; Анджеличи, Р. Дж. (1999). Синтез и методы в неорганической химии: лабораторное руководство (3-е изд.). С. 213–215.




