Круговая перестановка в белках - Circular permutation in proteins

А круговая перестановка это отношения между белки в результате чего белки имеют измененный порядок аминокислоты в их пептидная последовательность. В результате структура белка с разными возможностями подключения, но в целом похожей трехмерной (3D) формой. В 1979 году первая пара циркулярно переставленных белков - конканавалин А и лектин - были обнаружены; в настоящее время известно более 2000 таких белков.
Круговая перестановка может произойти в результате эволюционный События, посттрансляционные модификации, или же искусственно созданный мутации. Две основные модели, предложенные для объяснения эволюции белков с циркулярной перестановкой, следующие: перестановка путем дублирования и деление и синтез. Перестановка путем дублирования происходит, когда ген подвергается дублирование сформировать тандемный повтор, перед удалением лишних участков белка; эта связь обнаруживается между сапозин и swaposin. Деление и слияние происходит, когда частичные белки сливаются с образованием единого полипептида, например, в никотинамиднуклеотидтрансгидрогеназы.
Круговые перестановки обычно разрабатываются в лаборатории, чтобы улучшить их каталитическая активность или же термостойкость, или исследовать свойства исходного белка.
Традиционный алгоритмы за выравнивание последовательностей и выравнивание конструкции не способны обнаружить круговые перестановки между белками. Новый нелинейный были разработаны подходы, которые преодолевают это и способны обнаруживать топология -независимое сходство.
История

В 1979 году Брюс Каннингем и его коллеги обнаружили первый в природе белок с циркулярной перестановкой.[1] После определения пептидной последовательности лектин протеин фавин, они заметили его сходство с известным протеином - конканавалин А - за исключением того, что концы были переставлены по кругу. Более поздняя работа подтвердила круговую перестановку между парой[2] и показали, что конканавалин А переставляется посттрансляционный[3] через расщепление и необычное белковое лигирование.[4]
После открытия природного белка с круговой перестановкой, исследователи искали способ имитировать этот процесс. В 1983 году Дэвид Голденберг и Томас Крейтон смогли создать версию белка с циклической перестановкой путем химически лигировать Термини, чтобы создать циклический белок, затем вводя новые терминалы в другом месте, используя трипсин.[5] В 1989 г. Каролин Люгер и ее коллеги представили генетический метод создания круговых перестановок путем тщательного фрагментирования и лигирования ДНК.[6] Этот метод позволял вводить перестановки на произвольных сайтах.[6]
Несмотря на раннее открытие посттрансляционных циклических перестановок и предположение о возможном генетическом механизме развития круговых перестановок, первая пара генов с циклическими перестановками была открыта только в 1995 году. Сапозины представляют собой класс белков, участвующих в сфинголипид катаболизм и презентация антигена из липиды в людях. Крис Понтинг и Роберт Рассел идентифицировал циркулярно переставленную версию сапозина, введенного в растение. аспарагиновая протеиназа, которую они прозвали свопозин.[7] Сапозин и свапозин были первым известным случаем двух природных генов, связанных посредством круговой перестановки.[7]
Сотни примеров пар белков, связанных посредством круговой перестановки, впоследствии были обнаружены в природе или получены в лаборатории. По состоянию на февраль 2012 г., База данных круговой перестановки[8] содержит 2238 пар белков с круговой перестановкой с известными структурами, и многие другие пары известны без структур.[9] База данных CyBase собирает белки, которые являются циклическими, некоторые из которых являются пермутированными вариантами циклических белков дикого типа.[10] SISYPHUS - это база данных, которая содержит коллекцию вручную подобранных выравниваний белков с нетривиальными отношениями, некоторые из которых имеют циклические перестановки.[11]
Эволюция
В настоящее время для объяснения эволюции белков с циркулярной перестановкой используются две основные модели: перестановка путем дублирования и деление и синтез. У этих двух моделей есть убедительные примеры, подтверждающие их, но относительный вклад каждой модели в эволюцию все еще обсуждается.[12] Были предложены другие, менее распространенные механизмы, такие как «вырезать и вставить».[13] или же "перетасовка экзонов ".[14]
Перестановка путем дублирования
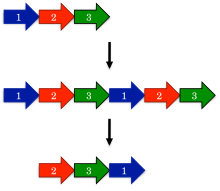
Самая ранняя модель, предложенная для эволюции круговых перестановок, - это перестановка с помощью механизма дублирования.[1] В этой модели ген-предшественник сначала подвергается дублирование и слияние, чтобы сформировать большой тандемный повтор. Следующий, стартовые и стоповые кодоны вводятся в соответствующие места в продублированном гене, удаляя лишние участки белка.
Одно удивительное предсказание перестановки с помощью механизма дублирования состоит в том, что могут происходить промежуточные перестановки. Например, дублированная версия белка должна оставаться функциональной, поскольку в противном случае эволюция быстро отобрала бы такие белки. Точно так же частично дублированные промежуточные соединения, у которых был усечен только один конец, должны быть функциональными. Такие промежуточные соединения широко описаны в семействах белков, таких как ДНК-метилтрансферазы.[15]
Сапозин и свапозин

Примером перестановки путем дупликации является связь между сапозином и свапозином. Сапозины очень консервативны гликопротеины, длиной примерно 80 аминокислотных остатков и образующих четыре альфа спиральный структура. У них почти одинаковое расположение остатков цистеина и сайтов гликозилирования. В кДНК последовательность, которая кодирует сапозин, называется просапозин. Он является предшественником четырех продуктов расщепления, сапозинов A, B, C и D. Четыре домена сапозина, скорее всего, возникли в результате двух тандемных дупликаций предкового гена.[16] Это повторение предполагает механизм эволюции отношений с вставка для конкретного завода (PSI). PSI - это домен, встречающийся исключительно в растениях, состоящий приблизительно из 100 остатков и обнаруженный в растениях. аспарагиновые протеазы.[17] Он принадлежит к семейству сапозиноподобных белков (SAPLIP) и имеет «поменять местами» N- и C-концы, так что порядок спиралей составляет 3-4-1-2 по сравнению с сапозином, что привело к названию «свапозин». ".[7][18]
Деление и синтез

Другой моделью эволюции круговых перестановок является модель деления и слияния. Процесс начинается с двух неполных белков. Они могут представлять два независимых полипептида (например, две части гетеродимер ), или, возможно, изначально были половинками одного белка, который подвергся делению и превратился в два полипептида.
Эти два белка могут позже слиться вместе с образованием единого полипептида. Независимо от того, какой белок идет первым, этот гибридный белок может выполнять аналогичную функцию. Таким образом, если слияние двух белков происходит дважды в эволюции (либо между паралоги внутри одного вида или между ортологи у разных видов), но в другом порядке, полученные гибридные белки будут связаны посредством круговой перестановки.
Доказательства того, что конкретный белок эволюционировал по механизму деления и слияния, могут быть получены путем наблюдения половин перестановки как независимых полипептидов у родственных видов или путем экспериментальной демонстрации того, что две половины могут функционировать как отдельные полипептиды.[19]
Трансгидрогеназы

Пример механизма деления и синтеза можно найти в никотинамиднуклеотидтрансгидрогеназы.[20] Это мембрана -граница ферменты которые катализируют перенос иона гидрида между НАД (H) и НАДФ (H) в реакции, которая связана с трансмембранная транслокация протонов. Они состоят из трех основных функциональных единиц (I, II и III), которые можно найти в разном расположении в бактерии, простейшие, и выше эукариоты. Филогенетический анализ предполагает, что три группы доменов были приобретены и слиты независимо.[12]
Другие процессы, которые могут привести к циклическим перестановкам
Посттрансляционная модификация
Две упомянутые выше эволюционные модели описывают способы циркулярной перестановки генов, приводящей к циклической перестановке. мРНК после транскрипция. Белки также можно циклически переставлять с помощью посттрансляционная модификация, без перестановки основного гена. Круговые перестановки могут происходить спонтанно через автокатализ, как и в случае конканавалин А.[4] В качестве альтернативы перестановка может потребовать рестрикционные ферменты и лигазы.[5]
Роль в белковой инженерии
Концы многих белков расположены близко друг к другу в трехмерном пространстве.[21][22] Благодаря этому часто можно разработать циклические перестановки белков. Сегодня круговые перестановки обычно создаются в лаборатории с использованием стандартных генетических методов.[6] Хотя некоторые сайты перестановки не позволяют белку складывание правильно, многие пермутанты были созданы с почти идентичной структурой и функцией исходного белка.
Мотивация создания кольцевого перестановщика белка может быть разной. Ученые могут захотеть улучшить некоторые свойства белка, такие как:
- Уменьшать протеолитический восприимчивость. Скорость расщепления белков может иметь большое влияние на их активность в клетках. Поскольку терминалы часто доступны для протеазы, создание циркулярно пермутированного белка с менее доступными концами может увеличить продолжительность жизни этого белка в клетке.[23]
- Улучшать каталитическая активность. Циркулярная перестановка белка иногда может увеличить скорость, с которой он катализирует химическую реакцию, что приводит к более эффективным белкам.[24]
- Заменить подложку или связывание лиганда. Круговая перестановка белка может привести к потере связывание субстрата, но иногда может приводить к новой активности связывания лиганда или изменению субстратной специфичности.[25]
- Улучшать термостойкость. Активизация белков в более широком диапазоне температур и условий может повысить их полезность.[26]
С другой стороны, ученых могут заинтересовать свойства исходного белка, такие как:
- Порядок складывания. Определить порядок, в котором различные части белковой складки сложно, из-за чрезвычайно коротких временных масштабов. Версии белков с круговой перестановкой часто складываются в другом порядке, предоставляя информацию о складывании исходного белка.[27][28][29]
- Основные конструктивные элементы. Искусственные белки с циркулярной перестановкой могут позволить выборочно удалять части белка. Это дает представление о том, какие структурные элементы являются важными или нет.[30]
- Изменить четвертичная структура. Было показано, что белки с циркулярной перестановкой имеют другую четвертичную структуру, чем белки дикого типа.[31]
- Найдите сайты встраивания для других белков. Может оказаться полезным вставка одного белка в качестве домена в другой белок. Например, вставив кальмодулин в зеленый флуоресцентный белок (GFP) позволил исследователям измерить активность кальмодулина через флуоресценция сплит-GFP.[32] Области GFP, которые допускают введение круговой перестановки, с большей вероятностью примут добавление другого белка, сохраняя функцию обоих белков.
- Дизайн романа биокатализаторы и биосенсоры. Введение круговых перестановок можно использовать для создания белков, катализирующих определенные химические реакции,[24][33] или для обнаружения присутствия определенных молекул с помощью белков. Например, слияние GFP-кальмодулина, описанное выше, можно использовать для определения уровня ионов кальция в образце.[32]
Алгоритмическое обнаружение
Много выравнивание последовательностей и алгоритмы выравнивания структуры белков были разработаны с учетом линейных представлений данных и, как таковые, не способны обнаруживать круговые перестановки между белками.[34] Два примера часто используемых методов, при которых возникают проблемы с правильным выравниванием белков, связанных с помощью круговой перестановки: динамическое программирование и много скрытые марковские модели.[34] В качестве альтернативы им существует ряд алгоритмов, построенных на основе нелинейных подходов и способных обнаруживать топология -независимые сходства или использовать модификации, позволяющие им обойти ограничения динамического программирования.[34][35] В таблице ниже собраны такие методы.
Алгоритмы классифицируются по типу требуемых входных данных. ПоследовательностьАлгоритмам на основе требуется только последовательность двух белков для создания выравнивания.[36] Методы секвенирования обычно бывают быстрыми и подходят для поиска пар белков с циклической перестановкой в целых геномах.[36] Структура-основанные методы требуют рассмотрения трехмерных структур обоих белков.[37] Они часто медленнее, чем методы, основанные на последовательностях, но способны обнаруживать кольцевые перестановки между удаленно родственными белками с низким сходством последовательностей.[37] Некоторые структурные методы независимая от топологии, что означает, что они также могут обнаруживать более сложные перестановки, чем круговые перестановки.[38]
| ИМЯ | Тип | Описание | Автор | Год | Доступность | Ссылка |
|---|---|---|---|---|---|---|
| FBPLOT | Последовательность | Ничьи точечные графики субоптимальных выравниваний последовательностей | Цукер | 1991 | [39] | |
| Бачар и другие. | Независимая от структуры, топологии | Использует геометрическое хеширование для независимого от топологии сравнения белков | Bachar et al. | 1993 | [35] | |
| Uliel at al | Последовательность | Первое предложение о том, как может работать алгоритм сравнения последовательностей для обнаружения круговых перестановок | Uliel et al. | 1999 | [36] | |
| ШЕБА | Структура | Использует алгоритм SHEBA для создания структурных выравниваний для различных точек перестановки с итеративным улучшением точки разреза. | Юнг и Ли | 2001 | [14] | |
| Мультипрот | Независимая от структуры и топологии | Вычисляет независимое от порядка последовательностей выравнивание множественных структур белка | Шацкий | 2004 | сервер, скачать | [38] |
| РАСПОДОМ | Последовательность | Изменено Алгоритм сравнения последовательностей Нидлмана и Вунша | Weiner et al. | 2005 | скачать | [34] |
| CPSARST | Структура | Описывает белковые структуры как одномерные текстовые строки с помощью Рамачандран алгоритм последовательного преобразования (RST). Обнаруживает циклические перестановки за счет дублирования представления последовательности и стратегии «двойной фильтрации и уточнения». | Ло, Лю | 2008 | сервер | [40] |
| GANGSTA + | Структура | Работает в два этапа: Первый этап определяет грубые выравнивания на основе вторичных структурных элементов. Вторая стадия уточняет выравнивание на уровне остатков и распространяется на области петель. | Schmidt-Goenner et al. | 2009 | сервер, скачать | [41] |
| SANA | Структура | Обнаружение исходных выровненных пар фрагментов (AFP). Постройте сеть возможных AFP. Используйте алгоритм случайного совпадения для соединения компонентов в граф. | Wang et al. | 2010 | скачать | [42] |
| CE-CP | Структура | Построен на вершине комбинаторное расширение алгоритм. Дублирует атомы перед выравниванием, обрезает результаты после выравнивания | Bliven et al. | 2015 | сервер, скачать | [43] |
| TopMatch | Структура | Имеет возможность вычислять независимое от топологии выравнивание структуры белка | Зиппл и Видерштейн | 2012 | сервер, скачать | [44] |
Рекомендации
![]() Эта статья была адаптирована из следующего источника под CC BY 4.0 лицензия (2012 ) (отчеты рецензента ): «Круговая перестановка в белках», PLOS вычислительная биология, 8 (3): e1002445, 2012 г., Дои:10.1371 / JOURNAL.PCBI.1002445, ISSN 1553-734X, ЧВК 3320104, PMID 22496628, Викиданные Q5121672
Эта статья была адаптирована из следующего источника под CC BY 4.0 лицензия (2012 ) (отчеты рецензента ): «Круговая перестановка в белках», PLOS вычислительная биология, 8 (3): e1002445, 2012 г., Дои:10.1371 / JOURNAL.PCBI.1002445, ISSN 1553-734X, ЧВК 3320104, PMID 22496628, Викиданные Q5121672
- ^ а б c Каннингем Б.А., Хемперли Дж.Дж., Хопп Т.П., Эдельман Г.М. (июль 1979 г.). «Фавин против конканавалина А: аминокислотные последовательности с циклической перестановкой». Труды Национальной академии наук Соединенных Штатов Америки. 76 (7): 3218–22. Bibcode:1979PNAS ... 76.3218C. Дои:10.1073 / pnas.76.7.3218. ЧВК 383795. PMID 16592676.
- ^ Эйнспар Х., Паркс Е. Х., Сугуна К., Субраманиан Е., Суддат Флорида (декабрь 1986 г.). «Кристаллическая структура лектина гороха при разрешении 3,0-А». Журнал биологической химии. 261 (35): 16518–27. PMID 3782132.
- ^ Carrington DM, Auffret A, Hanke DE (1985). «Лигирование полипептида происходит во время посттрансляционной модификации конканавалина А». Природа. 313 (5997): 64–7. Bibcode:1985Натура 313 ... 64С. Дои:10.1038 / 313064a0. PMID 3965973. S2CID 4359482.
- ^ а б DJ Bowles, DJ Pappin (февраль 1988 г.). «Транспортировка и сборка конканавалина А». Тенденции в биохимических науках. 13 (2): 60–4. Дои:10.1016/0968-0004(88)90030-8. PMID 3070848.
- ^ а б Гольденберг Д.П., Крейтон Т.Е. (апрель 1983 г.). «Круговые и циркулярно переставленные формы ингибитора трипсина бычьей поджелудочной железы». Журнал молекулярной биологии. 165 (2): 407–13. Дои:10.1016 / S0022-2836 (83) 80265-4. PMID 6188846.
- ^ а б c Люгер К., Хоммель Ю., Герольд М., Хофстинг Дж., Киршнер К. (январь 1989 г.). «Правильная укладка циркулярно переставленных вариантов бета-альфа-бочкообразного фермента in vivo». Наука. 243 (4888): 206–10. Bibcode:1989Sci ... 243..206L. Дои:10.1126 / science.2643160. PMID 2643160.
- ^ а б c d Ponting CP, Russell RB (май 1995 г.). «Свапозины: круговые перестановки в генах, кодирующих гомологи сапозина». Тенденции в биохимических науках. 20 (5): 179–80. Дои:10.1016 / S0968-0004 (00) 89003-9. PMID 7610480.
- ^ Ло В, Ли К, Ли К, Лю П. «База данных круговых перестановок». Институт биоинформатики и структурной биологии, Национальный университет Цин Хуа. Получено 16 февраля 2012.
- ^ Ло В.К., Ли С.К., Ли С.Й., Лю ПК (январь 2009 г.). «CPDB: база данных циклических перестановок в белках». Исследования нуклеиновых кислот. 37 (Выпуск базы данных): D328–32. Дои:10.1093 / nar / gkn679. ЧВК 2686539. PMID 18842637.
- ^ Каас Q, Craik DJ (2010). «Анализ и классификация кольцевых белков в CyBase». Биополимеры. 94 (5): 584–91. Дои:10.1002 / bip.21424. PMID 20564021.
- ^ Андреева А., Прлич А., Хаббард Т.Дж., Мурзин А.Г. (январь 2007 г.). «СИЗИФ - структурные выравнивания белков с нетривиальными отношениями». Исследования нуклеиновых кислот. 35 (Выпуск базы данных): D253–9. Дои:10.1093 / нар / gkl746. ЧВК 1635320. PMID 17068077.
- ^ а б Вайнер Дж., Борнберг-Бауэр Э. (апрель 2006 г.). «Эволюция круговых перестановок в многодоменных белках». Молекулярная биология и эволюция. 23 (4): 734–43. Дои:10.1093 / molbev / msj091. PMID 16431849.
- ^ Буйницкий JM (март 2002 г.). «Последовательность перестановок в молекулярной эволюции ДНК-метилтрансфераз». BMC Эволюционная биология. 2 (1): 3. Дои:10.1186/1471-2148-2-3. ЧВК 102321. PMID 11914127.
- ^ а б Юнг Дж, Ли Би (сентябрь 2001 г.). «Белки с круговой перестановкой в базе данных структуры белков». Белковая наука. 10 (9): 1881–6. Дои:10.1110 / л.с. 05801. ЧВК 2253204. PMID 11514678.
- ^ Елч А (июль 1999 г.). «Круговые перестановки в молекулярной эволюции ДНК-метилтрансфераз». Журнал молекулярной эволюции. 49 (1): 161–4. Bibcode:1999JMolE..49..161J. Дои:10.1007 / pl00006529. PMID 10368444. S2CID 24116226.
- ^ Хазкани-Ково Э., Альтман Н., Горовиц М., Граур Д. (январь 2002 г.). «Эволюционная история просапозина: два последовательных события тандемной дупликации дали начало четырем доменам сапозина у позвоночных». Журнал молекулярной эволюции. 54 (1): 30–4. Bibcode:2002JMolE..54 ... 30H. Дои:10.1007 / s00239-001-0014-0. PMID 11734895. S2CID 7402721.
- ^ Гурупрасад К., Тёрмакангас К., Кервинен Дж., Бланделл Т.Л. (сентябрь 1994 г.). «Сравнительное моделирование аспарагиновой протеиназы ячменя: структурное обоснование наблюдаемой гидролитической специфичности». Письма FEBS. 352 (2): 131–6. Дои:10.1016 / 0014-5793 (94) 00935-X. PMID 7925961. S2CID 32524531.
- ^ Брун Х (июль 2005 г.). «Краткая экскурсия по функциональным и структурным особенностям сапозиноподобных белков». Биохимический журнал. 389 (Pt 2): 249–57. Дои:10.1042 / BJ20050051. ЧВК 1175101. PMID 15992358.
- ^ Ли Дж., Блабер М. (январь 2011 г.). «Экспериментальная поддержка эволюции симметричной белковой архитектуры из простого пептидного мотива». Труды Национальной академии наук Соединенных Штатов Америки. 108 (1): 126–30. Bibcode:2011ПНАС..108..126Л. Дои:10.1073 / pnas.1015032108. ЧВК 3017207. PMID 21173271.
- ^ а б Hatefi Y, Yamaguchi M (март 1996). «Никотинамиднуклеотид трансгидрогеназа: модель использования энергии связывания субстрата для транслокации протонов». Журнал FASEB. 10 (4): 444–52. Дои:10.1096 / fasebj.10.4.8647343. PMID 8647343. S2CID 21898930.
- ^ Торнтон Дж. М., Сибанда Б. Л. (июнь 1983 г.). «Амино- и карбоксиконцевые области глобулярных белков». Журнал молекулярной биологии. 167 (2): 443–60. Дои:10.1016 / S0022-2836 (83) 80344-1. PMID 6864804.
- ^ Ю Й, Лутц С (январь 2011 г.). «Круговая перестановка: другой способ создания структуры и функции ферментов». Тенденции в биотехнологии. 29 (1): 18–25. Дои:10.1016 / j.tibtech.2010.10.004. PMID 21087800.
- ^ Уайтхед Т.А., Бержерон Л.М., Кларк Д.С. (октябрь 2009 г.). «Связывание кончиков: круговая перестановка снижает протеолитическую восприимчивость рекомбинантных белков». Белковая инженерия, дизайн и выбор. 22 (10): 607–13. Дои:10.1093 / белок / gzp034. PMID 19622546.
- ^ а б Чельцов А.В., Барбер М.Дж., Феррейра Г.К. (июнь 2001 г.). «Круговая перестановка 5-аминолевулинатсинтазы. Сопоставление полипептидной цепи с ее функцией». Журнал биологической химии. 276 (22): 19141–9. Дои:10.1074 / jbc.M100329200. ЧВК 4547487. PMID 11279050.
- ^ Цянь З., Лутц С. (октябрь 2005 г.). «Улучшение каталитической активности липазы B Candida antarctica путем круговой перестановки». Журнал Американского химического общества. 127 (39): 13466–7. Дои:10.1021 / ja053932h. PMID 16190688. (основной источник)
- ^ Топелл С., Хеннеке Дж., Глокшубер Р. (август 1999 г.). «Варианты зеленого флуоресцентного белка с круговой перестановкой». Письма FEBS. 457 (2): 283–9. Дои:10.1016 / S0014-5793 (99) 01044-3. PMID 10471794. S2CID 43085373. (основной источник)
- ^ Вигера А.Р., Серрано Л., Вильманнс М. (октябрь 1996 г.). «Различные переходные состояния сворачивания могут привести к одной и той же нативной структуре». Структурная биология природы. 3 (10): 874–80. Дои:10.1038 / nsb1096-874. PMID 8836105. S2CID 11542397. (основной источник)
- ^ Capraro DT, Roy M, Onuchic JN, Jennings PA (сентябрь 2008 г.). "Обратный путь к складыванию пейзажа бета-трилистника белка интерлейкина-1бета?". Труды Национальной академии наук Соединенных Штатов Америки. 105 (39): 14844–8. Bibcode:2008PNAS..10514844C. Дои:10.1073 / pnas.0807812105. ЧВК 2567455. PMID 18806223.
- ^ Zhang P, Schachman HK (июль 1996 г.). «Образование in vivo аллостерической аспартаттранскарбамоилазы, содержащей каталитические полипептидные цепи с круговой перестановкой: последствия для укладки и сборки белка». Белковая наука. 5 (7): 1290–300. Дои:10.1002 / pro.5560050708. ЧВК 2143468. PMID 8819162. (основной источник)
- ^ Хуанг Ю.М., Наяк С., Быстрофф К. (ноябрь 2011 г.). «Количественная растворимость in vivo и восстановление усеченных кольцевых пермутантов зеленого флуоресцентного белка». Белковая наука. 20 (11): 1775–80. Дои:10.1002 / pro.735. ЧВК 3267941. PMID 21910151. (основной источник)
- ^ Бирнинк П.Т., Ян Ю.Р., Граф Р., Король Д.С., Шах С.С., Шачман, Гонконг (март 2001 г.). «Случайная круговая перестановка, приводящая к разрыву цепи внутри и около альфа-спиралей в каталитических цепях аспартат-транскарбамоилазы: влияние на сборку, стабильность и функцию». Белковая наука. 10 (3): 528–37. Дои:10.1110 / л.с. 39001. ЧВК 2374132. PMID 11344321.
- ^ а б Бэрд Г.С., Захариас Д.А., Цзянь Р.Ю. (сентябрь 1999 г.). «Круговая перестановка и вставка рецептора в зеленые флуоресцентные белки». Труды Национальной академии наук Соединенных Штатов Америки. 96 (20): 11241–6. Bibcode:1999PNAS ... 9611241B. Дои:10.1073 / пнас.96.20.11241. ЧВК 18018. PMID 10500161.
- ^ Тернер Нью-Джерси (август 2009 г.). «Направленная эволюция движет новым поколением биокатализаторов». Природа Химическая Биология. 5 (8): 567–73. Дои:10.1038 / nchembio.203. PMID 19620998.
- ^ а б c d Вайнер Дж., Томас Г., Борнберг-Бауэр Э. (апрель 2005 г.). «Быстрое предсказание циклических перестановок в многодоменных белках на основе мотивов». Биоинформатика. 21 (7): 932–7. Дои:10.1093 / биоинформатика / bti085. PMID 15788783.
- ^ а б Бачар О., Фишер Д., Нусинов Р., Вольфсон Х. (апрель 1993 г.). «Метод компьютерного зрения для трехмерного независимого от последовательности структурного сравнения белков». Белковая инженерия. 6 (3): 279–88. Дои:10.1093 / белок / 6.3.279. PMID 8506262.
- ^ а б c Улиэль С., Флисс А., Амир А., Унгер Р. (ноябрь 1999 г.). «Простой алгоритм обнаружения круговых перестановок в белках». Биоинформатика. 15 (11): 930–6. Дои:10.1093 / биоинформатика / 15.11.930. PMID 10743559.
- ^ а б Prlic A, Bliven S, Rose PW, Bluhm WF, Bizon C, Godzik A, Bourne PE (декабрь 2010 г.). «Предварительно рассчитанные выравнивания структуры белков на сайте RCSB PDB». Биоинформатика. 26 (23): 2983–5. Дои:10.1093 / биоинформатика / btq572. ЧВК 3003546. PMID 20937596.
- ^ а б Шацкий М., Нусинов Р., Вольфсон Х. Дж. (Июль 2004 г.). «Метод одновременного выравнивания нескольких белковых структур». Белки. 56 (1): 143–56. Дои:10.1002 / prot.10628. PMID 15162494. S2CID 14665486.
- ^ Цукер М. (сентябрь 1991 г.). «Выравнивание субоптимальных последовательностей в молекулярной биологии. Выравнивание с анализом ошибок». Журнал молекулярной биологии. 221 (2): 403–20. Дои:10.1016 / 0022-2836 (91) 80062-У. PMID 1920426.
- ^ Lo WC, Lyu PC (январь 2008 г.). «CPSARST: эффективный инструмент кругового поиска перестановок, применяемый для обнаружения новых структурных взаимосвязей белков». Геномная биология. 9 (1): R11. Дои:10.1186 / gb-2008-9-1-r11. ЧВК 2395249. PMID 18201387.
- ^ Шмидт-Геннер Т., Герлер А., Кольбек Б., Кнапп Э. У. (май 2010 г.). «Белки с круговой перестановкой во вселенной белковых складок». Белки. 78 (7): 1618–30. Дои:10.1002 / prot.22678. PMID 20112421. S2CID 20673981.
- ^ Ван Л., Ву Л., Ван И, Чжан XS, Чен Л. (июль 2010 г.). «SANA: алгоритм последовательного и непоследовательного выравнивания структуры белка». Аминокислоты. 39 (2): 417–25. Дои:10.1007 / s00726-009-0457-y. PMID 20127263. S2CID 2292831.
- ^ Bliven SE, Bourne PE, Prlić A (апрель 2015 г.). «Обнаружение круговых перестановок в белковых структурах с помощью CE-CP». Биоинформатика. 31 (8): 1316–8. Дои:10.1093 / биоинформатика / btu823. ЧВК 4393524. PMID 25505094.
- ^ Сиппл MJ, Wiederstein M (апрель 2012 г.). «Обнаружение пространственных корреляций в белковых структурах и молекулярных комплексах». Структура. 20 (4): 718–28. Дои:10.1016 / j.str.2012.01.024. ЧВК 3320710. PMID 22483118.
дальнейшее чтение
- Дэвид Гудселл (апрель 2010 г.) Конканавалин А и круговая перестановка Банк данных белков (PDB) Молекула месяца
