Карборановая кислота - Carborane acid
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol ) | |
| |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
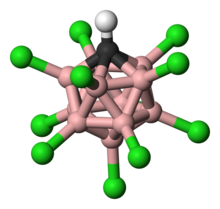
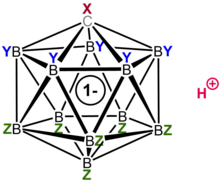
Карборановые кислоты H (CXB
11Y
5Z
6) (X, Y, Z = H, Alk, F, Cl, Br, CF3) являются классом суперкислоты,[1] некоторые из них оцениваются как минимум в миллион раз сильнее чем 100% чистый серная кислота с точки зрения их Hammett функция кислотности значения (ЧАС0 ≤ –18) и обладают вычисленным pKа значения значительно ниже –20, что делает их одними из самых сильных известных кислот Бренстеда.[2][3][4] Наиболее хорошо изученным примером является сильно хлорированное производное H (CHB
11Cl
11). Кислотность H (CHB
11Cl
11) было обнаружено, что значительно превосходит трифликовая кислота, CF
3ТАК
3ЧАС, и бистрифлимид, (CF
3ТАК
2)
2NH, соединения, ранее считавшиеся сильнейшими из выделяемых кислот.
Их высокая кислотность связана с обширной делокализацией их сопряженных оснований, карборанат-анионов (CXB11Y5Z6–), которые обычно дополнительно стабилизируются электроотрицательный такие группы, как Cl, F и CF3. Из-за отсутствия окислительных свойств и исключительно низкой нуклеофильности и высокой стабильности их конъюгированных оснований они являются единственными суперкислотами, известными как протонировать C60 фуллерен не разлагая его.[5][6] Кроме того, они образуют стабильные выделяемые соли с протонированный бензол, С6ЧАС7+, исходное соединение промежуточных продуктов Wheland, встречающихся в электрофильное ароматическое замещение реакции.
Фторированная карборановая кислота, H (CHB
11F
11), даже сильнее, чем хлорированная карборановая кислота. Он способен протонировать бутан с образованием терт-бутил-катион при комнатной температуре и является единственной известной кислотой, которая протонирует диоксид углерода с образованием мостикового катиона, [H (CO
2)
2]+
, что делает его, возможно, самой сильной из известных кислот. В частности, CO2 не подвергается заметному протонированию при обработке смешанными суперкислоты HF-SbF5 или HSO3F-SbF5.[7][8][9][10]
Как класс, карборановые кислоты образуют наиболее кислотную группу четко определенных выделяемых веществ, известных, гораздо более кислых, чем ранее известные однокомпонентные сильные кислоты, такие как трифликовая кислота или же хлорная кислота. В некоторых случаях, как и у почти пергалогенированных производных, упомянутых выше, их кислотность конкурирует (и, возможно, превышает) кислотность традиционных смешанных суперкислот Льюиса-Бренстеда, таких как волшебная кислота и фторантимоновая кислота. (Однако прямое сравнение до сих пор было невозможно из-за отсутствия меры кислотности, которая подходила бы для обоих классов кислот: pKа значения для химически сложных смешанных кислот не определены, в то время как ЧАС0 значения не могут быть измерены для карбоновых кислот с очень высокой температурой плавления).
Кислотность

11Cl
11) было показано, что он является мономерным в газовой фазе с кислым протоном (показано на красный) связанный с Cl (12) и вторично связанный с Cl (7). Мономерная форма является метастабильной при конденсации, но в конечном итоге полимеризуется с образованием структуры с кислотным протонным мостиком между карборановыми звеньями.[11] (N.B.: Линии между атомами углерода и бора карборанового ядра показывают связность, но не должны интерпретироваться как одинарные связи. Ордера на облигации меньше единицы из-за недостатка электронов.)
Сила кислоты Бренстеда-Лоури соответствует ее способности выделять ионы водорода. Одной из распространенных мер силы кислоты для концентрированных суперкислотных жидких сред является функция кислотности Гаммета, ЧАС0. Основываясь на своей способности количественно протонировать бензол, хлорированная карборановая кислота H (CHB
11Cl
11) по консервативным оценкам ЧАС0 значение -18 или ниже, что приводит к распространенному утверждению, что карбановые кислоты по крайней мере в миллион раз сильнее, чем 100% -ная серная кислота (ЧАС0 = −12).[12][13] Однако поскольку ЧАС0 значение измеряет протонирующую способность жидкость среды, кристаллическая и тугоплавкая природа этих кислот не позволяет напрямую измерить этот параметр. С точки зрения пKа, немного другая мера кислотности, определяемая как способность данного растворенного вещества подвергаться ионизации в растворителе, карборановые кислоты, по оценкам, имеют pKа значения ниже -20, даже без электроноакцепторных заместителей на атомах бора (например, H (CHB
11ЧАС
11) оценивается как pKа от −24),[14] с (пока неизвестным) полностью фторированным аналогом H (CHB
11F
11) имея расчетный pKа -46.[4] Известная кислота H (CHB
11F
11) с одним фтором меньше, как ожидается, будет лишь немного слабее (pKа < −40).
В газовой фазе H (CHB
11F
11) имеет вычисленный кислотность 216 ккал / моль, по сравнению с экспериментально определенной кислотностью 241 ккал / моль (в разумном соответствии с расчетным значением 230 ккал / моль) для H (CHB
11Cl
11). Напротив, HSbF6 (упрощенная модель для донорных частиц в фторантимоновая кислота ) имеет расчетную кислотность газовой фазы 255 ккал / моль, в то время как предыдущий экспериментально определенный рекордсмен был (C4F9ТАК2)2NH, родственник бистрифлимид, при 291 ккал / моль. Таким образом, H (CHB
11F
11) является, вероятно, наиболее кислотным веществом, синтезированным до сих пор в массе, с точки зрения его кислотности в газовой фазе. Ввиду его уникальной реакционной способности, он также является сильным претендентом на звание самого кислого вещества в конденсированной фазе (см. Выше). Были предсказаны некоторые еще более сильнокислые производные с кислотностью газовой фазы <200 ккал / моль.[15][16]
Карборановые кислоты отличаются от классических суперкислот тем, что представляют собой четко определенные однокомпонентные вещества. Напротив, классические суперкислоты часто представляют собой смеси кислоты Бренстеда и кислоты Льюиса (например, HF / SbF5).[17] Несмотря на то, что борные карборановые кислоты являются самой сильной кислотой, они описываются как «мягкие», чисто протонирующие слабоосновные вещества без дальнейших побочных реакций.[18] В то время как обычные суперкислоты разлагают фуллерены из-за их сильно окисляющего кислотного компонента Льюиса, карборановая кислота обладает способностью протонировать фуллерены при комнатной температуре с образованием выделяемой соли.[19][20] Кроме того, анион, который образуется в результате переноса протона, почти полностью инертен. Это свойство делает карборановые кислоты единственными веществами, сравнимыми по кислотности со смешанными суперкислотами, которые также можно хранить в стеклянной бутылке, поскольку различные фторид-донорные вещества (которые атакуют стекло) не присутствуют или не образуются.[21][19]
История
Карборановая кислота была впервые открыта и синтезирована профессором Кристофером Ридом и его коллегами в 2004 году в Калифорнийском университете в Риверсайде.[20] До открытия карборановой кислоты давний рекорд «самых сильных кислот как отдельных выделяемых соединений» держали две суперкислоты, фторсульфоновая кислота и трифторметансульфоновая кислота, с pKаs = -14 и -16 соответственно.[22] Исходная молекула, из которой происходит карборановая кислота, икосаэдрический карборанат-анион, HCB
11ЧАС−
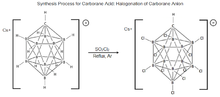
11, был впервые синтезирован в DuPont в 1967 году Уолтером Нотом. Исследования свойств этой молекулы были приостановлены до середины 1980-х годов, когда чешская группа ученых-борников Плешек, Штибр и Гержманек усовершенствовали процесс галогенирования молекул карборана. Эти открытия сыграли важную роль в разработке текущей процедуры синтеза карборановой кислоты.[19][22] Процесс состоит из обработки Cs+[HCB11ЧАС11]– с ТАК
2Cl
2кипячение с обратным холодильником в сухом аргоне для полного хлорирования молекулы с образованием карборановой кислоты, но было показано, что это полностью хлорируется только при определенных условиях.[23][19][24]
В 2010 году Рид опубликовал руководство, в котором подробно описаны процедуры синтеза карборановых кислот и их производных.[25] Тем не менее, синтез карборановых кислот остается длительным и трудным и требует хорошо обслуживаемого перчаточного бокса и специального оборудования. Исходный материал коммерчески доступен. декаборана (14), высокотоксичное вещество. Самая хорошо изученная карборановая кислота H (CHB
11Cl
11) готовится в 13 шагов. Последние несколько шагов особенно чувствительны и требуют наличия перчаточного ящика при <1 ppm H.2O без паров слабощелочного растворителя, поскольку такие слабые основания, как бензол или дихлорметан, будут реагировать с электрофилами на основе карборана и кислотами Бренстеда. Заключительным этапом синтеза является метатезис карборанатной соли μ-гидридодисилилия с избыточной жидкостью, безводным хлористым водородом, предположительно за счет образования прочных связей Si – Cl и H – H в летучих побочных продуктах:
- [Et3Si – H – SiEt3]+[HCB11Cl11]– + 2HCl →H (CHB
11Cl
11) + 2Et3SiCl + H2
- [Et3Si – H – SiEt3]+[HCB11Cl11]– + 2HCl →H (CHB
Продукт выделяли выпариванием побочных продуктов и характеризовали его инфракрасным (νCH = 3023 см−1) и ядерного магнитного резонанса (δ 4,55 (с, 1H, CH), 20,4 (с, 1H, H+) в жидкой SO2) спектры (обратите внимание на чрезвычайно слабопольный химический сдвиг кислотного протона).[25] Хотя реакции, используемые в синтезе, аналогичны, получение чистого образца более кислого H (CHB
11F
11) Оказалось, что это еще сложнее, требуя чрезвычайно строгих процедур для исключения следов слабоосновных примесей.[7]
Структура
Карборановая кислота состоит из 11 атомов бора; каждый атом бора связан с атомом хлора. Атомы хлора служат для повышения кислотности и действуют как щит от атак извне из-за стерических препятствий, которые они создают вокруг кластера. Кластер, состоящий из 11 боров, 11 хлора и одного атома углерода, спарен с атомом водорода, связанным с атомом углерода. Атомам бора и углерода позволяют образовывать шесть связей из-за способности бора образовывать трехцентровые двухэлектронные связи.[22]
 Бор обладает способностью образовывать «связь трех центров и двух электронов». Здесь представлены резонансные структуры связи 3c-2e в диборане.
Бор обладает способностью образовывать «связь трех центров и двух электронов». Здесь представлены резонансные структуры связи 3c-2e в диборане.
Хотя структура карборановой кислоты сильно отличается от обычных кислот, обе распределяют заряд и стабильность одинаковым образом. Карборанат-анион распределяет свой заряд, делокализуя электроны по 12 атомам клетки.[26] Это было показано в исследовании дифракции рентгеновских лучей на монокристалле, показавшем укороченную длину связи в гетероциклической части кольца, что указывает на электронную делокализацию.[27]
Хлорированный карбаматблизко-додекаборат анион HCB
11Cl−
11 представляет собой исключительно стабильный анион с тем, что ранее было описано как «замещающе инертные» вершины B – Cl.
Дескриптор близко указывает на то, что молекула является формальным производным (от B до C+ замена) из борана стехиометрии и заряда [BпЧАСп]2– (п = 12 для известных карбоновых кислот).[28] Стыковидная структура, образованная 11 атомами бора и 1 атомом углерода, позволяет электронам сильно делокализоваться через трехмерную клетку (специальная стабилизация карборановой системы была названа «σ-ароматичностью») и высокой энергией, необходимой для разрушения Кластерная часть бора в молекуле - вот что придает аниону удивительную стабильность.[28] Поскольку анион чрезвычайно стабилен, он не будет вести себя как нуклеофил по отношению к протонированному субстрату, в то время как сама кислота полностью не окисляет, в отличие от кислотных компонентов Льюиса многих суперкислот, таких как пентафторид сурьмы. Следовательно, чувствительные молекулы, такие как C60 можно протонировать без разложения.[29][30]
использование
Существует множество предлагаемых применений карборановых кислот на основе бора. Например, они были предложены в качестве катализаторов крекинга углеводородов и изомеризации п-алканы с образованием разветвленных изоалканов (например, «изооктан»). Карборановые кислоты могут также использоваться в качестве сильных селективных кислот Бренстеда для тонкого химического синтеза, где низкая нуклеофильность противоаниона может быть преимуществом. В механистической органической химии они могут быть использованы при изучении реакционноспособных катионных интермедиатов.[31] В неорганическом синтезе их беспрецедентная кислотность может позволить изолировать экзотические виды, такие как соли протонированного ксенона.[21][22][32]
Рекомендации
- ^ Обратите внимание, что на изображении кислотный протон не связан с карбораном, но это противоион, который не отображается.
- ^ Olah, G. A .; Пракаш, Г. К. С .; Sommer, J .; Мольнар, А. (2009). Суперкислотная химия (2-е изд.). Вайли. п. 41. ISBN 978-0-471-59668-4.
- ^ То есть, если это жидкость, протонирующая способность чистого образца карборановой суперкислоты, измеренная с помощью Мероприятия из H+, будет в миллион раз выше, чем у 100% серная кислота.
- ^ а б Липпинг, Лаури; Лейто, Иво; Коппель, Ивар; Кроссинг, Инго; Химмель, Даниэль; Коппель, Ильмар А. (14 января 2015 г.). «Сверхкислотность кислот Бренстеда на основе клозо-додекабората: исследование DFT». Журнал физической химии A. 119 (4): 735–743. Дои:10.1021 / jp506485x. PMID 25513897.
- ^ Juhasz, M .; Hoffmann, S .; Стоянов, Е .; Kim, K.-C .; Рид, К. А. (2004). «Самая сильная выделяемая кислота». Angewandte Chemie International Edition. 43 (40): 5352–5355. Дои:10.1002 / anie.200460005. PMID 15468064.
- ^ Рид, К. А. (2005). «Карборановые кислоты. Новые« сильные, но мягкие »кислоты для органической и неорганической химии» (PDF). Химические коммуникации. 2005 (13): 1669–1677. Дои:10.1039 / b415425h. PMID 15791295.
- ^ а б Нава Мэтью (2013). «Самая сильная кислота Бренстеда: протонирование алканов H (CHB11F11) при комнатной температуре». Angewandte Chemie International Edition. 53 (4): 1131–1134. Дои:10.1002 / anie.201308586. ЧВК 4993161. PMID 24339386.
- ^ Рид CA (2013). «Мифы о протоне. Природа H + в конденсированных средах». Соотв. Chem. Res. 46 (11): 2567–75. Дои:10.1021 / ar400064q. ЧВК 3833890. PMID 23875729.
- ^ Рид CA (2013). «Мифы о протоне. Природа H + в конденсированных средах». Соотв. Chem. Res. 46 (11): 2567–75. Дои:10.1021 / ar400064q. ЧВК 3833890. PMID 23875729.
- ^ Каммингс, Стивен; Гратчян, Грант П .; Рид, Кристофер А. (22 января 2016 г.). «Самая сильная кислота: протонирование двуокиси углерода». Angewandte Chemie International Edition. 55 (4): 1382–1386. Дои:10.1002 / anie.201509425. ISSN 1521-3773. PMID 26663640.
- ^ Стоянов, Евгений С .; Hoffmann, Stephan P .; Юхас, Марк; Рид, Кристофер А. (март 2006 г.). «Структура сильнейшей кислоты Бренстеда: карборановая кислота H (CHB11Cl11)» (PDF). Журнал Американского химического общества. 128 (10): 3160–3161. Дои:10.1021 / ja058581l. ISSN 0002-7863. PMID 16522093.
- ^ Рид, К. А. (октябрь 2011 г.). «Самая сильная кислота». Chem. Новая Зеландия. 75: 174–179. Дои:10.1002 / подбородок.201210266. S2CID 6226748.
- ^ Olah, G. A .; Пракаш, Г. К. С .; Sommer, J .; Мольнар, А. (2009). Суперкислотная химия (2-е изд.). Вайли. п. 41. ISBN 978-0-471-59668-4.
- ^ РKа значения рассчитаны для 1,2-дихлорэтана в качестве растворителя, с pKа пикриновой кислоты, «привязанной» к 0 для удобства. Поскольку водный pKа пикриновой кислоты составляет 0,4, эти расчетные значения дают приблизительную оценку pKа карборанов в воде.
- ^ Мейер, Мэтью М .; Ван, Сюэ-Бинь; Рид, Кристофер А .; Ван, Лай-Шэн; Касс, Стивен Р. (23 декабря 2009 г.). «Исследование слабого для оценки сильного: экспериментальное определение энергии связи электронов карборановых анионов и газовой кислотности карборановых кислот». Журнал Американского химического общества. 131 (50): 18050–18051. Дои:10.1021 / ja908964h. ISSN 1520-5126. PMID 19950932.
- ^ Липпинг, Лаури; Лейто, Иво; Коппель, Ивар; Коппель, Ильмар А. (19 ноября 2009 г.). "Сверхкислотность по Бренстеду в газовой фазе некоторых производных монокарба-клозо-боратов: вычислительное исследование". Журнал физической химии A. 113 (46): 12972–12978. Дои:10.1021 / jp905449k. ISSN 1089-5639. PMID 19807147.
- ^ Рид, Кристофер. «Карборановые кислоты. Новые« сильные, но мягкие »кислоты для органической и иногронной химии». Предварительная статья (февраль 2005 г.). Проверено 13 февраля 2015 г.
- ^ Рид, Кристофер А. «Самая сильная кислота». Химия в Новой Зеландии (Октябрь 2011 г.): 174-179. Доступ 13 февраля 2015 г.
- ^ а б c d Juhasz M .; Hoffmann S .; Стоянов Э .; Ким К.-С .; Рид К. А. (2004). «Самая сильная выделяемая кислота». Angewandte Chemie International Edition. 43 (40): 5352–5355. Дои:10.1002 / anie.200460005. PMID 15468064.
- ^ а б Рид К. А. (2005). «Карборановые кислоты. Новые« сильные, но мягкие »кислоты для органической и неорганической химии». Химические коммуникации (Представлена рукопись). 2005 (13): 1669–1677. Дои:10.1039 / b415425h. PMID 15791295.
- ^ а б Хопкин, М. (2004, 1 ноября). Создана самая сильная кислота в мире. Получено 3 марта 2015 г. из http://www.nature.com/news/2004/041115/full/news041115-5.html
- ^ а б c d Сато Кентаро, «Самая сильная кислота в мире». Музей органической химии. Доступ 13 февраля 2015 г.
- ^ «Обратное дело». Химические коммуникации. 46 (48): 9259. 2010-12-28. Дои:10.1039 / C0CC90142C. ISSN 1364-548X.
- ^ Гу У., Маккалох, Билли Дж., Рейбенспис, Джозеф и Озеров, Олег В. (2010, 1 февраля). Химические коммуникации Получено 5 марта 2015 г. из http://pubs.rsc.org/en/content/articlepdf/2010/cc/c001555e
- ^ а б Рид, Кристофер А. (19 января 2010 г.). «Реагенты H +, CH3 + и R3Si + -карборан: когда трифлаты не работают». Отчеты о химических исследованиях. 43 (1): 121–128. Дои:10.1021 / ar900159e. ISSN 0001-4842. ЧВК 2808449. PMID 19736934.
- ^ Эль-Хеллани А .; Лавалло В. (2014). «Слияние N-гетероциклических карбенов с карборан-анионами». Энгью. Chem. Int. Эд. 53 (17): 4489–4493. Дои:10.1002 / anie.201402445. PMID 24664969.
- ^ Аллен Л. Чан; Хавьер Фахардо младший; Джеймс Х. Райт, II; Мэтью Эсэй; Винсент Лавалло (2013). «Наблюдение при комнатной температуре B – Cl активации аниона HCB11Cl11 и выделение стабильного анионного карборанилфосфазида». Неорганическая химия. 52 (21): 12308–12310. Дои:10.1021 / ic402436w. PMID 24138749.
- ^ а б Рид Кристофер А. (1998). «Карбораны: новый класс слабо координирующих анионов для сильных электрофилов, оксидантов и суперкислот». Отчеты о химических исследованиях. 31 (3): 133–139. Дои:10.1021 / ar970230r.
- ^ Рамирес-Контрерас Родриго (2012). «Удобное C-алкилирование аниона [HCB11Cl11] -карборана». Дальтон Транс. 41 (26): 7842–7844. Дои:10.1039 / C2DT12431A. PMID 22705934.
- ^ Кин, Сэм. Исчезающая ложка: и другие правдивые сказки о безумии, любви и истории мира из Периодической таблицы элементов. Нью-Йорк: Back Bay Books, 2011. Печать.
- ^ Ловкин Крис. «Сильный, но нежный, без кислоты». Калифорнийский университет, Риверсайд. (Ноябрь 2004 г.). Доступ 13 февраля 2015 г.
- ^ Стайлз, Д. (1 сентября 2007 г.). «Колонка: Скамья-обезьяна». Получено 3 марта, 2015.

