Ботридиал - Botrydial
 | |
| Имена | |
|---|---|
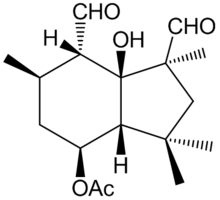
| Название ИЮПАК [(1S, 3aR, 4S, 6R, 7S, 7aS) -1,7-диформил-7a-гидрокси-1,3,3,6-тетраметил-2,3a, 4,5,6,7-гексагидроинден-4 -ил] ацетат | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C17ЧАС26О5 | |
| Молярная масса | 310,38534 г / моль |
| Плотность | 1,15 г / мл |
| Точка кипения | 397,4 ° С (747,3 ° F, 670,5 К) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Ботридиал это фитотоксичный сесквитерпен метаболит секретируется грибком Botrytis cinerea. Ботридиал был впервые выделен и описан в 1974 г.[1] Botrytis Cinerea является возбудителем болезни серой гнили и, как известно, поражает широкий спектр растений (более 200 видов), вызывая болезни пятнистости листьев и плесени на салате и помидорах, а также гниющие ягоды.[2] По этой причине ботридиал, а также другие метаболиты сесквитерпена, полученные из Botrytis Cinerea, представляют собой экономически важное заболевание для декоративных и сельскохозяйственных культур.[3] Из всех метаболитов, производимых этим грибком, Botrydial проявляет наивысшую фитотоксическую активность.[4]
Биосинтез
Botrydial происходит от BcBOT2 (BотритисcInerea BOTридиальный биосинтез), опосредованная циклизацией фарнезилдифосфата (FPP) до ключевого промежуточного трициклического спирта пресильфиперфолан-8β-ол. Пинедо и др. продемонстрировали, что BcBOT2 на самом деле является сесквитерпен-синтазой, путем инкубации FPP с рекомбинантным белком BcBOT2, что дало ожидаемый пресильфиперфолан-8-ол в качестве основного продукта. 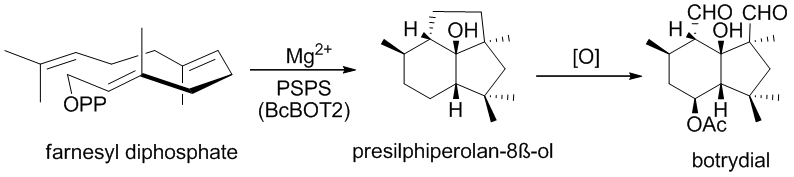
Затем в биосинтез ботридиала вовлечены еще 4 гена: 3 гена, которые кодируют монооксигеназу P450 (BcBOT3, BcBOT1, BcBOT4) и ген BcBOT5, аминокислотная последовательность которого показала высокую гомологию с известными ацетилтрансферазами.
Это привело к тому, что Пинедо и др. пришли к выводу, что BcBOT5, вероятно, ответственен за введение ацетильной группы в C-4. Они также пришли к выводу из количественного анализа с обратной транскрипцией-ПЦР (qRT-PCR), что пять последовательных генов совместно регулируются одним и тем же путем трансдукции BCG1-calcineurim.[5]
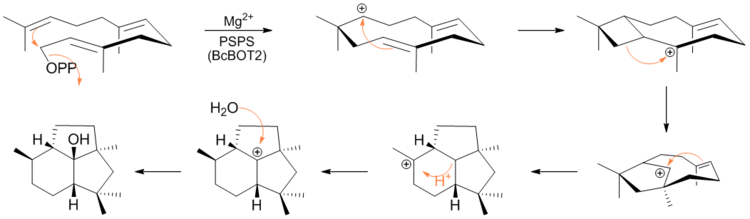
Механизм ферментативного образования пресильфиперфолан-8β-ола
Недавно в статье ASAP в Журнале Американского химического общества Кейн и др. экспериментально подтвержден с использованием мечения дейтерием и ЯМР-спектроскопии, механизм, с помощью которого FPP циклизуется в пресильфиперфолан-8β-ол. Механизм состоит из отщепления дифосфатной группы с последующими циклизацией и перегруппировками, опосредованными карбокатионом.[6]
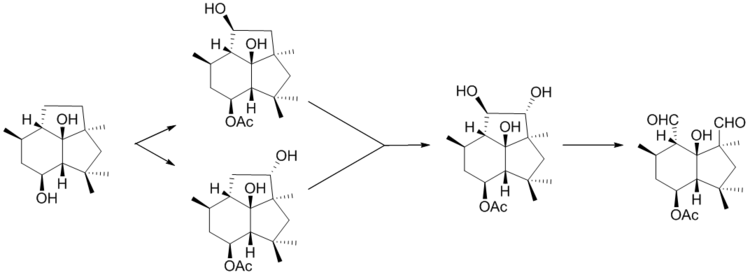
После образования пресильфиперфолан-8β-ола, BcBOT5 уступает место ацетилированию в положении C-4, затем происходит гидроксилирование проботрианового скелета в двухстадийном процессе с последующим окислительным расщеплением вновь образованного диола с образованием ботридиала.[7]
Механизм действия
Botrydial производится Botrytis Cinerea, когда растение-хозяин заражено. В результате ботридиал вызывает хлороз и коллапс клеток.[8] Кроме того, агрессивные штаммы гриба секреты поликетиды такие как ботциновая кислота, которые обладают фитотоксической и противогрибковой активностью.[5]
Примечания
- ^ Lindner, HJ; von Groose, B. Chem. Бер. 1974, 107, 3332-3336
- ^ Collado, I.G .; Hernandez-Galan, R .; Duran-Patron, R .; Канторал, Дж. М. Фитохимия. 1995, 38, 647-650
- ^ (а) Williamson, B .; Тудзинский, Б .; Тудзинский, П .; van Kan, J. A. Mol. Завод Патол. 2007, 8, 561–580. (b) Choquer, M .; Fournier, E .; Kunz, C .; Levis, C .; Pradier, J.M .; Саймон, А .; Viaud, M. FEMS Microbiol. Lett. 2007, 277, 1–10
- ^ Кольменарес, А. Дж .; Aleu, J., Duran-Patron, R .; Collado, I.G .; Hernandez-Galan, R.J. Chem. Ecol. 2002, 28, 997-1005
- ^ а б Pinedo, C .; Wang, C.M .; Pradier, J.M .; Dalmais, B .; Choquer, M .; Le Pecheur, P .; Morgant, G .; Collado, I.G .; Cane, D.E .; Viaud, M. ACS Chem. Биол. 2008, 3, 791-801.
- ^ Wang, C .; Hopson, R .; Lin, X .; Кейн, Д. Варенье. Chem. Soc. 2009, как можно скорее, Дои:10.1021 / ja9021649
- ^ Duran-Patron, R .; Кольменарес, A.J .; Hernandez-Galan, R .; Колладо, И. Тетраэдр. 2001, 57, 1929-1933 гг.
- ^ Deighton, N .; Muckenschnabel, I .; Colmenares, A.J., Collado, I.G .; Уильямсон, Б. Фитохимия, 2001, 57, 689-692.
