Биосовместимость - Biocompatibility - Wikipedia
Эта статья нужны дополнительные цитаты для проверка. (Декабрь 2011 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Биосовместимость связано с поведением биоматериалы в различных контекстах. Термин относится к способности материала работать с соответствующей реакцией хозяина в конкретной ситуации.[1] Неопределенность термина отражает постоянное развитие понимания того, как биоматериалы взаимодействуют с тело человека и, в конечном итоге, как эти взаимодействия определяют клинический успех медицинский прибор (Такие как кардиостимулятор, замена бедра или же стент ). Современные медицинские приборы и протезы часто изготавливаются из более чем одного материала, поэтому не всегда может быть достаточно говорить о биосовместимости конкретного материала.[2]
Поскольку иммунная реакция а функции восстановления в организме настолько сложны, что невозможно описать биосовместимость одного материала по отношению к одному типу клеток или ткани. Иногда можно услышать об испытаниях на биосовместимость, которые представляют собой большую батарею in vitro тест[3] который используется в соответствии с ISO 10993 (или другие аналогичные стандарты), чтобы определить, является ли определенный материал (или, скорее, биомедицинский продукт) биосовместимым. Эти тесты не определяют биосовместимость материала,[4] но они представляют собой важный шаг к тестирование животных и наконец клинические испытания который будет определять биосовместимость материала в данном применении, и, таким образом, медицинское оборудование Такие как имплантаты или же устройства доставки лекарств.[5]
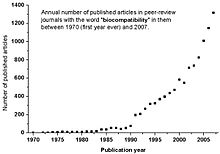
История
Слово биосовместимость кажется, впервые был упомянут в рецензируемых журналах и на встречах в 1970 году Р. Дж. Хегьели (выдержка из ежегодного собрания Amer Chem Soc) и К. А. Хомси.[7] Прошло почти два десятилетия, прежде чем он стал широко использоваться в научной литературе (см. График ниже).
Недавно Уильямс (снова) попытался переоценить текущий уровень знаний о том, какие факторы определяют клинический успех. При этом следует учитывать, что имплантат не всегда должен быть биологически активным, но он не должен причинять никакого вреда (локального или системного).[8]
Пять определений биосовместимости
- "Качество отсутствия токсичный или вредное воздействие на биологические системы ".[9]
- «Способность материала работать с соответствующим ответом хоста в конкретном приложении», определение Уильямса.[10]
- «Сравнение тканевого ответа, вызванного тесной связью имплантированного материала-кандидата с местом его имплантации внутри животного-хозяина, с тем тканевым ответом, признанным и установленным как подходящий с контрольными материалами» - ASTM
- "Относится к способности биоматериала выполнять свою желаемую функцию в отношении медицинской терапии, не вызывая каких-либо нежелательных местных или системных эффектов у реципиента или получателя этой терапии, но вызывая наиболее подходящий положительный клеточный или тканевый ответ в этом конкретном ситуации и оптимизации клинически значимых показателей этой терапии ".[8]
- «Биосовместимость - это способность имплантированного в тело протеза существовать в гармонии с тканями, не вызывая пагубных изменений».[11]
Комментарии к пяти приведенным выше определениям
- Определение Dorland Medical не рекомендуется в соответствии со словарем Уильямса, поскольку оно определяет биосовместимость только как отсутствие реакции хозяина и не включает какие-либо желаемые или положительные взаимодействия между тканью хозяина и биоматериалами.
- Это также называется «определением Уильямса» или «определением Уильяма».[12] Это было определено в Европейское общество биоматериалов Consensus Conference I и его легче найти в «Словаре биоматериалов Уильямса».
- В ASTM не рекомендуется согласно словарю Уильямса, поскольку он относится только к локальным тканевым реакциям на животных моделях.
- Четвертый - это расширение или, скорее, более точная версия первого определения, в котором отмечается как низкая токсичность, так и необходимость учитывать различные требования между различными медицинскими применениями одного и того же материала.
Все эти определения относятся к материалам, а не к устройствам. Это недостаток, поскольку многие медицинские устройства изготовлены из более чем одного материала. Большая часть доклинических испытаний материалов проводится не на устройствах, а на самом материале. Но на определенном этапе испытания должны будут включать устройство, поскольку форма, геометрия, обработка поверхности и т. Д. Устройства также будут влиять на его биосовместимость.
«Биосовместимый»
В литературе довольно часто встречается форма прилагательного «биосовместимый». Однако, согласно определению Уильямса, это не имеет никакого смысла, потому что биосовместимость зависит от контекста, то есть гораздо больше, чем просто сам материал, будет определять клинический результат медицинского устройства, частью которого является биоматериал. Это также указывает на один из недостатков нынешнего определения, поскольку медицинское устройство обычно изготавливается из более чем одного материала.
Металлические стекла на основе магния с добавлением цинка и кальция испытаны как потенциальные биосовместимые металлические биоматериалы для биоразлагаемых медицинских имплантатов.[13]
Биосовместимость (или тканевая совместимость) описывает способность материала действовать с соответствующей реакцией хозяина при применении по назначению. Биосовместимый материал не может быть полностью «инертным»; на самом деле решающее значение имеет уместность ответа хозяина. [14]
Предлагаемые дополнительные определения
Объем первого определения настолько широк, что Д. Уильямс попытался найти подходящие подгруппы приложений, чтобы иметь возможность дать более узкие определения. В статье MDT от 2003 года были выбраны супгруппы и их определения:
- Биосовместимость длительного имплантированные устройства
- Биосовместимость долгосрочного имплантируемого медицинского устройства относится к способности устройства выполнять свою предполагаемую функцию с желаемой степенью включения в хозяина, не вызывая каких-либо нежелательных местных или системных эффектов у этого хозяина.
- Биосовместимость краткосрочных имплантируемых устройств
- Биосовместимость медицинского устройства, которое намеренно помещается в сердечно-сосудистую систему для временных диагностических или терапевтических целей, относится к способности устройства выполнять свою предполагаемую функцию в потоке крови с минимальным взаимодействием между устройством и кровью, которое отрицательно влияет на производительность устройства. и без индукции неконтролируемой активации каскадов клеточных белков или белков плазмы.
- Биосовместимость тканевая инженерия товары
- Биосовместимость каркаса или матрицы для продуктов тканевой инженерии относится к способности действовать в качестве субстрата, который будет поддерживать соответствующую клеточную активность, включая облегчение молекулярных и механических систем передачи сигналов, для оптимизации регенерации ткани, не вызывая каких-либо нежелательных эффектов в этих клетках или индукции каких-либо нежелательных местных или системных ответов у возможного хозяина.
В этих определениях понятие биосовместимости относится к устройствам, а не к материалам, по сравнению с тремя основными определениями. 15–16 сентября 2005 г. в Сорренто прошла консенсусная конференция по определениям биоматериалов.[15]
Смотрите также
- Биосовместимый материал
- Биоматериал
- Медицинский прибор
- ISO 10993
- Медицинский имплант
- Медицинский силикон
- Муциновые покрытия подчелюстной кости крупного рогатого скота
- Биосовместимость титана
Рекомендации
- Сноски
- Примечания
- ^ «Биологические характеристики материалов», Джонатан Блэк, 2006 г., ISBN 0-8493-3959-6
- ^ Соображения по оценке биосовместимости медицинских изделий, Каммула и Моррис, Медицинское оборудование и диагностическая промышленность, май 2001 г.
- ^ «Тестирование биосовместимости in vitro биоматериалов и медицинских устройств», У. Мюллер, Технология медицинских устройств, март 2008 г.
- ^ «Оценка безопасности биосовместимости медицинских устройств: FDA / ISO и японские рекомендации». Mddionline.com. Архивировано из оригинал 29 ноября 2014 г.. Получено 20 ноября 2014.
- ^ Решетов, И. В .; Старцева, О. И .; Истранов, А.Л .; Ворона, Б. Н .; Люндуп, А. В .; Гуляев, И. В .; Мельников, Д. В .; Штанский, Д. В .; Шевейко, А. Н. (2016). «Трехмерная биосовместимая матрица для реконструктивной хирургии». Материалы конференции AIP. 1760 (1): 020056. Bibcode:2016AIPC.1760b0056R. Дои:10.1063/1.4960275. ISSN 0094-243X.
- ^ а б c Верт, Мишель (2012). «Терминология для биорелированных полимеров и приложений (Рекомендации IUPAC 2012)» (PDF). Чистая и прикладная химия. 84 (2): 377–410. Дои:10.1351 / PAC-REC-10-12-04.
- ^ Хомси, Чарльз (1970). «Биосовместимость при выборе материалов для имплантации». Журнал исследований биомедицинских материалов. 4 (3): 341–356. Дои:10.1002 / jbm.820040306. PMID 5469182.
- ^ а б Уильямс, Дэвид Ф. (2008). «О механизмах биосовместимости». Биоматериалы. 29 (20): 2941–2953. Дои:10.1016 / j.biomaterials.2008.04.023. PMID 18440630.
- ^ Медицинский словарь Дорланда
- ^ Словарь биоматериалов Уильямса, Д.Ф. Уильямс, 1999, ISBN 0-85323-921-5
- ^ Международный словарь по медицине и биологии, Э. Л. Беккер, С. И. Ландау и А. Мануила, 1986, Нью-Йорк: Wiley.
- ^ Уильямс, Д. (октябрь 2003 г.). «Возвращаясь к определению биосовместимости». Технология медицинского оборудования. 14 (8): 10–3. PMID 14603712.
- ^ Новосельски Р., Цезарь-Андрачке К., Сакевич П., Мацей А., Якобик-Колон А., Бабилас Р., Коррозия биосовместимых объемных металлических стекол Mg66 + XZn30-XCa4 (X = 0,2), Arch. Металл. Mater. 2016 т. 61 вып. 2, с. 807-810, г.
- ^ SCHMALZ, G; АРЕНХОЛЬТ-БИНДСЛЕВ, Д. Биосовместимость стоматологических материалов. Германия: Springer, 2009 г.
- ^ [1] В архиве 6 февраля 2005 г. Wayback Machine
