Апротинин - Aprotinin - Wikipedia
 | |
| Клинические данные | |
|---|---|
| Другие имена | Тразилол, бычий ингибитор трипсина поджелудочной железы |
| AHFS /Drugs.com | Монография |
| Беременность категория |
|
| Зависимость обязанность | Никто |
| Маршруты администрация | Внутривенно |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Биодоступность | 100% (внутривенный ) |
| Идентификаторы | |
| |
| Количество CAS | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| ECHA InfoCard | 100.029.983 |
| Химические и физические данные | |
| Формула | C284ЧАС432N84О79S7 |
| Молярная масса | 6511.51 г · моль−1 |
| | |
Наркотик апротинин (Тразилол, ранее Байер и теперь Nordic Group Pharmaceuticals), это небольшой протеин ингибитор трипсина поджелудочной железы крупного рогатого скота (БПТИ), или же основной ингибитор трипсина поджелудочной железы крупного рогатого скота, что является антифибринолитик молекула, которая подавляет трипсин и родственные протеолитические ферменты. Под торговой маркой Тразилол, апротинин использовался как медикамент управляется инъекция уменьшить кровотечение во время комплекса хирургия, например, операции на сердце и печени. Его основной эффект - замедление фибринолиз, процесс, который приводит к разрушению тромбов. Целью его использования было снижение потребности в переливание крови во время операции, а также повреждения органов-мишеней из-за гипотония (низкое кровяное давление) в результате значительной кровопотери. В 2007 году препарат был временно отменен во всем мире после того, как исследования показали, что его использование увеличивает риск осложнений или смерти;[1] это было подтверждено последующими исследованиями. Продажи тразилола были приостановлены в мае 2008 г., за исключением очень ограниченного использования в исследованиях. В феврале 2012 г. Европейское агентство по лекарствам (EMA) научный комитет вернул свою прежнюю точку зрения относительно апротинина и рекомендовал отменить приостановку.[2] Nordic стала дистрибьютором апротинина в 2012 году.[3]
Химия
| Ингибитор трипсина поджелудочной железы крупного рогатого скота | |||||||
|---|---|---|---|---|---|---|---|
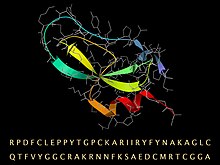 Последовательность BPTI с ее свернутой трехмерной структурой, представленной лентой для вторичной структуры и палкой-моделью (серая) для магистрали и боковых цепей. | |||||||
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | PTI | ||||||
| Entrez | 404172 | ||||||
| PDB | 4ПТИ Больше структур | ||||||
| RefSeq (мРНК) | NM_001001554 | ||||||
| RefSeq (Prot) | NP_001001554 | ||||||
| UniProt | P00974 | ||||||
| Прочие данные | |||||||
| Хромосома | 13: 75.02 - 75.03 Мб | ||||||
| |||||||
Апротинин - мономерный (одноцепочечный) глобулярный полипептид получено из легочной ткани крупного рогатого скота. Оно имеет молекулярный вес из 6512 и состоит из 16 различных аминокислота типы, расположенные в цепочку длиной 58 остатков[4][5] который сворачивается в стабильную компактную третичную структуру типа «small SS-rich», содержащую 3 дисульфида, скрученную β-шпильку и C-конец α-спираль.[6]
Аминокислотная последовательность бычьего BPTI представляет собой RPDFC LEPPY TGPCK ARIIR YFYNA KAGLC QTFVY GGCRA KRNNF KSAED CMRTC GGA.[7] Есть 10 положительно заряженных боковых цепей лизина (K) и аргинина (R) и только 4 отрицательных аспартата (D) и глутамата (E), что делает белок сильно базовый, что составляет базовый в его имени. (Из-за обычного исходного организма BPTI иногда называют бык ингибитор панкреатического трипсина.)
Высокая стабильность молекулы обусловлена 3 дисульфидные связи связывая 6 цистеин члены цепи (Cys5-Cys55, Cys14-Cys38 и Cys30-Cys51).[8] Длинный, основной лизин Боковая цепь 15 на открытой петле (вверху слева на изображении) очень плотно связывается в кармане специфичности в активном центре трипсина и ингибирует его ферментативное действие. BPTI синтезируется как более длинная последовательность-предшественник, которая сворачивается и затем расщепляется до зрелой последовательности, указанной выше.
BPTI - классический представитель семейства белков Типа Куница ингибиторы сериновой протеазы. Его физиологические функции включают в себя защитное ингибирование основного пищеварительного фермента трипсина, когда вырабатываются небольшие количества, путем расщепления предшественника трипсиногена во время хранения в поджелудочной железе.
Механизм действия препарата
Апротинин - это конкурентный ингибитор из нескольких сериновые протеазы, конкретно трипсин, химотрипсин и плазмин в концентрации около 125000 МЕ / мл, и калликреин при 300000 МЕ / мл.[5] Его действие на калликреин приводит к торможению образования фактор XIIa. В результате подавляются как внутренний путь коагуляции, так и фибринолиз. Его действие на плазмин самостоятельно замедляет фибринолиз.[4]
Эффективность препарата
В кардиохирургии с высоким риском значительной кровопотери апротинин значительно снижает кровотечение, смертность и продолжительность госпитализации.[5] О положительных эффектах сообщалось также при ортопедической хирургии высокого риска.[5] В трансплантация печени, первоначальные сообщения о пользе были омрачены опасениями по поводу токсичности.[9]
В метаанализ проведенных в 2004 г., потребность в переливании крови снизилась на 39% в шунтирование коронарной артерии (АКШ) хирургия.[10] В ортопедической хирургии также было подтверждено уменьшение количества переливаний крови.[11]
Безопасность лекарств
Были опасения по поводу безопасности апротинина.[5] Анафилаксия (тяжелая аллергическая реакция) возникает со скоростью 1: 200 при первом использовании, но серология (измерение антител против апротинина в крови) на практике не проводится для прогнозирования риска анафилаксии, поскольку правильная интерпретация этих тестов затруднена.[5]
Тромбоз, предположительно из-за сверхактивного ингибирования фибринолитической системы, может происходить с большей скоростью, но до 2006 г. доказательства этой связи были ограничены.[5][10] Точно так же, хотя биохимические показатели почечной функции иногда ухудшались, не было никаких доказательств того, что это сильно влияло на исходы.[5] Исследование, проведенное на кардиохирургических пациентах в 2006 г., показало, что действительно существует риск острая почечная недостаточность, инфаркт миокарда и сердечная недостаточность, а также Инсульт и энцефалопатия.[12] Авторы исследования рекомендуют более старые антифибринолитики (такие как транексамовая кислота ), в которых эти риски не были задокументированы.[12] Эта же группа обновила свои данные в 2007 году и продемонстрировала аналогичные результаты.[13]
В сентябре 2006 г. компания Bayer A.G. была обвинена FDA в том, что она не раскрыла во время дачи показаний существование ретроспективного исследования 67 000 пациентов, 30 000 из которых получали апротинин, а остальные - другие антифибринолитики. Исследование показало, что апротинин несет больший риск. FDA было уведомлено об исследовании одним из вовлеченных исследователей. Хотя FDA опубликовало заявление об обеспокоенности, оно не изменило своей рекомендации о том, что препарат может принести пользу определенным подгруппам пациентов.[14] В информационном бюллетене общественного здравоохранения от 3 октября 2006 г. FDA рекомендовало «врачам рассмотреть возможность ограничения использования тразилола теми ситуациями, в которых клиническая польза от снижения кровопотери необходима для медицинского лечения и перевешивает потенциальные риски» и внимательно следить за пациентами.[15]
25 октября 2007 г. FDA опубликовало заявление о рандомизированном исследовании «Консервация крови с помощью антифибринолитиков» (BART) в популяции кардиохирургических пациентов. Предварительные результаты показывают, что по сравнению с другими антифибринолитическими препаратами (эпсилон-аминокапроновая кислота и транексамовая кислота) апротинин может повышать риск смерти.[16] 29 октября 2006 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов выпустило предупреждение, что апротинин может иметь серьезную токсичность для почек и сердечно-сосудистой системы. Производитель, Bayer, сообщил FDA, что дополнительные исследования показали, что он может увеличить вероятность смерти, серьезного повреждения почек, застойной сердечной недостаточности и инсультов. FDA предупредило клиницистов об ограничении использования тех ситуаций, когда клиническая польза от снижения кровопотери имеет важное значение для медицинского лечения и перевешивает потенциальные риски.[17] 5 ноября 2007 г. компания Bayer объявила об отмене апротинина из-за канадского исследования, которое показало, что он увеличивает риск смерти при использовании для предотвращения кровотечения во время операции на сердце.[18]
В двух исследованиях, опубликованных в начале 2008 г., сравнивали апротинин с аминокапроновая кислота, обнаружили, что смертность увеличилась на 32[19] и 64%,[20] соответственно. Одно исследование показало повышенный риск потребности в диализе и реваскуляризации.[20]
Нет случаев губчатая энцефалопатия Сообщалось о передаче через апротинин, хотя препарат был отменен в Италии из-за опасений по этому поводу.[5]
Использование in vitro
Небольшие количества апротинина могут быть добавлены в пробирки со взятой кровью, чтобы обеспечить лабораторные измерения некоторых быстро разлагаемых белков, таких как глюкагон.
В клеточной биологии апротинин используется как ингибитор фермента предотвратить белок деградация в течение лизис или же гомогенизация клеток и тканей.
Апротинин можно пометить изотиоцианатом флуоресцеина. Конъюгат сохраняет свои антипротеолитические и углеводсвязывающие свойства.[21] и использовался в качестве флуоресцентного гистохимического реагента для окрашивания гликоконъюгатов (слизистых веществ), богатых уроновой или сиаловой кислотами.[22]
История
Первоначально названный «инактиватором калликреина», апротинин был впервые выделен из коровы. околоушные железы в 1930 г.[23] и независимо как ингибитор трипсина из поджелудочной железы крупного рогатого скота в 1936 г.[24] Он был очищен из легкого крупного рогатого скота в 1964 году.[25] Поскольку он ингибирует ферменты поджелудочной железы, он первоначально использовался для лечения острый панкреатит, при котором разрушение железы ее собственными ферментами считается частью патогенеза.[26] Его использование в большой хирургии началось в 1960-х годах.[27]
BPTI - один из наиболее тщательно изученных белков с точки зрения структурная биология, экспериментальная и вычислительная динамика, мутагенез и складной путь. Это была одна из самых первых кристаллических структур белка, решенных в 1970 году в лаборатории Роберт Хубер,[28] и его субстратоподобный режим взаимодействия был расшифрован в контексте бычьего трипсинового комплекса в 1974 году.[29] Позже он также стал известен как первый белок, структура определяется по ЯМР-спектроскопия, в лаборатории Курт Вутрих в ETH в Цюрихе в начале 1980-х.[30][31]
Поскольку это небольшой стабильный белок, структура которого была определена с высоким разрешением к 1975 году,[32] это была первая макромолекула, представляющая научный интерес, которую можно было смоделировать с помощью молекулярная динамика вычисление, в 1977 г. Дж. Эндрю МакКэммон и Брюс Гелин, в Karplus группа в Гарварде.[33] Это исследование подтвердило тогда удивительный факт, обнаруженный в работе ЯМР.[34] что даже хорошо упакованные ароматические боковые цепи внутри стабильного белка могут довольно быстро переворачиваться (шкала времени от микросекунд до миллисекунд). Константы скорости были определены с помощью ЯМР для водородного обмена отдельных пептидных NH-групп вдоль цепи в диапазоне от слишком быстрого для измерения на наиболее открытой поверхности до многих месяцев для наиболее скрытых водородно-связанных групп в центре β-слоя, и эти значения также довольно хорошо коррелируют со степенью движения, наблюдаемой при динамическом моделировании.
BPTI сыграла важную роль в развитии знаний о процессе сворачивание белка, самосборка полипептидной цепи в определенное расположение в 3D. Было показано, что проблема достижения правильного спаривания среди 6 боковых цепей Cys является особенно сложной для двух скрытых, близко расположенных SS рядом с концами цепи BPTI, что требует ненативного промежуточного соединения для сворачивания зрелой последовательности. in vitro (Позже было обнаружено, что последовательность предшественника сворачивается легче in vivo). BPTI было изображением на обложке сборника по сворачиванию белков Томаса Крейтона в 1992 году.[35]
Текущие результаты
Одно научное исследование на крысах показало, что лечение апротинином предотвращает нарушение гематоэнцефалического барьера во время С. neoformans инфекционное заболевание.[36] Другое исследование клеточных культур предполагает, что препарат подавляет репликацию SARS-CoV-2.[37]
Рекомендации
- ^ «Байер временно приостанавливает глобальный маркетинг тразилола» (PDF) (Пресс-релиз). Trasylol.com. 2007-11-05. Архивировано из оригинал (PDF) на 2011-07-17. Получено 2007-12-03.
- ^ «Европейское агентство по лекарствам рекомендует отменить суспензию апротинина». Европейское агентство по лекарственным средствам. 2012-02-17.
- ^ «Nordic Group приобретает права на Trasylol® у Bayer HealthCare». The Nordic Group B.V. Архивировано с оригинал 1 февраля 2014 г.. Получено 28 января 2014.
- ^ а б Маннуччи PM (июль 1998 г.). «Гемостатические препараты». Медицинский журнал Новой Англии. 339 (4): 245–53. Дои:10.1056 / NEJM199807233390407. PMID 9673304.
- ^ а б c d е ж грамм час я Махди AM, Вебстер Н.Р. (декабрь 2004 г.). «Периоперационные системные кровоостанавливающие средства». Британский журнал анестезии. 93 (6): 842–58. Дои:10.1093 / bja / aeh227. PMID 15277296.
- ^ Ричардсон Дж. С. (1981). «Анатомия и таксономия структуры белка». Достижения в химии белков Том 34. Успехи в химии белков. 34. С. 167–339. Дои:10.1016 / S0065-3233 (08) 60520-3. ISBN 978-0-12-034234-1. PMID 7020376.
- ^ Касселл Б., Радичевич М., Ансфилд М.Дж., Ласковски М. (январь 1965 г.). «Основной ингибитор трипсина бычьей поджелудочной железы. IV. Линейная последовательность из 58 аминокислот». Сообщения о биохимических и биофизических исследованиях. 18 (2): 255–8. Дои:10.1016 / 0006-291X (65) 90749-7. PMID 14282026.
- ^ Kassell B, Laskowski M (август 1965). «Основной ингибитор трипсина бычьей поджелудочной железы. V. Дисульфидные связи». Сообщения о биохимических и биофизических исследованиях. 20 (4): 463–8. Дои:10.1016 / 0006-291X (65) 90601-7. PMID 5860161.
- ^ Xia VW, Steadman RH (январь 2005 г.). «Антифибринолитики при ортотопической трансплантации печени: текущее состояние и противоречия». Трансплантация печени. 11 (1): 10–8. Дои:10.1002 / lt.20275. PMID 15690531.
- ^ а б Седракян А., Сокровище Т, Элефтериадес Я.А. (сентябрь 2004 г.). «Влияние апротинина на клинические исходы операции по аортокоронарному шунтированию: систематический обзор и метаанализ рандомизированных клинических испытаний». Журнал торакальной и сердечно-сосудистой хирургии. 128 (3): 442–8. Дои:10.1016 / j.jtcvs.2004.03.041. PMID 15354106.
- ^ Шига Т., Вадзима З., Иноуэ Т., Сакамото А. (декабрь 2005 г.). «Апротинин в большой ортопедической хирургии: систематический обзор рандомизированных контролируемых исследований». Анестезия и анальгезия. 101 (6): 1602–7. Дои:10.1213 / 01.ANE.0000180767.50529.45. PMID 16301226. S2CID 33762135.
- ^ а б Mangano DT, Tudor IC, Dietzel C (январь 2006 г.). «Риск, связанный с апротинином в кардиохирургии». Медицинский журнал Новой Англии. 354 (4): 353–65. Дои:10.1056 / NEJMoa051379. PMID 16436767.
- ^ Mangano DT, Miao Y, Vuylsteke A, Tudor IC, Juneja R, Filipescu D, et al. (Февраль 2007 г.). «Смертность, связанная с апротинином в течение 5 лет после операции аортокоронарного шунтирования». JAMA. 297 (5): 471–9. Дои:10.1001 / jama.297.5.471. PMID 17284697.
- ^ Харрис Дж. (30 сентября 2006 г.). "F.D.A. утверждает, что Bayer не удалось раскрыть результаты исследования риска наркотиков - New York Times". Нью-Йорк Таймс. Получено 2007-11-05.
- ^ «Факты и сравнения: информационные бюллетени по поводу трасилола для общественного здравоохранения». Получено 2007-11-05.
- ^ Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. «Раннее сообщение о продолжающемся обзоре безопасности инъекции апротинина (продается как тразилол)». В архиве из оригинала 30.10.2007. Получено 2007-10-28.CS1 maint: использует параметр авторов (связь)
- ^ Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. «Информация для медицинских работников; апротинин (продается как тразилол)». В архиве с оригинала от 10.10.2006. Получено 2006-10-30.CS1 maint: использует параметр авторов (связь)
- ^ Харрис Дж (2007-11-05). «Байер прекращает выпуск препарата для кардиохирургии». Нью-Йорк Таймс. Получено 2007-11-05.
- ^ Шоу А.Д., Стаффорд-Смит М., Уайт В.Д., Филлипс-Бьют Б., Сваминатан М., Милано С. и др. (Февраль 2008 г.). «Влияние апротинина на исход после коронарного шунтирования». Медицинский журнал Новой Англии. 358 (8): 784–93. Дои:10.1056 / NEJMoa0707768. PMID 18287601.
- ^ а б Schneeweiss S, Seeger JD, Landon J, Walker AM (февраль 2008 г.). «Апротинин во время аортокоронарного шунтирования и риск смерти». Медицинский журнал Новой Англии. 358 (8): 771–83. Дои:10.1056 / NEJMoa0707571. PMID 18287600.
- ^ Стоддарт Р. В., Кернан Дж. А. (март 1973 г.). «Апротинин, белок, связывающий углеводы». Histochemie. Гистохимия. Histochimie. 34 (4): 275–80. Дои:10.1007 / BF00306299. PMID 4266832. S2CID 44549220.
- ^ Кирнан Дж. А., Стоддарт Р. В. (1973). «Апротинин с флуоресцентной меткой: новый реагент для гистохимического определения кислых слизистых веществ». Гистохимия. 34 (1): 77–84. Дои:10.1007 / BF00304309. PMID 4119444. S2CID 32032724.
- ^ Краут H, Фрей EK, Bauer E (1930). "Über die Inaktivierung des kallikreins". Z Physiol Chem Хоппе-Зейлера (на немецком). 192: 1–21. Дои:10.1515 / bchm2.1930.192.1-3.1.
- ^ Куниц М., Нортроп Дж. Х. (июль 1936 г.). «Выделение из поджелудочной железы говядины кристаллического трипсиногена, трипсина, ингибитора трипсина и ингибитора соединения трипсина». Журнал общей физиологии. 19 (6): 991–1007. Дои:10.1085 / jgp.19.6.991. ЧВК 2141477. PMID 19872978.
- ^ Краут Х, Бхаргава Н (1964). "Versuche zur Isolierung des Kallikrein-Inaktivators aus Rinderlunge и seine Identifizierung mit dem Inaktivator aus Rinderparotis" [Эксперименты по выделению инактиватора калликрейна. V. Выделение инактиватора калликреина из легкого крупного рогатого скота и его идентификация с ингибитором из околоушной железы крупного рогатого скота. Hoppe-Seyler's Zeitschrift für Physiologische Chemie (на немецком). 338: 231–7. Дои:10.1515 / bchm2.1964.338.1-2.231. PMID 14330402.
- ^ Наджент Ф.В., Уоррен К.В., Джонассон Х., Гарсиадепаредес Г. (ноябрь 1964 г.). «Ранний опыт применения тразилола в лечении острого панкреатита». Южный медицинский журнал. 57 (11): 1317–21. Дои:10.1097/00007611-196411000-00012. PMID 14195953. S2CID 5286289.
- ^ Тайс Д.А., Уорт М.Х., Клаусс Р.Х., Рид Г.Х. (июль 1964 г.). «Подавление тразилолом фибринолитической активности, связанной с сердечно-сосудистыми операциями». Хирургия, гинекология и акушерство. 119: 71–4. PMID 14179354.
- ^ Хубер Р., Кукла Д., Рюльманн А., Эпп О., Форманек Х. (август 1970 г.). «Основной ингибитор трипсина бычьей поджелудочной железы. I. Анализ структуры и конформации полипептидной цепи». Die Naturwissenschaften. 57 (8): 389–92. Bibcode:1970NW ..... 57..389H. Дои:10.1007 / BF00599976. PMID 5447861. S2CID 6261274.
- ^ Хубер Р., Кукла Д., Боде В., Швагер П., Бартельс К., Дайзенхофер Дж., Штайгеманн В. (октябрь 1974 г.). «Структура комплекса, образованного бычьим трипсином и бычьим ингибитором трипсина поджелудочной железы. II. Кристаллографическое уточнение с разрешением 1,9 A». Журнал молекулярной биологии. 89 (1): 73–101. Дои:10.1016/0022-2836(74)90163-6. PMID 4475115.
- ^ Вагнер Г., Вютрих К. (март 1982 г.). «Последовательные резонансные отнесения в спектрах ядерного магнитного резонанса белка 1H. Основной ингибитор панкреатического трипсина». Журнал молекулярной биологии. 155 (3): 347–66. Дои:10.1016/0022-2836(82)90009-2. PMID 6176717.
- ^ Гавел Т.Ф., Вютрих К. (март 1985 г.). «Оценка совместного использования ядерного магнитного резонанса и дистанционной геометрии для определения конформации белков в растворе». Журнал молекулярной биологии. 182 (2): 281–94. Дои:10.1016/0022-2836(85)90346-8. PMID 2582141.
- ^ Deisenhofer J, Steigemann W (1975). «Кристаллографическое уточнение структуры бычьего ингибитора трипсина поджелудочной железы при разрешении 1,5 ангстрем» (PDF). Acta Crystallographica B. 31: 238. Дои:10.1107 / S0567740875002415.
- ^ Маккаммон Дж. А., Гелин Б. Р., Карплюс М (июнь 1977 г.). «Динамика свернутых белков». Природа. 267 (5612): 585–90. Bibcode:1977Натура.267..585М. Дои:10.1038 / 267585a0. PMID 301613. S2CID 4222220.
- ^ Вютрих К., Вагнер Г. (февраль 1975 г.). «ЯМР-исследования динамики остатков ароматических аминокислот в основном ингибиторе трипсина поджелудочной железы». Письма FEBS. 50 (2): 265–8. Дои:10.1016/0014-5793(75)80504-7. PMID 234403. S2CID 46084481.
- ^ Creighton TE (1992). Сворачивание белков. В. Х. Фриман. ISBN 978-0-7167-7027-5.
- ^ Сюй CY, Чжу Х.М., Ву Дж.Х., Вэнь Х., Лю CJ (февраль 2014 г.). «Повышенная проницаемость гематоэнцефалического барьера опосредуется сериновой протеазой во время криптококкового менингита». Журнал международных медицинских исследований. 42 (1): 85–92. Дои:10.1177/0300060513504365. PMID 24398759.
- ^ Бойкова, Дениса; Бехтель, Марко; Маклафлин, Кэти-Мэй; McGreig, Jake E .; Кланн, Кевин; Беллингаузен, Карла; Роде, Гернот; Джонигк, Дэнни; Браубах, Питер; Цизек, Сандра; Мюнх, Кристиан; Wass, Mark N .; Михаэлис, Мартин; Cinatl, Jindrich (2020). «Апротинин подавляет репликацию SARS-CoV-2». Клетки. 9 (11): 2377. Дои:10.3390 / ячейки9112377. ISSN 2073-4409.
