Антимицин - Antimycin
Антимицины продуцируются как вторичные метаболиты Streptomyces бактерии, почвенные бактерии. Эти специализированные метаболиты, вероятно, убивают соседние организмы, чтобы обеспечить бактериям Streptomyces конкурентное преимущество.[1]
Химические структуры



Биосинтез

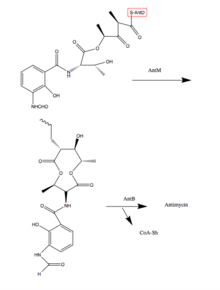
Антимицины производятся сборочным комплексом нерибосомальной пептидной синтетазы (NRPS) / поликетидсинтазы (PKS), который действует как сборочная линия для производства антимицина. Сборка генетически кодируется семейством генов муравьев. Для сборки требуется 14 белков AntBCDEFGHIJKLMNO, которые перемещают промежуточные продукты по сборочной линии через серию переэтерификации, кето-снижение, тиоляции (добавление серосодержащей группы), конденсаты, и аденилирование.[2] Последние два шага с участием AntB и AntO - это шаги адаптации. Следующие шаги химически описывают, что делают ферменты муравьев для синтеза антимицина. Синтез начинается с триптофана, аминокислоты.
1. В индольное кольцо триптофана, аминокислоты, открывается триптофан-2,3-диоксигнеазой, AntN, с образованием N-формил-L-кинуренина.[3]
2. N-формил-L-кинуренин превращается в антранилат по конкретному пути кинурениназа, AntP.[3]
3. Антранилат активируется ацил-КоА лигаза белок, AntF и загруженный на его родственный белок-носитель, AntG, для дальнейшей обработки.[3]
4. Антранилат превращается в 3-аминосалицилат многокомпонентным оксигеназа, AntHIJKL.[3]
5. 3-Аминосалицилат представлен в NRPS, AntC. AntC имеет два модуля, которые организованы как конденсация1 (C1) -аденилирование1 (A1) -тиолирование1 (T1) -конденсация2 (C2) -аденилирование2 (A2) -кеторедукция (KR) -тиолирование2 (T2). Домен А1 активирует и загружает треонин, аминокислоту, на Т1, за чем следует С1-промотируемая конденсация 3-аминосалицилата и треонина. Домен A2 активируется и загружается пируват на Т2. Пируват восстанавливается доменом KR и конденсируется с треонином с помощью C2. [1]
6. Кетосинтаза домен PKS катализирует декарбоксилатная конденсация между аминоацилом тиоэфир присоединенный к домену AntC T2 и 2-карбоксиацильный фрагмент, присоединенный к домену белка-носителя ацетила AntD.[1]
7. AntM катализирует восстановление β-кетогруппы, которая предшествует TE-домену AntD - способствует высвобождению девятичленного дилактон [1]
8. Гомолог липазы, AntO, и ацилтрансфераза гомолог, AntB, катализируют установку N-формильной группы и переэтерификацию гидроксильной группы C-8, соответственно, что приводит к образованию остова семейства антимицина.[1]
Рекомендации
- ^ а б c d е Сейпке, Райан Ф.; Хатчингс, Мэтью I (2013). «Регуляция и биосинтез антимицинов». Журнал органической химии Бейльштейна. 9: 2556–2563. Дои:10.3762 / bjoc.9.290. ISSN 1860-5397. ЧВК 3869250. PMID 24367419.
- ^ Ян, Ян; Чжан, Лихан; Ито, Такуя; Цюй, Сюйдун; Асакава, Ёсинори; Авакава, Такаяоши; Абэ, Икуро; Лю, Вэнь (2012). «Биосинтетический путь для высокого структурного разнообразия общего дилактонового ядра в производстве антимицина». Органические буквы. 14 (16): 4142–4145. Дои:10.1021 / ol301785x. ISSN 1523-7060. PMID 22861048.
- ^ а б c d Сэнди, Мориа; Руи, Чжэ; Галлахер, Джо; Чжан, Вэньцзюнь (2012). «Ферментативный синтез дилактонового каркаса антимицинов». ACS Химическая биология. 7 (12): 1956–1961. Дои:10.1021 / cb300416w. ISSN 1554-8929. PMID 22971101.
