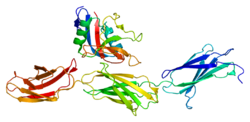
Аггрекан - Aggrecan
Аггрекан (ACAN), также известный как протеогликановый протеин, специфичный для хряща (CSPCP) или хондроитинсульфат протеогликан 1, это белок что у людей кодируется БАНКА ген.[3] Этот ген является членом лектикан (хондроитинсульфат протеогликан ) семья. Кодируемый белок является неотъемлемой частью внеклеточный матрикс в хрящевой ткани и выдерживает сжатие в хрящ.
Аггрекан - это протеогликан, или белок, модифицированный большим углеводы; то человек форма белка 2316 аминокислоты длинный и может быть выражен в нескольких изоформы из-за альтернативное сращивание.[3]
Структура
Аггрекан - высокомолекулярный (1х106
Аггрекан имеет молекулярную массу> 2500 кОм.Да.[5] Основной белок (~ 300 кДа[6]) к нему прикреплено около 100 цепей GAG.[7]
Аггрекан состоит из двух шаровидный структурные области (G1 и G2) на N-концевой конец и один глобулярный домен (G3) на C-терминал конец, разделенный большим расширенным доменом (CS), сильно модифицированным с помощью GAGs. (N-G1-G2-CS-G3-C) Два основных модифицирующих фрагмента сами расположены в различных областях, а сульфат хондроитина и кератансульфат область, край.
Три глобулярных домена, G1, G2 и G3, участвуют в агрегации, гиалуронан переплет клеточная адгезия, и хондроцит апоптоз.
Вместе с коллаген II типа, аггрекан является основным структурным компонентом хрящ, особенно суставной хрящ.
Семейство аггрекан включает других важных членов, таких как Versican, также названный PG-M, нейрокан, бревикан и рецептор НА клеточной поверхности CD44. Они представляют собой модульные протеогликаны, содержащие комбинации структурных мотивов, таких как EGF-подобные домены, углеводные домены узнавания (CRD), комплемент-связывающий белок (CBP) -подобные домены, иммуноглобулиновые складки и протеогликановые тандемные повторы.
Функция
Аггрекан является важным компонентом для структуры хряща и функции суставов.
Функционально домен G1 взаимодействует с гиалуроновой кислотой и связывающим белком, образуя стабильные тройные комплексы во внеклеточном матриксе. G2 гомологичен тандемным повторам G1 и связывающего белка и участвует в переработке продукта. G3 составляет карбоксильный конец основного белка. Он усиливает модификацию гликозаминогликанов и секрецию продуктов. Аггрекан играет важную роль в обеспечении взаимодействий хондроцит-хондроцит и хондроцит-матрикс благодаря своей способности связывать гиалуронан.[7]
Аггрекан придает межпозвонковому диску и хрящам способность выдерживать сжимающие нагрузки. Локализованные высокие концентрации аггрекана обеспечивают осмотические свойства, необходимые для нормального функционирования тканей, а ГАГ создают давление набухания, которое противодействует сжимающей нагрузке на ткань. Эта функциональная способность зависит от высокой концентрации ГАГ / аггрекана во внеклеточном матриксе ткани.[8] В диске концентрация аггрекана достигает пика в возрасте двадцати лет, а затем снижается, а продукты разложения аггрекана медленно накапливаются в течение следующих десятилетий.[9] Это приводит к тому, что диски с возрастом становятся более жесткими и менее упругими.
Аггрекан также играет важную роль в организации внеклеточных пространств между нейроны в мозг.[10] Через взаимодействие с связать белок и тенасцины, аггрекан связывается с гиалуронан, образуя крупные агрегированные комплексы на клетка поверхность.
Клиническое значение
Синтез и разложение аггрекана исследуются на предмет их роли в хрящ ухудшение при травмах суставов, заболеваниях и старении.
Линкерный домен между N-концевыми глобулярными доменами, называемый межглобулярным доменом, очень чувствителен к протеолиз. Такая деградация была связана с развитием артрит. Протеазы способные к деградации аггреканов называются агреканасы, и они являются членами АДАМ (А Дезинтегрин И Металлопротеиназа ) белковое семейство.[11]
Дегенеративное заболевание суставов является ведущим источником заболеваемости, приводящим к значительным социальным и экономическим последствиям. Остеоартроз характеризуется медленным прогрессирующим ухудшением суставной хрящ и фиброз из синовиальная оболочка и суставная капсула. Суставной хрящ содержит до 10% протеогликан по весу, большая часть которого составляет аггрекан, и его потеря является ранним признаком заболевания.
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000157766 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Doege KJ, Sasaki M, Kimura T, Yamada Y (январь 1991). «Полная кодирующая последовательность и выведенная первичная структура человеческого хряща, большой агрегации протеогликана, аггрекана. Человеческие повторы и дополнительные альтернативно сплайсированные формы». J. Biol. Chem. 266 (2): 894–902. PMID 1985970.
- ^ Nap RJ, Szleifer I (ноябрь 2008 г.). «Структура и взаимодействия аггреканов: статистический термодинамический подход». Биофиз. J. 95 (10): 4570–83. Дои:10.1529 / biophysj.108.133801. ЧВК 2576360. PMID 18689463.
- ^ Hascall, VC; Sajdera, SW (10 октября 1970 г.). «Физические свойства и полидисперсность протеогликана из носового хряща крупного рогатого скота». Журнал биологической химии. 245 (19): 4920–30. PMID 5506265.
- ^ Chandran, PL; Горкай, Ф (январь 2012). «Аггрекан, необычный полиэлектролит: обзор поведения раствора и физиологические последствия». Acta Biomaterialia. 8 (1): 3–12. Дои:10.1016 / j.actbio.2011.08.011. ЧВК 3226867. PMID 21884828.
- ^ а б Киани С., Чен Л., Ву Ю.Дж., Йи А.Дж., Ян Б.Б. (март 2002 г.). «Структура и функции аггрекана». Cell Res. 12 (1): 19–32. Дои:10.1038 / sj.cr.7290106. PMID 11942407.
- ^ Раули П., Мартенс Д., Рантакоко Дж., Алини М., Мвале Ф., Антониу Дж. (2006). «Участие полиморфизма аггрекана в дегенерации межпозвонкового диска человека и суставного хряща». Eur Cell Mater. 11: 1–7, обсуждение 7. PMID 16425147.
- ^ Сиван SS, Wachtel E, Roughley P (2014). «Структура, функция, старение и оборот аггрекана в межпозвоночном диске». Биохим. Биофиз. Acta. 1840 (10): 3181–9. Дои:10.1016 / j.bbagen.2014.07.013. PMID 25065289.
- ^ Моравски М., Брюкнер Г., Арендт Т., Мэтьюз Р. Т. (май 2012 г.). «Аггрекан: за пределы хряща и в мозг». Международный журнал биохимии и клеточной биологии. 44 (5): 690–3. Дои:10.1016 / j.biocel.2012.01.010. PMID 22297263.
- ^ Восточный CJ, Стэнтон H, Голуб С.Б., Роджерсон FM, Fosang AJ (2007). «Дефицит ADAMTS-5 не блокирует агреканолиз в предпочтительных сайтах расщепления в богатой хондроитинсульфатом области аггрекана». J. Biol. Chem. 282 (12): 8632–40. Дои:10.1074 / jbc.M605750200. PMID 17255106.
дальнейшее чтение
- Ватанабе Х, Ямада Й, Кимата К. (1998). «Роли аггрекана, большого протеогликана хондроитинсульфата, в структуре и функции хряща». J. Biochem. 124 (4): 687–93. Дои:10.1093 / oxfordjournals.jbchem.a022166. PMID 9756610.
- Fosang AJ, Neame PJ, Last K, Hardingham TE, Murphy G, Hamilton JA (1992). «Межглобулярный домен аггрекана хряща расщепляется PUMP, желатиназами и катепсином B». J. Biol. Chem. 267 (27): 19470–4. PMID 1326552.
- Сэнди Дж. Д., Фланнери CR, Ним П. Дж., Ломандер Л. С. (1992). «Структура фрагментов аггрекана в синовиальной жидкости человека. Доказательства участия в остеоартрите новой протеиназы, которая расщепляет связь Glu 373-Ala 374 межглобулярного домена». J. Clin. Вкладывать деньги. 89 (5): 1512–6. Дои:10.1172 / JCI115742. ЧВК 443022. PMID 1569188.
- Болдуин СТ, Регинато AM, Прокоп DJ (1989). «Новый эпидермальный фактор роста-подобный домен в человеческом коровом белке для большого хрящ-специфичного протеогликана. Доказательства альтернативного сплайсинга домена». J. Biol. Chem. 264 (27): 15747–50. PMID 2789216.
- Кимата К., Баррач Х. Дж., Браун К. С., Пеннипакер Дж. П. (1981). «Отсутствие протеогликана ядра в хряще от мышей cmd / cmd (дефицит хрящевого матрикса)». J. Biol. Chem. 256 (13): 6961–8. PMID 7240256.
- Глумофф В., Савонтаус М., Веханен Дж., Вуорио Е. (1994). «Анализ экспрессии генов аггрекана и тенасцина в скелетных тканях мышей путем северной гибридизации и гибридизации in situ с использованием видоспецифических зондов кДНК». Биохим. Биофиз. Acta. 1219 (3): 613–22. Дои:10.1016/0167-4781(94)90220-8. PMID 7524681.
- Илич М.З., Мок М.Т., Уильямсон О.Д., Кэмпбелл М.А., Хьюз К.Э., Хэндли С.Дж. (1995). «Катаболизм аггрекана культурами эксплантатов суставного хряща человека в присутствии ретиноевой кислоты». Arch. Biochem. Биофизы. 322 (1): 22–30. Дои:10.1006 / abbi.1995.1431. PMID 7574678.
- Валхму В.Б., Палмер Г.Д., Риверс ПА, Эбара С., Ченг Дж.Ф., Фишер С., Рэтклифф А. (1995). «Структура гена аггрекана человека: экзон-интронная организация и ассоциация с белковыми доменами». Biochem. J. 309. 309 (2): 535–42. Дои:10.1042 / bj3090535. ЧВК 1135764. PMID 7626017.
- Барри Ф. П., Ним П. Дж., Сасс Дж., Пирсон Д. (1994). «Вариации длины кератансульфатного домена аггрекана млекопитающих». Матрикс Биол. 14 (4): 323–8. Дои:10.1016 / 0945-053X (94) 90198-8. PMID 7827755.
- Fosang AJ, Last K, Neame PJ, Murphy G, Knäuper V, Tschesche H, Hughes CE, Caterson B, Hardingham TE (1994). «Нейтрофильная коллагеназа (ММР-8) расщепляет аггреканазный сайт E373-A374 в межглобулярном домене аггрекана хряща». Biochem. J. 304. 304 (2): 347–51. Дои:10.1042 / bj3040347. ЧВК 1137499. PMID 7998967.
- Fosang AJ, Last K, Knäuper V, Neame PJ, Murphy G, Hardingham TE, Tschesche H, Hamilton JA (1993). «Коллагеназы фибробластов и нейтрофилов расщепляются на двух участках в агреканском межглобулярном домене хряща». Biochem. J. 295. 295 (1): 273–6. Дои:10.1042 / bj2950273. ЧВК 1134849. PMID 8216228.
- Коренберг JR, Чен XN, Doege K, Grover J, Roughley PJ (1993). «Отнесение гена аггрекана человека (AGC1) к 15q26 с использованием флуоресцентного гибридизационного анализа in situ». Геномика. 16 (2): 546–8. Дои:10.1006 / geno.1993.1228. PMID 8314595.
- Дудия Дж., Дэвидсон С.М., Wells TM, Vynios DH, Hardingham TE, Bayliss MT (1996). «Возрастные изменения содержания С-концевой области аггрекана в суставном хряще человека». Biochem. J. 313. 313 (3): 933–40. Дои:10.1042 / bj3130933. ЧВК 1217001. PMID 8611178.
- Fülöp C, Cs-Szabó G, Glant TT (1996). «Видоспецифический альтернативный сплайсинг эпидермального фактора роста-подобного домена 1 хрящевого аггрекана». Biochem. J. 319. 319 (3): 935–40. Дои:10.1042 / bj3190935. ЧВК 1217878. PMID 8921002.
- Киршфинк М., Блазе Л., Энгельманн С., Шварц-Альбиц Р. (1997). «Секретируемый хондроитинсульфат протеогликан линий В-клеток человека связывается с белком комплемента C1q и ингибирует образование комплекса C1». J. Immunol. 158 (3): 1324–31. PMID 9013976.
- Parkar AA, Kahmann JD, Howat SL, Bayliss MT, Day AJ (1998). «TSG-6 взаимодействует с гиалуронаном и аггреканом в зависимости от pH через общий функциональный элемент: влияние на его регуляцию в воспаленном хряще». FEBS Lett. 428 (3): 171–6. Дои:10.1016 / S0014-5793 (98) 00523-7. PMID 9654129.
- Fosang AJ, Last K, Fujii Y, Seiki M, Okada Y (1998). «ММР мембранного типа 1 (ММР-14) расщепляется по трем сайтам в межглобулярном домене аггрекана». FEBS Lett. 430 (3): 186–90. Дои:10.1016 / S0014-5793 (98) 00667-X. PMID 9688535.
- «Аггрекан». Обучающий центр. Компания Сигма-Олдрич. Получено 2011-10-24.
внешняя ссылка
- Аггрекан в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Человек БАНКА расположение генома и БАНКА страница сведений о гене в Браузер генома UCSC.
- Обзор всей структурной информации, доступной в PDB за UniProt: P16112 (Человеческий сердцевинный белок Aggrecan) в PDBe-KB.
- Обзор всей структурной информации, доступной в PDB за UniProt: P07897 (Основной белок Rat Aggrecan) в PDBe-KB.